

2022-2023学年福建省泉州市养正中学高二上学期 期中联考化学试题(Word版)
展开2022-2023学年福建省泉州市养正中学高二上学期 期中联考化学试题
考试科目:化学 满分:100分 考试时间:75分钟
命题者:
可能用到的相对原子质量:H 1 C 12 N14 O 16
一、单选题:本题共16小题,每题3分,共48分。在每小题给出的四个选项中,只有一个选项符合题目要求。
1.下列分别是利用不同能源发电的实例图像,其中不属于新能源开发利用的是( )
A.风力发电 B.太阳能发电
C.火力发电 D.地热能发电
2.根据所学知识和已有生活经验,下列变化过程中ΔS<0的是
A.NH4NO3 (s) === NH4+ (aq)+ NO3- (aq) B.H2O(s)→H2O(l)→H2O (g)
C.2CO(g) + O2(g) === 2CO2 (g) D.Mg(s)+H2SO4(aq) === MgSO4(aq)+H2(g)
3.反应A(g)+B(g)⇋C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
A.该反应的逆反应为放热反应
B.升高温度,利于A的转化率增大
C.加入催化剂时,该反应的反应热发生改变
D.增大压强,能够加快反应达到平衡状态的速率
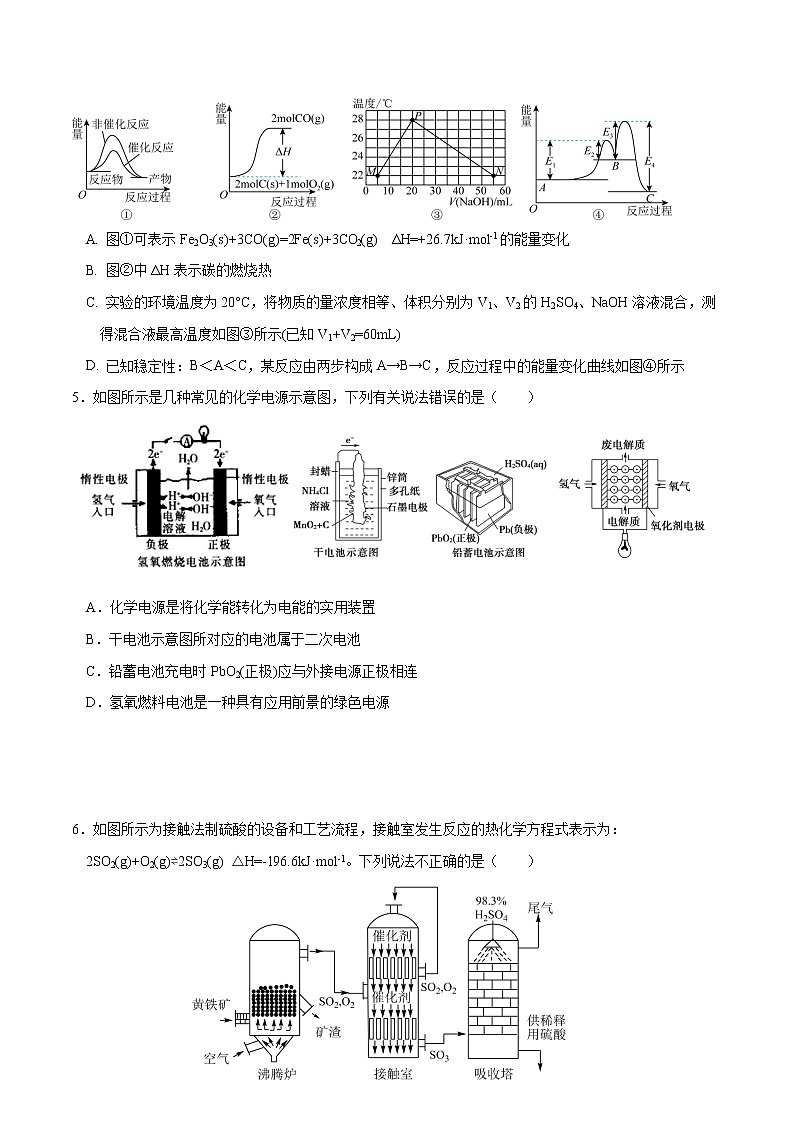
4. 下列选项正确的是( )
A. 图①可表示Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=+26.7kJ·mol-1的能量变化
B. 图②中ΔH表示碳的燃烧热
C. 实验的环境温度为20°C,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测得混合液最高温度如图③所示(已知V1+V2=60mL)
D. 已知稳定性:B<A<C,某反应由两步构成A→B→C,反应过程中的能量变化曲线如图④所示
5.如图所示是几种常见的化学电源示意图,下列有关说法错误的是( )
A.化学电源是将化学能转化为电能的实用装置
B.干电池示意图所对应的电池属于二次电池
C.铅蓄电池充电时PbO2(正极)应与外接电源正极相连
D.氢氧燃料电池是一种具有应用前景的绿色电源
6.如图所示为接触法制硫酸的设备和工艺流程,接触室发生反应的热化学方程式表示为:
2SO2(g)+O2(g)⇌2SO3(g) △H=-196.6kJ·mol-1。下列说法不正确的是( )
A.黄铁矿进入沸腾炉之前需要进行粉碎,是为了增大反应物的接触面积,加快反应速率,并且可以提高原料的转化率
B.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室
C.工业生产要求高效,为加快反应速率,接触氧化应使用催化剂并尽可能高的提高体系温度
D.工业制硫酸的尾气大量排放至空气中会形成酸雨
7.将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
A.钢铁设施表面因积累大量电子而被保护
B.钢铁设施的电极反应式为
C.金属M的活动性比Fe的活动性弱
D.钢铁设施在河水中的腐蚀速率比在海水中的快
8.下列关于反应2SO2(g)+O2(g) 2SO3(g)的描述正确的是( )
A.使用催化剂,的平衡转化率增大
B.增大浓度,平衡常数K减小
C.当时,反应达到平衡状态
D.降低反应温度,反应物中活化分子百分数减少,反应速率减慢
9.实验室利用下列实验方案探究影响化学反应速率的因素,有关说法错误的是( )
实验编号 | 温度℃ | 酸性溶液 | 溶液 |
① | 25 | 4mL 0.01mol/L | 2mL0.1mol/L |
② | 25 | 4mL 0.01mol/L | 2mL0.2mol/L |
③ | 50 | 4mL 0.01mol/L | 2mL0.1mol/L |
A.实验中要记录溶液褪色所需要的时间
B.对比实验①②探究的是浓度对化学反应速率的影响
C.对比实验①③探究的是温度对化学反应速率的影响
D.起始时向①中加入固体,不影响其反应速率
10. 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表所示,下列说法正确的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 1 | 2 | 0 |
平衡浓度/mol·L-1 | 0.5 | 0.5 | 1 |
A. Y的转化率为25% B. 反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为16
C. 反应前后压强之比为2:3 D. 增大压强,该反应平衡会正向移动,此反应的平衡常数增大
11.恒温条件下,可逆反应:2NO(g)+O2(g)⇌ 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
12. 下列事实不能用勒夏特列原理解释的是( )
A. NO2(g)+ SO2(g) SO3(g)+ NO(g),对该平衡体系加压后颜色加深
B. 在含有红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
C. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
D. 反应2SO2(g)+O2(g) 2SO3(g)△H<0中采取高压措施可提高SO3的产量
13. 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现T℃时,甲醇(CH3OH)在铜基催化剂上的反应机理如下(该反应为可逆反应):
下列有关说法正确的是( )
A. 反应I和反应Ⅱ相比,反应I更容易发生
B. 反应I为CH3OH(g)=CO(g)+2H2(g) ∆H<0
C. 通过控制催化剂的用量可以控制反应的速率和反应进行的程度
D. CH3OH(g)与H2O(g)在高温条件下更容易反应
14.废水中通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。则下列叙述错误的是( )
A.电池工作时需控制温度不宜过高
B.a极电极反应式为:+e-=+Cl-
C.b极为负极,发生氧化反应
D.H+由b极穿过质子交换膜到达a极
15.法国化学家PaulSabatier较早提出可以利用工业废弃物CO2转化为CH4,其反应原理为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) △H=-165kJ・mol-1。若在密闭容器中充入1molCO2、1mol H2引发该反应进行,下列说法正确的是( )
A | B | C | D |
恒温恒容下,混合气体中CH4与CO2的体积分数变化 | 恒温恒压条件平衡后,t1时改变条件可能是充入少量N2 | 升高温度,平衡常数Kc的变化趋势 | CO2平衡转化率随压强的变化趋势 |
A.A B.B C.C D.D
16.在容积一定的密闭容器中,充入一定量的NO和足量碳发生化学反应C(s)+2NO(g)⇌CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
A.增加碳的量,平衡正向移动
B.在T2时,若反应处于状态D,则此时v正>v逆
C.若状态B、C、D的压强分别为pB、pC、pD,则有pC=pD>pB
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
二、非选择题:本题包括4小题,共52分。
17.(14分)汽车尾气中的主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是_______,图1中对应反应的热化学方程式为________________。
(2)N2O和CO均是有害气体,可在表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
①图2中,该反应的活化能为_______,该反应的ΔH=_______;
②在反应体系中加入Pt2O+作为该反应的催化剂,则ΔH _______ (填“增大”“减小”或“不变”)。
(3)利用NH3还原法可将NOx还原为N2进行脱除。已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=﹣2070 kJ·mol-1
若有15gNO被还原,则释放的热量为______ kJ。
(4)“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
已知25℃和101kPa下:
①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g)ΔH=﹣akJ•mol﹣1
②2CO(g)+O2(g)=2CO2(g)ΔH=﹣bkJ•mol﹣1
③H2O(g)=H2O(l)ΔH=﹣ckJ•mol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为 。
18.(12分)2018年7月至9月,国家文物局在辽宁开展水下考古,搜寻、发现并确认了甲午海战北洋水师沉舰——经远舰。已知:正常海水呈弱碱性。
(1)经远舰在海底“沉睡”124年后,钢铁制成的舰体腐蚀严重。舰体发生电化学腐蚀时,负极的电极反应式为_______。
(2)为了保护文物,考古队员采用“牺牲阳极的阴极保护法”对舰船进行了处理。
①下列说法不正确的是________。
A.锌块发生氧化反应:Zn-2e-=Zn2+
B.舰体有电子流入,可以有效减缓腐蚀
C.若通过外加电源保护舰体,应将舰体与电源正极相连
D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同
②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为
_________。
(3)船上有些器皿是铜制品,表面有铜锈。
①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
下列说法正确的是________
A.疏松的Cu2(OH)3Cl属于有害锈
B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液
C.青铜器表面涂一层食盐水可以做保护层
D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”
②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为______。
(4)考古队员将舰船上的部分文物打捞出水后,采取脱盐、干燥等措施保护文物。从电化学原理的角度分析“脱盐、干燥”的防腐原理:________。
19.(12分)25℃时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据图中数据,写出该反应的化学方程式_______;此反应的平衡常数表达式K=_______。
(2)0~3min, v(C)=_____mol·L-1·min-1。
(3)在5~7 min内,若K值不变,则此处曲线变化的原因是_______。
(4)如图表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4由大到小的排序为:_______;A的转化率最大的一段时间是_______。
20.(14分)以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-51 kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+41 kJ·mol-1
①已知几种化学键的键能如下表所示,则a=_______kJ·mol-1。
化学键 | C-H | C-O | H-O | H-H | C≡O |
键能/kJ·mol-1 | 406 | 351 | 465 | 436 | a |
②若反应II逆反应活化能Ea′=124 kJ·mol-1,则该反应的正反应的活化能Ea=_______kJ·mol-1。
(2)向2L容器中充入1 mol CO2和2 mol H2,若只发生反应I,测得反应在不同压强平衡混合物中甲醇体积分数φ(CH3OH)随温度变化如图1所示,逆反应速率与容器中c(CH3OH)关系如图2所示:
①图1中P1_______P2(填“>”、“<”或“=”);
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是_______(填字母序号)。
(3)若反应II的正、逆反应速率分别可表示为v正=k正c(CO2)·c(H2)、v逆=k逆c(CO)·c(H2O),k正、k逆分别表示正、逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是_______,表示lgk逆随温度T变化关系的直线是_______。
(4)如图4所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
A.a 极连接外接电源的负极
B.b 极的电极反应式为 Cl--2e- + 2OH- === ClO- + H2O
C.电解过程中 Na+从左池移向右池
D.外电路上每转移1 mol电子,理论可催化还原标准状况下CO2气体 11.2 L
化学参考答案
一、选择题:本题共16小题,每题3分,共48分。
1-5CCDDB 6-10CADDB 11-16AADBAB
二、非选择题:本题包括4小题,共52分,每空各2分。
17. (14分)
(1) N2 N2(g)+ O2(g)=2NO(g) ΔH=+180 kJ·mol-1
(2) 134 kJ·mol-1 -226 kJ·mol-1 不变
(3) 172.5
(4)CH3OH(l)+O2(g)=CO2(g)+2H2O(l)ΔH=(﹣a﹣b﹣2c)kJ/mol
18. (12分)
(1)Fe-2e-=Fe2+
(2) ① C
②O2+4e-+2H2O=4OH-
(3) ①A
②4CuCl +O2+2H2O+2CO=2Cu2(OH)2CO3+4Cl-
(4)脱盐、干燥处理破坏了微电池中的离子导体(或电解质溶液),使文物表面无法形成微电池发生电化学腐蚀
19. (12分)
(1) A+2B⇌2C K=
(2)0.1
(3)加压
(4) K1>K2=K3=K4 t2-t3
20. (14分)
(1) ①1070 ②165
(2) ①> ② a
(3)甲 乙
(4) C
福建省泉州市安溪一中、养正中学、惠安一中、实验中学2023-2024学年高一上学期期中考化学试题: 这是一份福建省泉州市安溪一中、养正中学、惠安一中、实验中学2023-2024学年高一上学期期中考化学试题,共9页。试卷主要包含了下列关于物质分类的正确组合是,下列操作正确的是,下列关于焰色反应说法错误的是,下列叙述中,正确的是等内容,欢迎下载使用。
福建省泉州市两校2023-2024学年高二上学期12月联考化学试题: 这是一份福建省泉州市两校2023-2024学年高二上学期12月联考化学试题,文件包含泉州九中与侨光中学2023秋季高二年联考化学试题pdf、泉州九中与侨光中学2023秋季高二年联考化学参考答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
福建省漳州市正兴学校2021-2022学年高二上学期期中考试化学试题(Word版含答案): 这是一份福建省漳州市正兴学校2021-2022学年高二上学期期中考试化学试题(Word版含答案),共8页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。












