

河南省洛阳市创新发展联盟2022-2023学年高二上学期12月阶段检测化学试卷(Word版含答案)
展开
这是一份河南省洛阳市创新发展联盟2022-2023学年高二上学期12月阶段检测化学试卷(Word版含答案),共11页。试卷主要包含了请将各题答案填写在答题卡上,本试卷主要考试内容,可能用到的相对原子质量,下列化学用语表示正确的是,设NA为阿伏加德罗常数的值, 001NA等内容,欢迎下载使用。
洛阳市创新发展联盟2022-2023学年高二上学期12月阶段检测化 学考生注意:1.本试卷分选择题和非选择题两部分,共100分。考试时间90分钟。2.请将各题答案填写在答题卡上。3.本试卷主要考试内容:人教版选择性必修1。4.可能用到的相对原子质量:H1 N14 O 16 S 32 Ni 59 Cu 64 Ba 137一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。1. 发明创造为人类文明进步做出了巨大贡献。下列装置工作时,涉及的能量转化主要是化学能与电能之间的转化的是
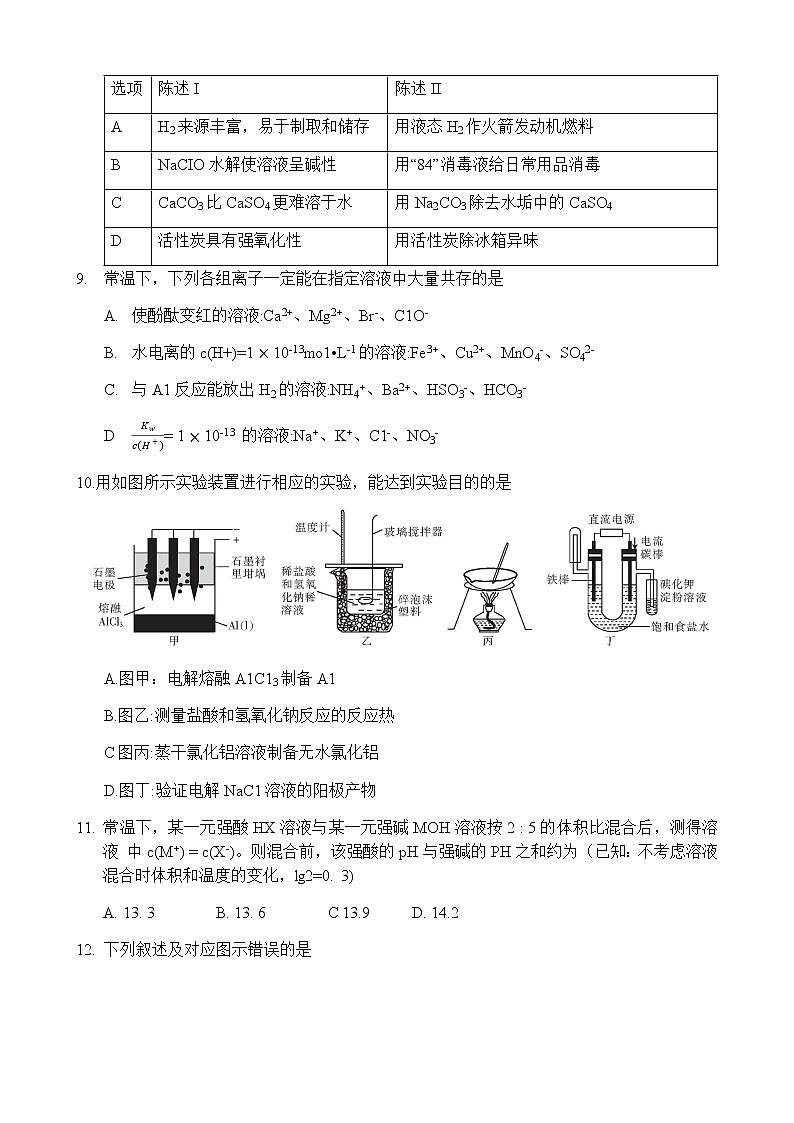
2. 炎热的夏天,湖泊水位大幅下降,这其中有水分蒸发的原因。在水蒸发形成水蒸气的过程中, 其焓变和熵变的大小正确的是A. △S<0 △H<0B. △S>0 △H>0C. △S>0 △H<0D. △S<0 △H>03. 下列物质中,属于弱电解质的有① Fe(OH)3②冰醋酸③CH4④Cu(NO3)2溶液⑤NH3 • H20⑥BaS04⑦H20 A. 3种 B. 4 种 C. 5种 D. 6种4. 已知有如下热化学方程式,下列判断错误的是① C(s)+O2 (g)=CO2 (g) △ = kJ• mol-1 ② C(s)+O2(g)=CO(g) △ = kJ• mol-1 ③ 2H2(g)+O2(g)=2H2O(g) △ = kJ• mol-1 ④ CO(g)十H2O(g) = CO2(g)十H2(g) △ = kJ• mol-1 A. B. C. =—— D. 5. 下列关于工业合成氨的叙述正确的是A.及时从反应体系中分离出氨气,有利于平衡向正反应方向移动B.催化剂能缩短反应达到平衡状态所用的时间,而压强无此作用C.工业合成氨的反应是熵增的放热反应,在任何温度下都能自发进行 D.高温、高压都能缩短反应达到平衡状态所用的时间,而只有高温有利于提高合成氨的产率6. 下列化学用语表示正确的是A.HSO3-在水中的电离方程式:HSO3-+H2OSO32-+H3O+B.SO32-在水中的水解方程式:SO32-+2H2OH2SO3 +2OH-C.表示C2H2燃烧热的热化学方程式:C2H2 (g)+O2 (g)=H2O(g) +2CO2 (g) △H=-1255.5 kJ• mol-1D.可逆反应 HCHO(g)+O2(g) H2O(1)+CO2 (g)的平衡常数:K= 7. 设NA为阿伏加德罗常数的值。下列说法正确的是A. 25℃时,1 L pH = 3 的 H2SO3 溶液中,H+ 的数目为 0. 001NAB. 0. 1mo1 • L-1 的 NH4NO3 溶液中含有 NH4+、NH3、NH3 • H2O 的总数目为0. 1NAC. 25℃时,pH=13的NaOH溶液中,水电离出的OH-的数目为10-11NA D. 99°C时,1 L pH = 7的NaOH溶液中,OH-的数目为10-7NA8. 陈述I和陈述II均正确且具有因果关系的是选项陈述I陈述IIAH2来源丰富,易于制取和储存用液态H2作火箭发动机燃料BNaCIO水解使溶液呈碱性用“84”消毒液给日常用品消毒CCaCO3比CaSO4更难溶于水用Na2CO3除去水垢中的CaSO4D活性炭具有强氧化性用活性炭除冰箱异味9. 常温下,下列各组离子一定能在指定溶液中大量共存的是A. 使酚酞变红的溶液:Ca2+、Mg2+、Br-、C1O-B. 水电离的c(H+)=110-13mo1•L-1的溶液:Fe3+、Cu2+、MnO4-、SO42-C. 与A1反应能放出H2的溶液:NH4+、Ba2+、HSO3-、HCO3-D = 110-13 的溶液:Na+、K+、C1-、NO3-10.用如图所示实验装置进行相应的实验,能达到实验目的的是 A.图甲:电解熔融A1C13制备A1 B.图乙:测量盐酸和氢氧化钠反应的反应热 C图丙:蒸干氯化铝溶液制备无水氯化铝 D.图丁:验证电解NaC1溶液的阳极产物11. 常温下,某一元强酸HX溶液与某一元强碱MOH溶液按2 : 5的体积比混合后,测得溶液 中c(M+) = c(X-)。则混合前,该强酸的pH与强碱的PH之和约为(已知:不考虑溶液混合时体积和温度的变化,lg2=0. 3)A. 13. 3 B. 13. 6 C 13.9 D. 14.212. 下列叙述及对应图示错误的是A.图甲是某温度下c(CH3COOH)+c(CH3COO-) = 0. 100 mol • L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系曲线,pH = 3的溶液中:=10-4. 75B.图乙是恒温密闭容器中发生反应CaCO3(s)=CaO(s)+CO2(g)时,c(CO2)随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积C.图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线, 时刻溶液的温度最高D.图丁是在0. 1mo1 •L-1的Na2CO3溶液中加水稀释,随着加入水的体积的增大,溶液中c(HCO3-)的变化曲线,Na2CO3的水解程度:A点小于B点13. 电化学降解NO3-的原理如图所示,下列说法正确的是A. N为电源的正极B. 电池工作时,H+通过质子交换膜从左侧移向右侧C. Pt电极上的反应式为4OH-+4e-=O2↑ +2H2OD. 每生成5. 6gN2,左右两侧溶液质量变化差为18 g14. 温度为了时,将H2 (g)和I2 (g)各1.6mol充入10L恒容密闭容器中,发生反应H2 (g)+ I2 (g)2HI(g),一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是t/min2479n(H2)/mol1.21.11.01.0A. O〜4min 的平均反应速率 (HI) = 0. 25mol • L-1 • min-1B. 时,反应的平衡常数=1.2C. 其他条件不变,若降温到T0,达到平衡时,平衡常数K0= 4,则此反应的AH<O D. 其他条件不变,9min后,向容器中再充入 6 mol H2,平衡向正反应方向移动,再次达到平衡时,H2的浓度减小,I2的转化率增大 二、非选择题:本题共4小题,共58分。15. (14分)磷能形成次磷酸(H3PO2)、亚磷酸(H3PO3)等多种含氧酸,请根据所学知识回答下 列问题:(1) 已知H3PO2溶液中存在的含磷微粒只有H2PO2-、H3PO2。① H3PO2属于 酸。② 写出将1 mol• L-1的NaOH溶液逐滴加入10 mL 1 mol • L-1H3PO2溶液中至过量时发生反应的离子方程式: __________________________。(2) 亚磷酸(H3PO3)是二元中强酸,常温下,其电离平衡常数为Kal = 5. 0 10-2、Ka2= 2. 5 -7,lg5 = 0. 7。① 常温下,0. 1mol • L-1的NaH2PO3溶液呈_____ (填“酸”或“碱”性,该溶液中含磷微粒的浓度由大到小的顺序为____________________ 。② 常温下,向0. 1mol • L-1的H3PO3溶液中滴加NaOH溶液至pH = 5,此时溶液中的c(H2PO3-)+2c(HPO32-)-c(Na+ )= (填精确值)mol • L-1。③ 常温下,将NaOH溶液滴加到亚磷酸溶液中,混合溶液的pH随lg 或
lg 变化的关系如图所示。 表示lg的是曲线______(填“I”或“II”),=_______。16. (15分)铁镍矿是一种重要的金属材料,主要用于制备铁镍合金,还用于制备镍氢电池的材 料。某铁镍矿石的主要成分是四氧化三铁和硫酸镍,还含有铜、钙、镁、硅的氧化物。由该铁镍矿石制备高纯度的氢氧化镍的工艺流程如图: 回答下列问题:(1)为提高镍的浸出率,可采取的措施有 _______。(2)“酸溶”时,所加入的试剂A是硫酸,“废渣1”的主要成分的化学式为_______ 。(3)“除铁”时H2O2的作用是_________ 。(4) “除铜”时,所用的试剂B为Na2S,反应的离子方程式为_________ 。(5) “除钙、镁”过程中形成的“废渣3”的化学式为____________ 。(6) 已知常温下Ksp[Ni(OH)2] = 2.010-15,该流程在“沉镍”过程中,需调节溶液pH约为_______ 时,Ni2+才刚好沉淀完全(离子沉淀完全的浓度<1.010-5mol • L-1,lg2≈0.30)。⑺某化学镀镜试剂的化学式为 (NH4)x Ni(SO4)y(Ni为+ 2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:I. 称量28. 7 g该镀镍试剂,配制成100mL溶液A;II. 准确量取10. 00mL溶液A,用0. 40mol • L-1的EDTA(Na2H2 Y)标准溶液滴定其中的Ni2+ (离子方程式为Ni2+ +H2Y2-=NiY2- +2H+)消耗EDTA标准溶液25. 00 mL-III.另取10. 00mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4. 66 g。① 配制100 mL溶液A时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管夕卜,还需要_____________ 。② 该镀镍试剂的化学式为_________________ 。17. (15分)CO可直接作为燃料电池的燃料,某CO燃料电池的结构如图1所示。(1) 电池工作时,电子由电极_____ (填“A”或“B”,下同)流向电极______。(2) 电极B的电极反应式为_________ ,该电池中可循环利用的物质为_______ 。(3) 纳米级Cu2O由于具有优良的催化性能而受到关注,采用CO燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图2所示。① 电极A应连接____ (填“C”或“D”),穿过阴离子交换膜的离子为_____________ 。② 当反应生成14. 4gCu2O时,图2左侧溶液_____ (填“增加”或“减少”)的质量为____g。18. (14分)消除氮氧化物的污染是当前科学研究的热点,根据所学知识回答下列问题:(1) 已知①N2(g)+O2(g)=2NO(g) △ = kJ• mol-1②C(s)的燃烧热为 △ = -bkJ• mol-1,则反应 C(s) + 2NO(g) N2 (g)+CO2 (g)的△= kJ• mol-1 (用含a(的代数式表示)。(2) 已知NO2和N2O4可以相互转化,反应2NO2(g) N2O4(g) △= kJ• mol-1 在温度一定时,平衡体系中NO2的体积分数(NO2)随压强的变化情况如图。① A、C两点的正反应速率的关系为(A)___ (填“>”、“<”或“ = ”)(C)。② A、B、C、D、E各状态, (正)> (逆)的是状态____。③ EA所需时间为,DC所需时间为,则___ (填“>”、“<”或“ = ”)。
(3) 在一定条件下,NH3可还原氮氧化物,消除氮氧化物污染。工业上,常用N2和H2在催化剂作用下合成NH3。在催化剂作用下,n(N2) : n(H2) = 1 : 3时,发生反应,平衡混合气中NH3的物质的量分数随温度和压强变化的关图所示。① 该反应的平衡常数K(a)_________ (填”<”、“=”或“>”)K(b)。② 500 ℃、压强为5p0时,H2的转化率为_____%(保留三位有效数字),KP= ______。[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压物质的量分数)] 化学参考答案1.C【解析】太阳能路灯涉及的能量转化为太阳能转化为电能,A项不符合题意;火箭发射涉及的能量转化主要为化学能转化为热能,B项不符合题意;煤气灶使用时,涉及的能量转化主要为化学能转化为热能,D项不符合题意。2.B【解析】水由液态转化为气态是熵增吸热过程,B项符合题意。3.B【解析】甲烷是非电解质,硝酸铜溶液是混合物,硫酸钡是盐,强电解质,其余均为弱电解质,B项符合题意。4.C【解析】化学反应方程式相减,K值相除,C项错误。5. A【解析】催化剂和压强均可以缩短达到平衡的时间,B项错误;工业合成氨是熵减的反应,C项错误;合成氨反应是放热反应,高温不利于提高合成氨的产率,D项错误。6. A【解析】多元弱酸根的水解要分步进行,B项错误;燃烧热生成的水应为液态,C项错误;平衡常数中,液态水浓度不写在平衡表达式中,D项错误。7. A【解析】体积未知,无法计算,B项、C项均错误;Kw未知,无法计算,D项错误。8. C【解析】氢气作为火箭发动机燃料,主要利用了氢气的热值高,A项不符合题意;NaClO用于消毒,利用的是NaClO的强氧化性,B项不符合题意;活性炭疏松多孔,可用于冰箱除异味,D项不符合题意。9. D【解析】酚酞变红的溶液显碱性,Mg2+不能大量共存,A项不符合题意;水电离出的c( H+ )= 1 10-13,此溶液可能显酸性,也可能显碱性,Fe3+、Cu2+在碱性条件下不能大量共存,B项不符合题意;金属铝既可与酸反应,又可与碱反应,均能产生氢气,酸式根离子不能共存,C项不符合题意。10. D【解析】电解氯化铝制备金属铝时,铝应做阴极,A项不符合题意;温度计的位置不对,B项不符合题意; 制备无水氯化铝不能通过蒸干氯化铝溶液制取,C项不符合题意。11. B【解析】根据题意可知,混合后溶液呈中性,由此可知,反应前c(H+ ) V(酸) =c(OH-) V(碱),由此 计算可得2c(H+ ) = 5c(OH- ),若酸中c(H+ ) = 10-1,则碱中c(OH- ) = 4 10-2,由此计算可得pH(酸) = 1,pH(碱) = 12. 6,B项符合题意。12. C【解析】t1时刻反应速率最快,并不是温度最高的点,随着反应进行,盐酸浓度减小,反应放热,溶液温度升高,在t1时刻以后,浓度对反应速率的影响大于温度的影响,此时刻,反应还在放热,C项错误。13. B【解析】根据图示可知,硝酸根在Ag—Pt电极上被还原,说明Ag—Pt电极为阴极,N电极为负极,A项错误;Pt电极上发生的是氧化反应,失电子,C项错误;每生成5. 6gN2,转移的电子的物质的量为2mol,阳极室生成16g氧气,同时向阴极室转移的H+为2mol,则阳极室质量减少18g,阴极室质量减少3. 6g,左右两室质量差为14. 4g,D项错误。14. C【解析】(HI)=0. 025 mol • L-1 • min-1 ,A项错误;计算可得,K=1. 44,B项错误;通入氢气后,再次达到平衡时,氢气的浓度增大,D项错误。15. (1)①一元弱(或其他合理答案2分)②OH-+H3PO2=H2PO2-+H2O(2 分)⑵①酸(2分);c(H2PO3-)>c(HPO32-)>c(H3PO3)(2 分)③ 10-5—10-9(2 分)③ I (2分)2. 3(2分)16. (1)粉碎矿石(或搅拌或延长浸取时间等合理答案均可,2分)(2) SiO2 (多写“CaSO4”不扣分,1分)(3) 将Fe2+氧化为Fe3+(2分)(4) S2-十Cu2+=CuS↓ (2 分)(5) CaF2、MgF2(2 分)(6) 9. 15(2 分)(7) ①100mL容量瓶(2分)②(NH4)2Ni(SO4)2(2 分)17. (1)A(2 分);B(2 分)(2) O2十4e- + 2CO2 =2CO32- ( 2 分);CO2 (1 分)(3) ①C(2 分);OH-(2 分)②减少(2分);3. 6(2分)18. (1) - (a+b) (2 分)(2) ①<(2 分)② D(2分)③ >(2分)(3) ①<(2 分)②33.3(2分);(2分)
相关试卷
这是一份河南省洛阳市创新发展联盟2022-2023学年高二下学期5月阶段性考试化学试卷PDF版含答案,共8页。
这是一份2022-2023学年河南省创新发展联盟高二上学期10月阶段检测(月考)化学试题PDF版含答案,文件包含化学2022-10-13pdf、化学答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份2022-2023学年河南省创新发展联盟高三上学期11月阶段检测化学试题 PDF版,文件包含2022-2023学年上学期创新发展联盟高三阶段检测化学试题pdf、2022-2023学年上学期创新发展联盟高三阶段检测化学答案解析pdf等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。








