

(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第14天——铁 金属材料
展开高一年级20天轻松提升化学第14天——铁 金属材料
(建议用时90分钟)
一、选择题:每小题只有一个选项符合题意。
1.下列成语或谚语中蕴含着一定的化学知识或原理,下列有关说法错误的是( )
A.百炼成钢——通过反复锤炼,除去铁中部分杂质,使其转化为钢
B.水滴石穿——CO2+H2O+CaCO3Ca(HCO3)2(以大理石为例)
C.恨铁不成钢——钢的性能远优于铁
D.真金不怕火炼——单质金的熔点很高
2.下列有关金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.金属元素的单质在常温下都为固体
C.含金属元素的离子都是阳离子
D.金属阳离子被还原不一定得到金属单质
3.合金相对于纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大
②一般合金的熔点比它的各成分金属的更低
③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金
④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
4.将已完全覆盖氧化膜的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硫酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
5.下列反应中,铁元素被氧化的是( )
A.FeS+2HClFeCl2+ H2S↑
B.Fe+H2SO4FeSO4+H2↑
C.FeO+2HClFeCl2+H2O
D.2FeCl3+Cu2FeCl2+ CuCl2
6.下列各组反应,最终一定能得到白色沉淀的是 ( )
A.向CaCl2溶液中通入CO2
B.向FeCl3溶液中加入NaOH溶液
C.向FeCl2溶液中加入过量NaOH溶液
D.向MgSO4溶液中加入足量NaOH溶液
7.某溶液中可能含有Fe3+、Mg2+、Na+、Ba2+、Cl-、OH-、S中的若干种,下列说法中正确的是 ( )
A.溶液中最多有4种离子
B.若溶液有颜色,则一定没有OH-
C.若溶液呈碱性,则一定含有Na+
D.该溶液不可能溶解单质铜
8.设NA为阿伏加德罗常数值。下列有关叙述正确的是 ( )
A.5.6 g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B.标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA
C.32 g Cu与S完全反应转移的电子数为0.5NA
D.在反应2Al+2NaOH+2H2O2NaAlO2+3H2↑中生成1 mol H2转移的电子数为3NA
9.用铝箔包裹0.1 mol金属钠,用针扎若干个小孔,放入水中,完全反应后,放出的气体体积(标准状况)为 ( )
A. 1.12 L B.小于1.12 L
C.大于1.12 L D.无法确定
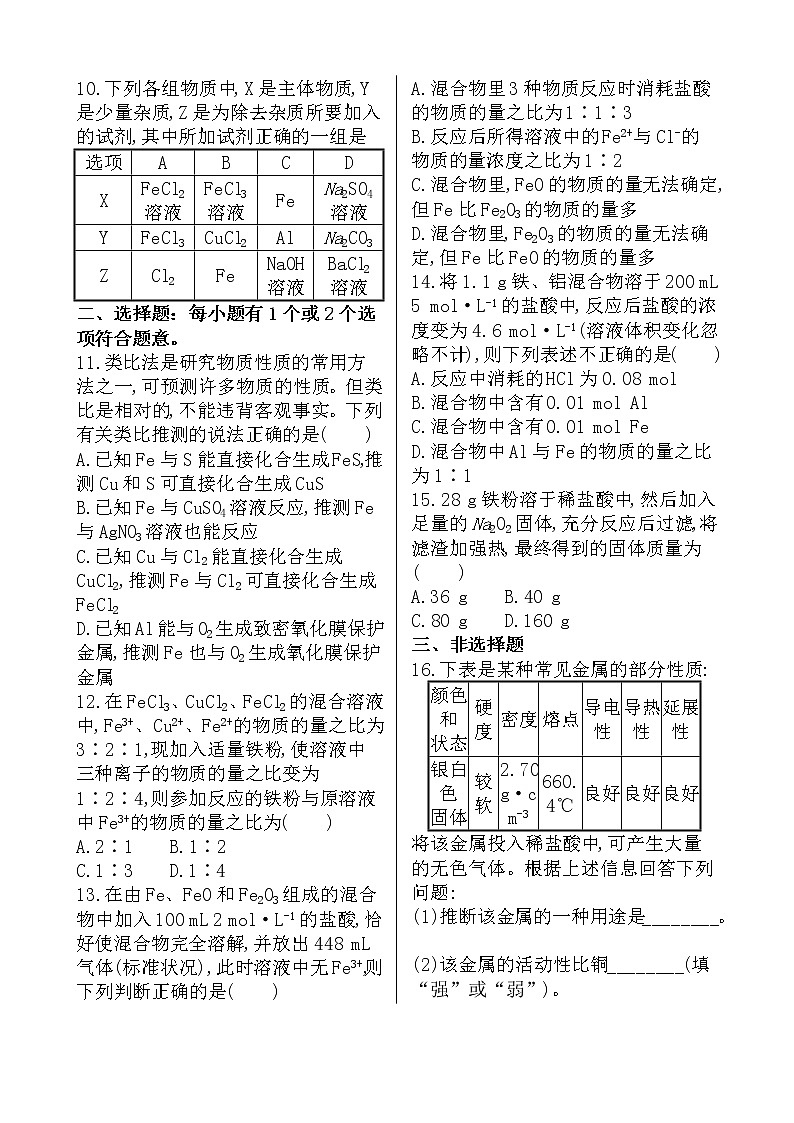
10.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
选项 | A | B | C | D |
X | FeCl2 溶液 | FeCl3 溶液 | Fe | Na2SO4 溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cl2 | Fe | NaOH 溶液 | BaCl2 溶液 |
二、选择题:每小题有1个或2个选项符合题意。
11.类比法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列有关类比推测的说法正确的是( )
A.已知Fe与S能直接化合生成FeS,推测Cu和S可直接化合生成CuS
B.已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
C.已知Cu与Cl2能直接化合生成CuCl2,推测Fe与Cl2可直接化合生成FeCl2
D.已知Al能与O2生成致密氧化膜保护金属,推测Fe也与O2生成氧化膜保护金属
12.在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子的物质的量之比变为1∶2∶4,则参加反应的铁粉与原溶液中Fe3+的物质的量之比为( )
A.2∶1 B.1∶2
C.1∶3 D.1∶4
13.在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol·L-1的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe3+,则下列判断正确的是( )
A.混合物里3种物质反应时消耗盐酸的物质的量之比为1∶1∶3
B.反应后所得溶液中的Fe2+与Cl-的物质的量浓度之比为1∶2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
14.将1.1 g铁、铝混合物溶于200 mL 5 mol·L-1的盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计),则下列表述不正确的是( )
A.反应中消耗的HCl为0.08 mol
B.混合物中含有0.01 mol Al
C.混合物中含有0.01 mol Fe
D.混合物中Al与Fe的物质的量之比为1∶1
15.28 g铁粉溶于稀盐酸中,然后加入足量的Na2O2固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为( )
A.36 g B.40 g
C.80 g D.160 g
三、非选择题
16.下表是某种常见金属的部分性质:
颜色和 状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
银白色 固体 | 较软 | 2.70 g·cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答下列问题:
(1)推断该金属的一种用途是________。
(2)该金属的活动性比铜________(填“强”或“弱”)。
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱。
①一种猜想:_______________________;
②验证方法:________________________;
③实验现象: _______________________;
④实验结论: _______________________。
17.把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应,然后取出部分溶液(忽略水电离出的离子)。
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中可能存在的离子有________。
(2)若滴加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有________,可能存在的金属粉末有_________________________________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+)∶n(Fe2+)=_______________。
(4)若(3)反应后的溶液中有三种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)________________。
18.下列物质之间有如下反应关系:
已知E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:
A________,B________,D________,
甲________,乙________,丙________。
(2)写出E→C反应的化学方程式: _________________________。
19. (1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:
____FeS2+_____H++______N____Fe2++ ________S+_____NO↑+________H2O
在上述氧化还原反应方程式中还原剂为____________________________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________(填字母)
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________。
20.阅读下列材料后,回答相应问题。
铁在生活中分布较广,占地壳含量的4.75%,纯铁是柔韧而延展性较好的银白色金属,用于制发电机和电动机的铁芯,铁及其化合物还用于制磁铁、药物、墨水、颜料、磨料等。另外人体中也含有铁元素,+2价的亚铁离子是血红蛋白的重要组成成分,用于氧气的运输。在我国,从战国时期到东汉初年,铁器的使用开始普遍起来,成为了我国最主要的金属。铁的化合物四氧化三铁就是磁铁矿,是早期司南的材料。
(1)服用维生素C可将人体中的Fe3+转化成Fe2+,这说明维生素C具有什么性质?
(2)新配制的FeCl2溶液应加入什么物质可以防止FeCl2转化为FeCl3?
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应,写出反应的离子方程式。
(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程的原理是什么? 处理过程中需定期添加的原料是什么?
(5)某同学为检验某未知溶液是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知溶液于试管中溶液呈红色(证明含有FeCl2),你认为此方案是否合理?若不合理,如何改进?
(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第20天——综合提升: 这是一份(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第20天——综合提升,文件包含人教版高一年级20天轻松提升化学第20天综合提升-答案doc、人教版高一轻松寒假20天提升作业适用高一新教材化学第20天综合提升doc等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第18天——化学键: 这是一份(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第18天——化学键,文件包含人教版高一年级20天轻松提升化学第18天化学键-答案doc、人教版高一轻松寒假20天提升作业适用高一新教材化学第18天化学键doc等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。
(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第13天——金属材料: 这是一份(人教版)高一轻松寒假20天提升作业(适用高一新教材)化学第13天——金属材料,文件包含人教版高一年级20天轻松提升化学第13天金属材料-答案doc、人教版高一轻松寒假20天提升作业适用高一新教材化学第13天金属材料doc等2份试卷配套教学资源,其中试卷共4页, 欢迎下载使用。












