

高中化学专题13盐类的水解(教师版含解析)2021年高考化学真题和模拟题分类汇编
展开
这是一份高中化学专题13盐类的水解(教师版含解析)2021年高考化学真题和模拟题分类汇编,共47页。试卷主要包含了单选题,多选题,工业流程题,原理综合题等内容,欢迎下载使用。
专题13盐类的水解
2021年化学高考题
一、单选题
1.(2021·全国高考真题)HA是一元弱酸,难溶盐MA的饱和溶液中随c(H+)而变化,不发生水解。实验发现,时为线性关系,如下图中实线所示。
下列叙述错误的是
A.溶液时,
B.MA的溶度积度积
C.溶液时,
D.HA的电离常数
【KS5U答案】C
【分析】
本题考查水溶液中离子浓度的关系,在解题过程中要注意电荷守恒和物料守恒的应用,具体见详解。
【KS5U解析】
A.由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=mol/Ly,故D正确;
综上所述,说法不正确的是C项,故答案为C。
3.(2021·广东高考真题)鸟嘌呤()是一种有机弱碱,可与盐酸反应生成盐酸盐(用表示)。已知水溶液呈酸性,下列叙述正确的是
A.水溶液的
B.水溶液加水稀释,升高
C.在水中的电离方程式为:
D.水溶液中:
【KS5U答案】B
【KS5U解析】
A.GHCl为强酸弱碱盐,电离出的GH+会发生水解,弱离子的水解较为微弱,因此0.001mol/L GHCl水溶液的pH>3,故A错误;
B.稀释GHCl溶液时,GH+水解程度将增大,根据勒夏特列原理可知溶液中c(H+)将减小,溶液pH将升高,故B正确;
C.GHCl为强酸弱碱盐,在水中电离方程式为GHCl=GH++Cl-,故C错误;
D.根据电荷守恒可知,GHCl溶液中c(OH-)+c(Cl-)=c(H+)+c(GH+),故D错误;
综上所述,叙述正确的是B项,故答案为B。
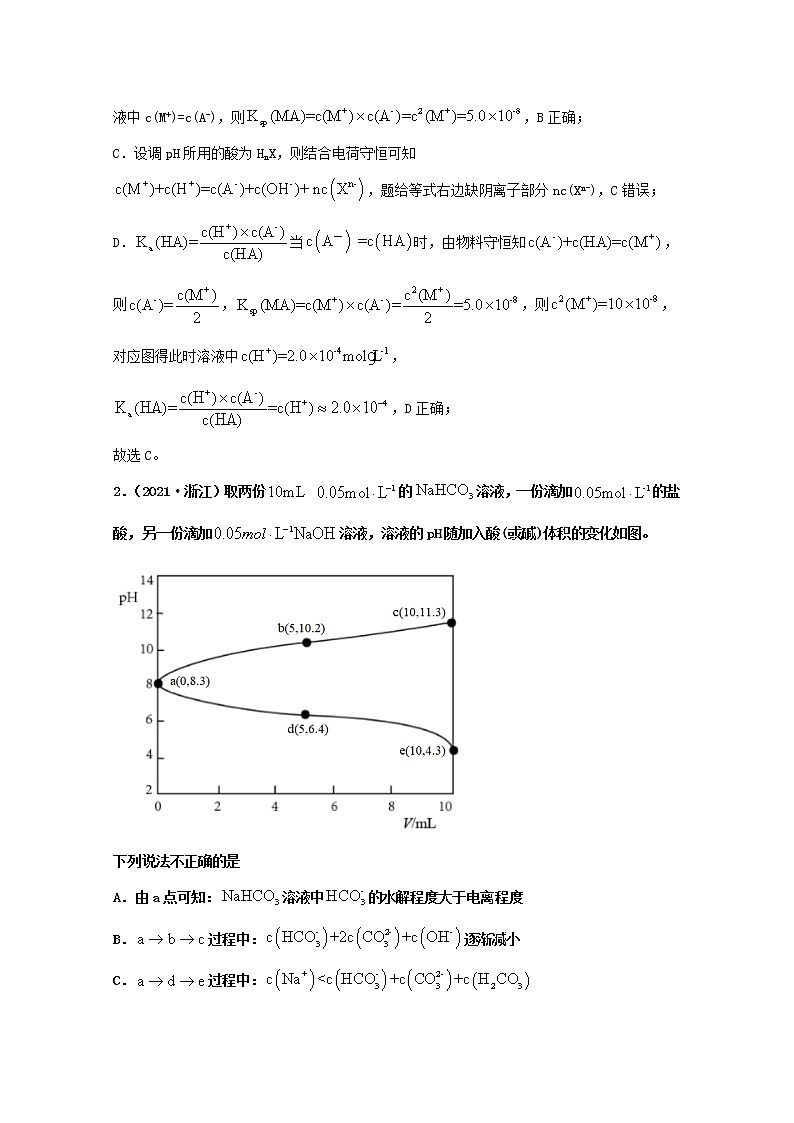
4.(2021·湖南高考真题)常温下,用的盐酸分别滴定20.00mL浓度均为三种一元弱酸的钠盐溶液,滴定曲线如图所示。下列判断错误的是
A.该溶液中:
B.三种一元弱酸的电离常数:
C.当时,三种溶液中:
D.分别滴加20.00mL盐酸后,再将三种溶液混合:
【KS5U答案】C
【分析】
由图可知,没有加入盐酸时,NaX、NaY、NaZ溶液的pH依次增大,则HX、HY、HZ三种一元弱酸的酸性依次减弱。
【KS5U解析】
A.NaX为强碱弱酸盐,在溶液中水解使溶液呈碱性,则溶液中离子浓度的大小顺序为c(Na+)>c(X-)>c(OH-)>c(H+),故A正确;
B.弱酸的酸性越弱,电离常数越小,由分析可知,HX、HY、HZ三种一元弱酸的酸性依次减弱,则三种一元弱酸的电离常数的大小顺序为Ka(HX)>Ka (HY)>Ka(HZ),故B正确;
C.当溶液pH为7时,酸越弱,向盐溶液中加入盐酸的体积越大,酸根离子的浓度越小,则三种盐溶液中酸根的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故C错误;
D.向三种盐溶液中分别滴加20.00mL盐酸,三种盐都完全反应,溶液中钠离子浓度等于氯离子浓度,将三种溶液混合后溶液中存在电荷守恒关系c(Na+)+ c(H+)= c(X-)+c(Y-)+c(Z-)+ c(Cl-)+ c(OH-),由c(Na+)= c(Cl-)可得:c(X-)+c(Y-)+c(Z-)= c(H+)—c(OH-),故D正确;
故选C。
5.(2021·浙江高考真题)实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确的是
A.图中实线表示pH随加水量的变化,虚线表示pH随温度的变化'
B.将NH4Cl溶液加水稀释至浓度mol·L-1,溶液pH变化值小于lgx
C.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH)
【KS5U答案】C
【分析】
由题中信息可知,图中两条曲线为10 mL 0. 50 mol·L-1 NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化曲线,由于两种盐均能水解,水解反应为吸热过程,且温度越高、浓度越小其水解程度越大。氯化铵水解能使溶液呈酸性,浓度越小,虽然水程度越大,但其溶液的酸性越弱,故其pH越大;醋酸钠水解能使溶液呈碱性,浓度越小,其水溶液的碱性越弱,故其pH越小。温度越高,水的电离度越大。因此,图中的实线为pH随加水量的变化,虚线表示pH随温度的变化。
【KS5U解析】
A.由分析可知,图中实线表示pH随加水量的变化,虚线表示pH随温度的变化,A说法正确;
B.将NH4Cl溶液加水稀释至浓度mol·L-1时,若氯化铵的水解平衡不发生移动,则其中的c(H+)变为原来的,则溶液的pH将增大lgx,但是,加水稀释时,氯化铵的水解平衡向正反应方向移动,c(H+)大于原来的,因此,溶液pH的变化值小于lgx,B说法正确;
C.随温度升高,水的电离程度变大,因此水的离子积变大,即Kw增大;随温度升高,CH3COONa的水解程度变大,溶液中c(OH-)增大,因此,C说法不正确;
D. 25℃时稀释相同倍数的NH4C1溶液与CH3COONa溶液中均分别存在电荷守恒,c(Na+ ) +c(H+) =c(OH-)+c(CH3COO- ) ,c(NH4+)+c(H+ ) =c(Cl-)+c(OH- )。因此,氯化铵溶液中,c(Cl-)-c(NH4+) =c(H+ )-c(OH- ),醋酸钠溶液中,c(Na+ )-c(CH3COO- )= c(OH-) -c(H+) 。由于25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8 ×10-5,因此,由于原溶液的物质的量浓度相同,稀释相同倍数后的NH4C1溶液与CH3COONa溶液,溶质的物质的量浓度仍相等,由于电离常数相同,其中盐的水解程度是相同的,因此,两溶液中|c(OH-) -c(H+)|(两者差的绝对值)相等,故c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH4+),D说法正确。
综上所述,本题选C。
6.(2021·浙江高考真题)25℃时,下列说法正确的是
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol
【KS5U答案】D
【KS5U解析】
A.NaHA溶液呈酸性,可能是HA-的电离程度大于其水解程度,不能据此得出H2A为强酸的结论,A错误;
B.可溶性正盐BA溶液呈中性,不能推测BA为强酸强碱盐,因为也可能是B+和A-的水解程度相同,即也可能是弱酸弱碱盐,B错误;
C.弱酸的浓度越小,其电离程度越大,因此0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1>α2,C错误;
D.100 mL pH=10.00的Na2CO3溶液中氢氧根离子的浓度是1×10-4mol/L,碳酸根水解促进水的电离,则水电离出H+的浓度是1×10-4mol/L,其物质的量为0.1L×1×10-4mol/L=1×10-5mol,D正确;
答案选D。
二、多选题
7.(2021·山东高考真题)赖氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+H2R+HRR-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=,下列表述正确的是
A.>
B.M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+)
C.O点,pH=
D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
【KS5U答案】CD
【分析】
向H3RCl2溶液中滴加NaOH溶液,依次发生离子反应:、、,溶液中逐渐减小,和先增大后减小,逐渐增大。,,,M点,由此可知,N点,则,P点,则。
【KS5U解析】
A.,,因此,故A错误;
B.M点存在电荷守恒:,此时,因此,故B错误;
C.O点,因此,即,因此,溶液,故C正确;
D.P点溶质为NaCl、HR、NaR,此时溶液呈碱性,因此,溶质浓度大于水解和电离所产生微粒浓度,因此,故D正确;
综上所述,正确的是CD,故答案为CD。
三、工业流程题
8.(2021·湖南高考真题)可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以形式存在,还含有、、、等物质。以独居石为原料制备的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为_______;
(2)为提高“水浸”效率,可采取的措施有_______(至少写两条);
(3)滤渣Ⅲ的主要成分是_______(填化学式);
(4)加入絮凝剂的目的是_______;
(5)“沉铈”过程中,生成的离子方程式为_______,常温下加入的溶液呈_______(填“酸性”“碱性”或“中性”)(已知:的,的,);
(6)滤渣Ⅱ的主要成分为,在高温条件下,、葡萄糖()和可制备电极材料,同时生成和,该反应的化学方程式为_______
【KS5U答案】 适当升高温度,将独居石粉碎等 Al(OH)3 促使铝离子沉淀 ↑ 碱性 6++12=12+6CO↑+6H2O+6CO2↑
【分析】
焙烧浓硫酸和独居石的混合物、水浸,转化为Ce2(SO4)3和H3PO4,与硫酸不反应,转化为Al2(SO4)3,转化为Fe2(SO4)3,转化为CaSO4和HF,酸性废气含HF;后过滤,滤渣Ⅰ为和磷酸钙、FePO4,滤液主要含H3PO4,Ce2(SO4)3,Al2(SO4)3,Fe2(SO4)3,加氯化铁溶液除磷,滤渣Ⅱ为FePO4;聚沉将铁离子、铝离子转化为沉淀,过滤除去,滤渣Ⅲ主要为氢氧化铝,还含氢氧化铁;加碳酸氢铵沉铈得Ce2(CO3)3·nH2O。
【KS5U解析】
(1)铈的某种核素含有58个质子和80个中子,则质量数为58+80=138,该核素的符号为;
(2)为提高“水浸”效率,可采取的措施有适当升高温度,将独居石粉碎等;
(3)结合流程可知,滤渣Ⅲ的主要成分是Al(OH)3;
(4)加入絮凝剂的目的是促使铝离子沉淀;
(5)用碳酸氢铵“沉铈”,则结合原子守恒、电荷守恒可知生成的离子方程式为↑;铵根离子的水解常数Kh()=≈5.7×10-10,碳酸氢根的水解常数Kh()==≈2.3×10-8,则Kh()c(NaHCO3)>c(NaClO),所以c(Na+):①>②>③,故C正确;
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,铵根离子浓度增大,氨水电离平衡逆向移动,c(OH﹣)减小、c(NH3·H2O)增大,所以溶液中c(OH﹣)/c(NH3·H2O)减小,故D错误;
选C。
8.(2021·浙江高三其他模拟)已知:p[]=-lg[]。室温下向HX溶液中滴加等物质的量浓度的NaOH溶液,溶液pH随p[]变化关系如图所示。下列说法正确的是
A.a点溶液中:10c(Na+)=c(HX)
B.溶液中由水电离出的c(H+):a>b>c
C.b点溶液中:c(Na+)+c(H+)=c(HX)+c(OH-)
D.当溶液呈中性时:c(Na+)=c(HX)
【KS5U答案】C
【KS5U解析】
A.a点溶液中存在电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),此时p[]=-1,则c(X-)=10c(HX),代入电荷守恒得c(Na+)+c(H+)=10c(HX)+c(OH-),由于溶液呈酸性c(H+)>c(OH-), c(Na+)c(H+)=c(OH—),故C错误;
D.由分析可知,G点为醋酸钠溶液,由电荷守恒关系c(CH3COO—)+c(OH—)=c(Na+)+c(H+)可知,溶液中各离子浓度关系为c(CH3COO—)=c(Na+)+c(H+)—c(OH—),故D正确;
故选D。
12.(2021·广西南宁市·南宁三中高三三模)常温下, 用如图1所示装置,分别向25mL0.3mol/L Na2CO3溶液和25mL0.3mo/lLNaHCO3溶液中逐滴滴加0.3mol/L的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是
A.X曲线为Na2CO3溶液的滴定曲线
B.b点溶液的pH大于c点溶液的pH
C.a、d两点水的电离程度:a>d
D.c点的溶液中:c(Na+)+c(H+)=2c(CO)+c(HCO )+c(OH-)
【KS5U答案】C
【KS5U解析】
A.碳酸钠溶液中滴加盐酸时先发生反应CO+H+= HCO +H2O,然后发生HCO +H+=H2CO3+H2O,碳酸氢钠溶液中滴加盐酸时发生HCO +H+=H2CO3+H2O,所以滴加25mL盐酸时,碳酸钠溶液中几乎不产生二氧化碳,压强几乎不变,而碳酸氫钠恰好完全反应,压强达到最大,所以X代表NaHCO3溶液,Y代表Na2CO3溶液,A错误:
B. b点溶液溶质为NaCl, c点溶液溶质为NaHCO3,所以c点代表溶液的pH更大,B错误:
C. d点盐酸和碳酸钠恰好完全反应,溶质为NaCl,还有少量溶解的二氧化碳,而a点溶质为碳酸钠和碳酸氢钠,HCO、CO的水解都会促进水的电离,所以a点水的电离程度更大,C正确。
D. c点的溶液中:根据电荷守恒知,c(Na+)+(H+)= 2(CO)+c(HCO)+c(OH-)+c(C1-),D错误。
故选:C。
13.(2021·江西抚州市·临川一中)常温下,以酚酞为指示剂,用0.1000mol·L−1的NaOH溶液滴定20.00mL0.1000mol·L−1的二元酸H2A溶液。溶液中pH、含A微粒分布系数δ(物质的量分数)随滴加NaOH溶液体积VNaOH的变化关系如图所示
下列说法中正确的是
A.H2A在水中电离的方程式为:H2A⇌H++HA-,HA-⇌H++A2-
B.当VNaOH溶液=20.00mL时,溶液中离子浓度大小顺序为:c(Na+)﹥c(HA-)﹥c(H+)﹥c(A2-)﹥c(OH-)
C.常温下,HA-的电离平衡常数为1×10-5
D.当VNaOH溶液=30.00mL时,c(HA-)+c(H+)=c(A2-)+c(OH-)
【KS5U答案】B
【KS5U解析】
A.根据图像的变化趋势可知①、②代表含A微粒分布系数,③代表pH变化,据图可知未滴加NaOH溶液时,溶液中含A微粒只有两种,则应为HA-和A2-,不含H2A,说明H2A第一步完全电离,在水中的电离方程式为H2A=H++HA-,HA-⇌H++A2-,A错误;
B.当VNaOH溶液=20.00mL时,NaOH和H2A恰好完全反应生成NaHA,溶质为NaHA,溶液中存在HA-⇌H++A2-和H2O⇌H++OH-,所以离子浓度大小关系为c(Na+)﹥c(HA-)﹥c(H+)﹥c(A2-)﹥c(OH-),B正确;
C.HA-的电离平衡常数表达式为Ka=,据图可知当c(A2-)=c(HA-)时加入25mLNaOH溶液,此时pH为2.0,即c(H+)=1×10-2mol/L,所以Ka=1×10-2,C错误;
D.当VNaOH溶液=30.00mL时,溶质为等物质的量的NaHA、Na2A,溶液中的电荷守恒:c(H+)+c(Na+)=2c(A2-)+c(HA-)+c(OH-),物料守恒为2c(Na+)=3c(A2-)+3c(HA-),用两个等式消去c(Na+)可得:c(HA-)+2c(H+)=c(A2-)+2c(OH-),D错误;
综上所述答案为B。
14.(2021·山东潍坊市·高三三模)常温下,将0.1mol·L-1的溶液加水稀释,混合溶液中与的关系如图所示。下列说法正确的是
A.的值为10-4.7
B.M、N两点对应的溶液稀释程度N>M
C.向溶液中加入固体可使N点移动到P点
D.将溶液稀释1000倍后,溶液中
【KS5U答案】AD
【KS5U解析】
A.由N点数据可知=-4.5,则c(H+)=10-4.5 mol·L-1,则c(OH-)=10-9.5 mol·L-1,=4.8,则=10-4.8,则==10-9.5×104.8=10-4.7,故A正确;
B.溶液越稀,的水解程度越大,溶液酸性越小,N点=-4.5,则c(H+)=10-4.5 mol·L-1,M点=-6.0,则c(H+)=10-6.0 mol·L-1,因此N酸性强,溶液的浓度大,即M、N两点对应的溶液稀释程度M>N,故B错误;
C.温度不变, 不变,混合溶液中与的关系曲线不变,因此向溶液中加入固体,不可使N点移动到P点,故C错误;
D.稀释溶液,促进铵根离子的水解,将溶液稀释1000倍后,溶液接近中性,c(NH)≈2c(SO),故D正确;
故选AD。
15.(2021·天津高三三模)常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是
A.可求出Ka1(H2SO3)、Ka2(H2SO3)的值
B.滴定中两次反应终点可依次用甲基橙、酚酞作指示剂
C.图中Y点对应的溶液中3c(SO)=c(Na+)+c(H+)-c(OH-)
D.图中Z点对应的溶液中:c(Na+)>c(SO)>c(HSO)>c(OH-)
【KS5U答案】D
【KS5U解析】
A.混合溶液中W点c(H2SO3)=c(),Ka1(H2SO3)==c(H+)=10-pH=10-2,混合溶液Y点中c()=c(),Ka2(H2SO3)==c(H+)=10-pH=10-7.19,故可求出Ka1(H2SO3)、Ka2(H2SO3)的值,A正确;
B.甲基橙变色范围为3.1-4.4,滴定到第一反应终点溶液pH值为4.25,在其范围内,所以可以选取甲基橙作指示剂, 酚酞的变色范围是8.2~10.0,滴定到第二反应终点溶液pH值为9.86,在其范围内,所以可以选取酚酞作指示剂,B正确;
C.Y点溶液中存在电荷守恒c(Na+)+c(H+)=2c()+c()+c(OH-)且该点溶液中存在c()=c(),所以存在3c()=c(Na+)+c(H+)-c(OH-),C正确;
D.Z点酸碱恰好完全反应生成Na2SO3,两步水解生成OH-导致溶液呈碱性,但只有第一步水解生成,所以c()<c(OH-),由物料守恒知c(Na+)>c(),则该点溶液中存在c(Na+)>c()>c(OH-)>c(),D错误;
故答案为:D。
16.(2021·天津高三一模)室温下,向10mL0.1000molNa2CO3溶液中逐滴滴加0.1000mol/LHCl溶液,整个反应过程中无气体逸出(溶解的CO2均表示为H2CO3)。测得混合溶液的pH随加入HCl溶液体积的变化如下图。下列说法正确的是
A.a点溶液的溶质主要为NaCl、NaHCO3
B.b点溶液中c(Na+)+c(H+)>c(OH-)+c()+2c()
C.c点时,溶液中发生的离子反应是3+4H+=2+H2CO3
D.取d点溶液加热至沸腾,然后冷却至室温,溶液的pH不变
【KS5U答案】B
【分析】
依据题意,向碳酸钠溶液中逐滴滴入盐酸,发生反应和。根据所加盐酸溶液的体积确定a、b、c、d各点溶质成分,然后根据各点溶质成分解答。
【KS5U解析】
A.a点时加入盐酸为碳酸钠的一半,发生反应,还有剩余碳酸钠,体系中含有溶质NaCl、、,故A错误;
B.b点时,加入的盐酸和碳酸钠刚好反应生成碳酸氢钠和氯化钠,且溶液呈碱性,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c()+2c()+c(Cl-),所以c(Na+)+c(H+)>c(OH-)+c()+2c(),故B正确;
C.c点时溶质为H2CO3,和NaCl,溶液中发生的离子反应是2+3H+=+H2CO3,故C错误;
D.d点时溶质为NaCl和,溶液呈酸性,加热煮沸碳酸分解产生二氧化碳逸出,冷却后溶液呈中性,pH增大,故D错误。
答案选B。
17.(2021·天津高三一模)常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:p=-lg]。下列叙述不正确的是
A.m点:c(Na+)1
【KS5U答案】D
【KS5U解析】
A.根据电荷守恒可得,又由图示可知m点pH=4.76,则,所以m点:c(Na+)Ka(HY)
B.M点溶液显中性,溶液中c(Y-)Ka(HY),故A不选;
B.本题为向酸中滴加Ba(OH)2溶液,因此随着Ba(OH)2溶液的加入溶液先进行酸碱中和反应,所以当HY与Ba(OH)2溶液中水电离出的第一次达到时为中性点,当继续滴加Ba(OH)2溶液会抑制水的电离(N点之后),即第二次水电离该点为碱性点,所以M点呈中性,根据电荷守恒,所以c(Y-)>(Ba2+),故B;
C.N点完全反应点,0.1mol/LBa(OH)2溶液中,故消耗完20mL0.1mol/L的HY需要10mL0.1mol/LBa(OH)2溶液,故C不选;
D.根据电荷守恒可得T点;M点;T、M点相同,T点大于M点,所以,故D不选。
答案选B
19.(2021·辽宁高三其他模拟)常温下,向二元弱酸溶液中滴加溶液,测得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是
A.曲线m表示pH与变化的曲线
B.
C.溶液中:
D.交点a的溶液中:
【KS5U答案】D
【分析】
二元弱酸H2A的一级电离常数Ka1=,二级电离常数Ka2=,当c(H2A)= c(HA—)或c(A2—)= c(HA—)时,Ka1= c(H+)或Ka2= c(H+),由图可知,坐标原点时,曲线m对应pH为2.3,曲线n对应pH为5.7,一级电离常数大于二级电离常数,则曲线m表示pH与变化的曲线,曲线n表示pH与变化的曲线,一级电离常数Ka1=10—2.3、二级电离常数Ka2=10—5.7。
【KS5U解析】
A.由分析可知,曲线m表示pH与变化的曲线,故A正确;
B.由分析可知,H2A的二级电离常数Ka2=10—5.7,故B正确;
C.HA—的水解常数Kh===10—11.7<Ka2,则HA—的电离程度大于水解程度,溶液中,故C正确;
D.由图可知,交点a的溶液中>0,则溶液中c(HA—)>c(H2A),故D错误;
故选D。
20.(2021·四川雅安市·高三三模)草酸(H2C2O4)是一种二元弱酸。常温下向草酸溶液中滴加NaOH溶液,混合溶液中lgX[x表示或]随pH的变化如图。下列说法中错误的是
A.NaHC2O4溶液呈酸性
B.H2C2O4第二步电离常数数量级是10-5
C.pH=7时,c(Na+)=c()+2c()
D.1.22c(H2C2O4)
【KS5U答案】D
【分析】
二元弱酸草酸的K1=[]×c(H+)>K2=[]×c(H+),当溶液的pH相同时,c(H+)相同,lgX:a>b,则a表示lg与pH的变化关系,b表示lg与pH的变化关系,以此解答。
【KS5U解析】
A.由分析可知,a表示lg与pH的变化关系,当lg=0时,pH=1.22,则c(H+)=10-1.22mol/L,二元弱酸草酸的K1=[]×c(H+)=10-1.22,同理可得K2=[]×c(H+)=10-4.9,NaHC2O4溶液中的电离常数K2=10-4.9,水解常数Kh===10-12.78,则的电离大于水解,NaHC2O4溶液呈酸性,故A正确;
B.由分析可知,b表示lg与pH的变化关系,,当lg=0时,pH=4.19,则c(H+)=10-4.19mol/L,二元弱酸草酸的K2=[]×c(H+)=10-4.19,数量级是10-5,故B正确;
C.pH=7时,c(H+)=c(OH-),由电荷守恒c(H+)+ c(Na+)=c(OH-)+ c()+2c()可知,c(Na+)=c()+2c(),故C正确;
D.lgX为增函数,pH=1.22时,曲线a中,lgX=lg=0时,c()=c(H2C2O4),曲线b中lgX=lg103c(H2C2O4),曲线b中,lgX=lg=0,c()=c()>c(H2C2O4),所以1.22<pH<4.19的过程中,c()逐渐增大,c(H2C2O4)逐渐减小,c()逐渐增大,则不一定满足c()>c(H2C2O4),故D错误;
故选D。
21.(2021·广西南宁二中高三三模)常温下,用盐酸滴定溶液,其滴定曲线如图所示。下列说法正确的是
A.a点溶液中
B.b液中
C.若取c点溶液与足量浓的明矾溶液混合,有白色絮状沉淀生成,同时产生气泡,主要原因是:Al3++3HCO= Al(OH)3 ↓+3CO2↑
D.各点中水电离程度大小:d>c>b>a
【KS5U答案】C
【KS5U解析】
A.a点加入12.5mL盐酸,a点溶液中的溶质是等物质的量的、、,因碳酸根离子的水解程度大于碳酸氢根离子,导致碳酸根浓度下降,碳酸氢根离子浓度增大,氯离子不水解浓度不变,离子浓度大小:,故A错误;
B.由电荷守恒可得:,故B错误;
C.c点溶液中的溶质为碳酸氢钠和氯化钠,若取c点溶液与足量浓的明矾溶液混合,有白色絮状沉淀生成,同时产生气泡,主要原因是两者发生双水解,离子反应方程式是Al3+ +3 HCO3- = Al(OH)3 ↓+ 3CO2↑,故C正确;
D.随着盐酸加入,不断被反应,水解越来越弱,水电离程度降低,各点中水电离程度大小:dc(HA-)>c(A2-),故A说法正确;
B.根据图像,c点:c(A2-)=c(HA-),溶质为KHA和K2A,如果KHA和K2A物质的量浓度相同,存在2c(K+)=3[c(H2A)+c(HA-)+c(A2-)],c(H2A)+c(HA-)+c(A2-)=0.1mol/L,则c(K+)=0.15mol/L,但HA-的电离程度大于A2-水解程度,c(HA-)小于c(A2-),推出c(K2A)略小于c(KHA),即c(K+)小于0.15moL/L,故B说法错误;
C.从a点推出c(HA-)=10-4mol/L,c(H+)=1mol/L,弱电解质的电离微弱,c(H2A)约为0.1mol/L,即H2A的电离常数为=10-3moL/L,故C说法正确;
D.根据图像,KHA溶液显酸性,抑制水的电离,加入KOH,生成K2A,A2-水解,促进水的电离,从b点到e点,水电离产生的c(H+)先增大后减小,故D说法正确;
答案为B。
26.(2021·全国高三其他模拟)25℃时,向20.00 mL 0.1000 mol·L-1的Na2R溶液中滴入 0.1000 mol·L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示(忽略混合过程中溶液体积的变化)。下列说法错误的是
A.Ka2(H2R)>Kh1(R2-)
B.Ka1(H2R)的数量级为10-4
C.滴定过程中水的电离程度先减小后增大
D.m点时,溶液中存在c(Cl-)+2c(R2-)+c(HR-)=c(Na+)
【KS5U答案】C
【KS5U解析】
A.m点时,Na2R的物质的量等于NaHR的物质的量,此时pH=7,溶液中存在R2-、HR-的水解,以及HR-的电离,所以Ka2(H2R)>Kh1(R2-),故A正确;
B.加入40ml盐酸时,得到60.oomlpH=2.5的H2R 和NaCl的混合溶液,由元素守恒可知,, ,,故B正确;
C.滴定过程中水的电离程度逐渐减小,故C错误;
D.m点,由电荷守恒有: ,此时pH=7, ,则有故D正确;
故答案为C。
二、多选题
27.(2021·全国高三零模)二元弱碱在常温下的水溶液里,微粒的分布系数()随的变化关系如图所示。下列说法正确的是
A.常温下,的一级电离常数
B.常温下,等物质的量的和组成的混合溶液显酸性
C.与少量的硫酸反应得到的盐为
D.溶液中,
【KS5U答案】AC
【KS5U解析】
A. 常温下二元弱碱的级电离方程式为:,当瓶pH=10时,c[]=c[],c()=1104,则的一级电离常数 ,故A正确;
B. 常温下,为二元弱碱,为碱式盐,所以等物质的量的和组成的混合溶液显碱性,故B错误;
C. 少量的硫酸与反应方程式为:2+H2SO4=+2H2O,得到的盐为,故C正确;
D. 根据质子守恒,在溶液中, ,故D错误;
故答案:AC
28.(2021·河北石家庄市·)常温下,通入HCl或加入NaOH固体调节0.01mol·L-1NaHR溶液的pH(调节过程中溶液体积不变),溶液中c(HR-)随pH变化的曲线如图所示。下列说法错误的是
A.xb=d
D.c点时溶液中存在c(HR-)>c(H2R)>c(R2-)
【KS5U答案】CD
【KS5U解析】
A.0.01mol·L-1NaHR溶液的pH=6,溶液中存在R2-、HR-、H2R三种微粒,根据物料守恒,故溶液中x=c(HR-) c>b,故C错误;
D.c点NaHR溶液显酸性,则NaHR溶液的电离程度大于水解程度,所以c点时溶液中存在c(HR-)>c(R2-)>c(H2R),故D错误;
故选CD。
三、工业流程题
29.(2021·重庆市第十一中学校高三二模)锗属于稀有分散元素,一种以锗精矿(含GeO2、GeO、SiO2、As2O3)制备高纯二氧化锗的工艺流程如下:
下列数据是对应物质的熔点:
物质
GeO2
GeO
SiO2
As2O3
熔点/℃
1115
710(升华)
1723
193(升华)
(1)第32号元素锗的原子结构示意图________,根据锗在元素周期表中的位置写出单质锗的一种用途________。
(2)“焙烧”前,粉碎锗精矿的目的是________。矿渣1的主要成分是________。
(3)“还原焙烧”中,含Ge氧化物在不同气氛中的挥发情况如图。800~1100℃之间,含Ge氧化物在CO中的挥发率明显高于空气中的原因是________。
(4)“碱浸氧化”后,GeO转化为锗酸盐,请写出反应的离子方程式________。
(5)“精馏水解”发生反应的化学方程式________。
(6)在氯化物熔盐中,电解SiO2和GeO2的混合物,可制得硅锗合金。反应原理如下:
SiO2+GeO2SiGe(合金)+2O2↑
生成硅锗合金的电极为________(填“阳极”或“阴极”),写出生成O2的电极反应式________。
【KS5U答案】 半导体材料 增大接触面积,加快反应速率,提高锗精矿的利用率 As2O3 GeO2在CO中转化为GeO升华 GeCl4 + (n+2)H2O=GeO2·nH2O + 4HCl 阴极 2O2--4e-=O2↑
【分析】
由于As2O3在193℃时升华,所以锗精矿(含GeO2、GeO、 SiO2、As2O3)首先在300℃焙烧得到含GeO2、GeO、SiO2矿石;然后在1200℃下GeO2被CO还原成710℃下挥发的GeO以及主要含SiO2的矿渣2;GeO在碱性条件下被双氧水为Ge4+;然后加盐酸经蒸馏得到GeCl4; GeCl4再精馏水解最后烘干得到高纯的GeO2,据此分析可得:
【KS5U解析】
(1)第32号元素锗为第四周期第IV族的元素,则其原子结构示意图为;锗位于金属与非金属分界线的元素,可用作半导体材料,故答案为:;半导体材料;
(2)“焙烧”前,粉碎锗精矿的目的是增大接触面积,加快反应速率,提高锗精矿的利用率;由于As2O3在193℃时升华,所以300℃煅烧锗精矿(含GeO2、GeO、SiO2、As2O3)后再冷凝得到的矿渣1的主要成分为As2O3,故答案为:增大接触面积,加快反应速率,提高锗精矿的利用率;As2O3;
(3) GeO在710℃时挥发,所以800~1100 ℃之间,含Ge氧化物在CO中的挥发率明显高于空气中的原因是GeO2在CO中转化为GeO升华,故答案为:GeO2在CO中转化为GeO升华;
(4)“碱浸氧化”后,GeO转化为锗酸盐,则其离子方程式为:,故答案为:;
(5)“精馏水解”时GeCl4中Ge4+水解生成和HCl,则其反应的化学方程式为:,故答案为:;
(6) 由SiO2+GeO2SiGe(合金)+2O2↑可知,Si、Ge化合价均降低,发生还原反应,为电解池的阴极;O元素化合价升高为,发生氧化反应,则2O2--4e-=O2↑,故答案为:阴极;2O2--4e-=O2↑。
四、原理综合题
30.(2021·天津南开区·南开中学高三三模)I.人类使用能源经历了三个时期。
(1)柴草时期
从能量转化的角度看,木材燃烧时化学能主要转化成_______能和光能。
(2)化石能源时期
迄今为止,煤、石油、天然气仍是人类使用的主要能源。煤的综合利用有_______、煤的气化和煤的液化等:石油经分馏可以获得汽油、煤油、柴油等轻质油,通过催化裂化和裂解可以得到乙烯、丙烯等,通过结构的重新调整可得到芳香烃类化合物。
(3)多能源结构时期
基于环保理念,天津市将逐步减少传统燃油汽车的使用,燃料电池汽车将有更广阔的发展前景。如图1所示为氢氧燃料电池的示意图,其基本工作原理与铜锌原电池的相同。根据图中电子流动方向判断,A电极的电极反应方程式为_______,氢氧燃料电池的优点是_______(写一条即可)。
II.氮的循环对人类的生产和生活具有重要意义,图2为氮的部分循环过程:
(4)上述转化中,属于氮的固定的是_______(填标号)。
(5)步骤②,以氨气为原料制备两种常见氮肥的反应如下:
a.NH3+H2O+CO2=NH4HCO3
b.2NH3(g)+CO2(g)H2O(g)+CO(NH2)2(s) ΔH___>___c(HA2-)>c(OH-),结合图4中的II,当溶液中的=101.8,此时溶液的pH=____。
【KS5U答案】热 煤的干馏 2H2 – 4e- = 4H+ 无污染、原料来源广泛、可以持续产生稳定的电流等 ① a 增大压强 c(H2A−) c(H+) 9
【KS5U解析】
(1)燃烧为放热反应,木材燃烧时化学能主要转化为热能和光能;
(2)煤的综合利用有煤的干馏、煤的气化和煤的液化;
(3)根据电子流向以及氢离子流向可知A电极为负极,氢气失电子被氧化为H+,电极反应式为2H2 – 4e- = 4H+;氢氧燃料的产物为水,无污染,原料为氢气和氧气,来源广泛,且可以持续产生稳定的电流等;
(4)氮的固定是指将游离态的氮转化为化合态,所以过程①属于氮的固定;
(5)反应a为化合反应,原子利用率达到100%;该反应为气体系数之和减小的反应,所以增大压强既能加快化学反应速率,又能使该平衡正向移动;
(6)当滴入20mLNaOH溶液时,溶液中的溶质为NaH2A,存在电离平衡H2A−HA2-+H+,此时溶液显酸性,所以c(H+)>c(OH-),同时由于水也会电离出H+,电离是微弱的,所以c(Na+)>c(H2A−)>c(H+)>c(HA2-)>c(OH-);根据题意可知H3A为三元弱酸,前一步的电离会抑制后一步电离,所以:Ka1>Ka2>Ka3,即>>,所以当pH相等时>>,则曲线Ⅱ代表lg,当lg=10时,pH=2.8,即c(H+)=10-2.8mol/L,所以Ka2=1010×10-2.8=10-7.2,则当=101.8时,c(H+)==10-9mol/L,pH=9。
31.(2021·天津高三三模)我国在碳—1化学方面的进展主要集中在合成气化工和甲醇化工。
I.研究CO2与CH4反应使之转化为CO和H2(合成气),可减缓燃料危机和减弱温室效应,过程包括
反应a:CH4(g)+CO2(g)2CO(g)+2H2(g)△H1>0
反应b:H2(g)+CO2(g)H2O(g)+CO(g)△H2>0
(1)反应a在一定条件下能够自发进行的原因是___;该反应工业生产适宜的温度和压强为___(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO和H2时,CH4和CO2平衡转化率随温度变化关系如图所示。
①923K时CO2的平衡转化率大于CH4的原因是___。
②计算923K时反应b的化学平衡常数K=____(计算结果保留小数点后两位)。
II.CO2催化加氢制甲醇:在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示。
(3)下列说法正确的是___。
A.该反应的正反应为放热反应
B.压强大小关系为P1
相关试卷
这是一份2010-2019年高考化学真题分类训练 专题13 盐类的水解及沉淀的溶解平衡(教师版含解析),共33页。
这是一份高中化学专题14沉淀溶解平衡(教师版含解析)2021年高考化学真题和模拟题分类汇编,共51页。试卷主要包含了单选题,工业流程题等内容,欢迎下载使用。
这是一份高中化学专题12弱电解质的电离平衡(教师版含解析)2021年高考化学真题和模拟题分类汇编,共45页。试卷主要包含了单选题,多选题,原理综合题,填空题,工业流程题等内容,欢迎下载使用。








