




所属成套资源:人教版 (2019) 高中 化学 选择性必修1 全册同步课件
人教版 (2019)选择性必修1第四节 化学反应的调控图文课件ppt
展开
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控图文课件ppt,共34页。PPT课件主要包含了目标素养,知识概览,自主预习,预习检测等内容,欢迎下载使用。
1.能应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。2.认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。
一、合成氨反应的理论分析1.反应特点。根据合成氨的热化学方程式:
可知合成氨反应的特点:(1)可逆反应。(2)能自发进行。(3)正反应是 放 热反应。 (4)正反应是气体物质的量 减小 的反应。2.可以增大该反应的速率的措施有 升高温度、增大压强、增大反应物浓度及使用催化剂 等;可以提高平衡混合物中氨的含量的措施有 降低温度、增大压强、增大反应物浓度 等。
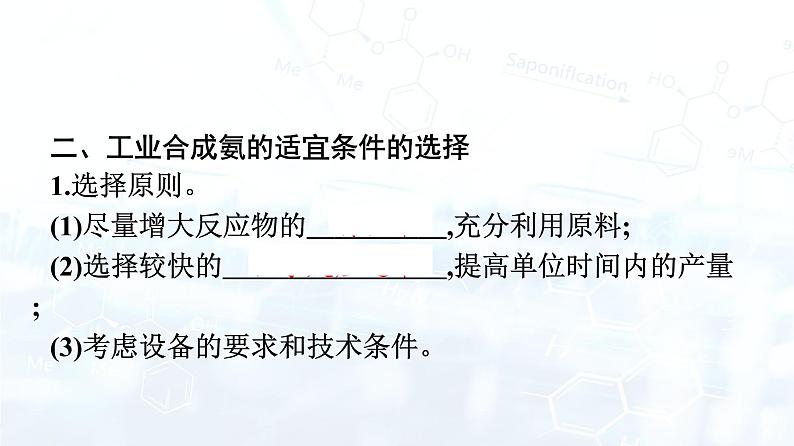
二、工业合成氨的适宜条件的选择1.选择原则。(1)尽量增大反应物的 转化率 ,充分利用原料; (2)选择较快的 化学反应速率 ,提高单位时间内的产量; (3)考虑设备的要求和技术条件。
2.工业合成氨反应的适宜条件。(1)压强。①适宜条件: 10 MPa~30 MPa 。 ②理论依据:压强越大,需要的动力 越大 ,对材料的强度和设备的制造要求就越高,这会大大增加生产投资,降低综合经济效益。
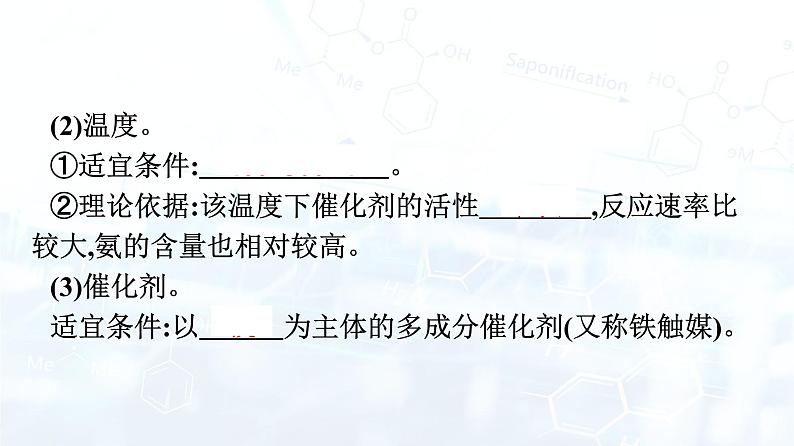
(2)温度。①适宜条件: 400~500 ℃ 。 ②理论依据:该温度下催化剂的活性 最强 ,反应速率比较大,氨的含量也相对较高。 (3)催化剂。适宜条件:以 铁 为主体的多成分催化剂(又称铁触媒)。
(4)浓度。①适宜条件:采用迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去;原料气循环使用,及时补充N2和H2。②理论依据:减小生成物浓度,提高反应物的转化率。
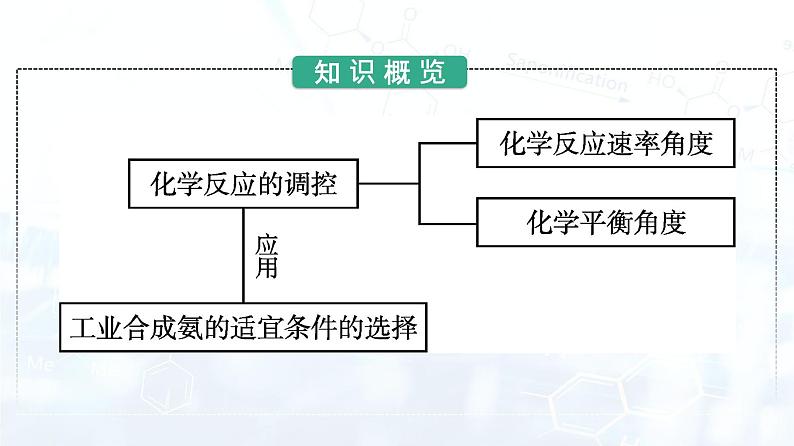
三、化学反应的调控影响化学反应进行的因素有两个方面,一是参加反应的物质的 组成、结构和性质 等本身因素,二是 温度、压强、浓度、催化剂 等反应条件。化学反应的调控,就是通过改变 反应条件 使一个可能发生的反应按照某一方向进行,综合考虑影响 化学反应速率 和 化学平衡 的因素。
1.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )。A.使用铁触媒,使N2和H2混合气体有利于合成氨B.高压比常压条件更有利于合成氨的反应C.400~500 ℃比室温更有利于合成氨的反应D.合成氨时采用循环操作,可提高原料的利用率答案:B
解析:催化剂不影响平衡移动;合成氨采用400~500 ℃是综合考虑反应速率、转化率及催化剂的活性后选择的温度;采用循环操作与平衡移动无关。
2.一定条件下,将10.0 ml H2和1.0 ml N2充入恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),并达到平衡状态,则H2的转化率可能是( )。A.15%B.30%C.35%D.75%答案:A
3.合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ· ml-1,K=6.6×105。(1)从平衡常数来看,反应的限度已经很大了,还需要使用催化剂的原因是 。 (2)试分析实际生产中采取400~500 ℃的温度的原因是 。 (3)压强越大越有利于合成氨平衡正向移动和增大化学反应速率,而实际采用的压强为10 MPa~30 MPa,不采用更高的压强,其原因是 。
答案:(1)增大化学反应速率,提高单位时间的产量(2)温度升高,不利于增大反应物的转化率,温度过低,反应速率小,单位时间内NH3的产量低,并且在此温度时,催化剂的活性最大(3)实际生产中,应根据反应设备可使用的钢材质量及综合指标来选择压强。采用更高的压强,对设备和材料的要求越高,需要的动力越大,会增加投资和能量消耗,降低综合经济效益
工业生产中选择适宜生产条件的思路重难归纳1.分析化学反应的特点:从可逆性、反应前后气体体积的变化、焓变三个角度分析。2.根据反应特点具体分析外界条件对化学反应速率和化学平衡的影响。3.从化学反应速率和化学平衡的角度进行综合分析,再充分考虑实际情况,选出适宜的外界条件。
工业合成氨中如何调整反应物浓度以提高氨气产量?提示:合成氨反应中,反应物的转化率并不高,如果让N2和H2的混合气体只一次通过合成塔是很不经济的,应将分离NH3后的未转化的合成气进行循环使用,并及时补充N2和H2,使反应物保持一定的浓度,有利于合成氨反应的进行。
典例剖析下列关于工业合成氨的叙述中,错误的是( )。A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行B.温度越高越有利于工业合成氨C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动答案:B
解析:合成氨的反应为放热反应,温度越高,NH3的产率越低,且温度太高会影响催化剂的催化效果。
【拓展延伸】 合成氨反应达到平衡后,加入N2,当反应重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的小,对吗?答案:不对。加入N2,平衡正向移动,反应重新达到平衡后,NH3的浓度比原平衡的大,N2的浓度也比原平衡的大。
方法归纳 合成氨反应条件和选择依据。工业生产中,必须从反应限度和反应速率两个角度选择合成氨的适宜条件,既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较大的反应速率,提高单位时间内的产量,同时还要考虑设备的要求和技术条件。
学以致用可逆反应3H2(g)+N2(g) 2NH3(g) ΔH
相关课件
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控图文课件ppt,共29页。
这是一份高中化学人教版 (2019)选择性必修1第四节 化学反应的调控优秀课件ppt,共23页。PPT课件主要包含了学习目标,的动力越大,有利于生产的条件等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第四节 化学反应的调控说课ppt课件,共18页。PPT课件主要包含了化学反应的调控,合成氨的反应历程,思考与讨论1,影响因素,思考与讨论2,课堂练习等内容,欢迎下载使用。









