




还剩8页未读,
继续阅读
成套系列资料,整套一键下载
人教版 (2019) 高中 化学 选择性必修1 第三章 章末核心素养整合 课件
展开
这是一份人教版 (2019) 高中 化学 选择性必修1 第三章 章末核心素养整合 课件,共15页。
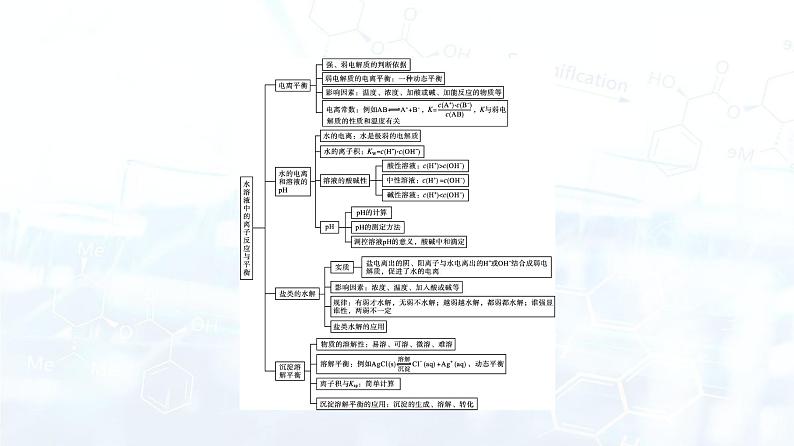
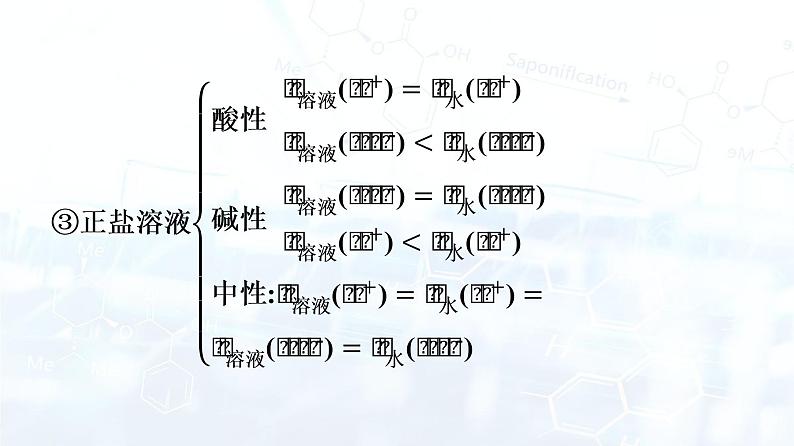
章末核心素养整合专题一 溶液中水的电离分析 1.水电离出的c水(H+)或c水(OH-)的计算(常温下)。(1)c水(OH-)和c水(H+)的关系。由H2O H++OH-可知,不论何种温度,何种溶液,由H2O电离的c水(OH-)和c水(H+)永远相等。(2)pH的意义。pH=-lgc溶液(H+),所以由pH=a可以直接推出溶液中c溶液(H+)=10-a mol·L-1。如常温下,pH=13的CH3COONa溶液中,c(H+)=10-13 mol·L-1、c(OH-)=10-1 mol·L-1,溶液中的OH-、H+均全部来自水的电离,但CH3COO-水解消耗掉水电离的部分H+,所以溶液中的H+比水电离的H+少,c水(H+)=c水(OH-)=c溶液(OH-)=10-1 mol·L-1。【典型例题1】常温下,0.1 mol·L-1的某一元酸HA在水中有1%发生电离,回答下列各问题。(1)该溶液的pH= 。 (2)HA的电离平衡常数K= 。 (3)升高温度时,K将 (填“增大”“减小”或“不变”,下同),pH将 。 (4)由HA电离出的c(H+)约为水电离出的c(H+)的 倍。答案:(1)3 (2)1×10-5 (3)增大 减小 (4)108 专题二 溶液中粒子浓度的大小关系 1.解题流程。2.掌握“四个”步骤。(1)判断反应产物:判断两种溶液混合时生成了什么物质,是否有物质过量,再确定反应后溶液的组成。(2)写出反应后溶液中存在的平衡:根据溶液的组成,写出溶液中存在的所有平衡(水解平衡、电离平衡),尤其注意不要漏水的电离平衡。这一步的主要目的是分析溶液中存在的各种粒子及比较直接地看出某些粒子浓度间的关系,在具体应用时要注意防止遗漏。(3)列出溶液中存在的等式:根据反应后溶液中存在的溶质的守恒原理,列出两个重要的等式,即电荷守恒式和物料守恒式,据此可列出溶液中阴、阳离子间的数学关系式。(4)比大小:根据溶液中存在的平衡和题给条件,结合平衡的有关知识,分析哪些平衡进行的程度相对大一些,哪些平衡进行的程度相对小一些,再依次比较溶液中各粒子浓度的大小。这一步是溶液中粒子浓度大小比较中最重要的一步,关键是要把握好电离平衡和水解平衡两大理论,树立“主次”意识。【典型例题2】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)= ]。下列叙述错误的是( )。A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-4.2C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)=c(A2-)=c(H+)答案:D
章末核心素养整合专题一 溶液中水的电离分析 1.水电离出的c水(H+)或c水(OH-)的计算(常温下)。(1)c水(OH-)和c水(H+)的关系。由H2O H++OH-可知,不论何种温度,何种溶液,由H2O电离的c水(OH-)和c水(H+)永远相等。(2)pH的意义。pH=-lgc溶液(H+),所以由pH=a可以直接推出溶液中c溶液(H+)=10-a mol·L-1。如常温下,pH=13的CH3COONa溶液中,c(H+)=10-13 mol·L-1、c(OH-)=10-1 mol·L-1,溶液中的OH-、H+均全部来自水的电离,但CH3COO-水解消耗掉水电离的部分H+,所以溶液中的H+比水电离的H+少,c水(H+)=c水(OH-)=c溶液(OH-)=10-1 mol·L-1。【典型例题1】常温下,0.1 mol·L-1的某一元酸HA在水中有1%发生电离,回答下列各问题。(1)该溶液的pH= 。 (2)HA的电离平衡常数K= 。 (3)升高温度时,K将 (填“增大”“减小”或“不变”,下同),pH将 。 (4)由HA电离出的c(H+)约为水电离出的c(H+)的 倍。答案:(1)3 (2)1×10-5 (3)增大 减小 (4)108 专题二 溶液中粒子浓度的大小关系 1.解题流程。2.掌握“四个”步骤。(1)判断反应产物:判断两种溶液混合时生成了什么物质,是否有物质过量,再确定反应后溶液的组成。(2)写出反应后溶液中存在的平衡:根据溶液的组成,写出溶液中存在的所有平衡(水解平衡、电离平衡),尤其注意不要漏水的电离平衡。这一步的主要目的是分析溶液中存在的各种粒子及比较直接地看出某些粒子浓度间的关系,在具体应用时要注意防止遗漏。(3)列出溶液中存在的等式:根据反应后溶液中存在的溶质的守恒原理,列出两个重要的等式,即电荷守恒式和物料守恒式,据此可列出溶液中阴、阳离子间的数学关系式。(4)比大小:根据溶液中存在的平衡和题给条件,结合平衡的有关知识,分析哪些平衡进行的程度相对大一些,哪些平衡进行的程度相对小一些,再依次比较溶液中各粒子浓度的大小。这一步是溶液中粒子浓度大小比较中最重要的一步,关键是要把握好电离平衡和水解平衡两大理论,树立“主次”意识。【典型例题2】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)= ]。下列叙述错误的是( )。A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-4.2C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)=c(A2-)=c(H+)答案:D
相关资料
更多









