
所属成套资源:全套2023届高考化学二轮复习作业含解析
2023届高考化学二轮复习化学反应速率与化学平衡作业含解析
展开
这是一份2023届高考化学二轮复习化学反应速率与化学平衡作业含解析,共35页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
化学反应速率与化学平衡
一、选择题(本大题共12小题)
1.(2022·山东济南·二模)均相芬顿反应原理是高级氧化技术的经典工艺之一,如图所示(和为速率常数)。下列说法错误的是
A.相同条件下,基元反应Ⅰ比Ⅱ的活化能低
B.基元反应Ⅰ中氧元素的化合价没有发生变化
C.基元反应Ⅱ的化学方程式为
D.芬顿反应进行的过程中,整个体系的几乎不变(忽略体积变化)
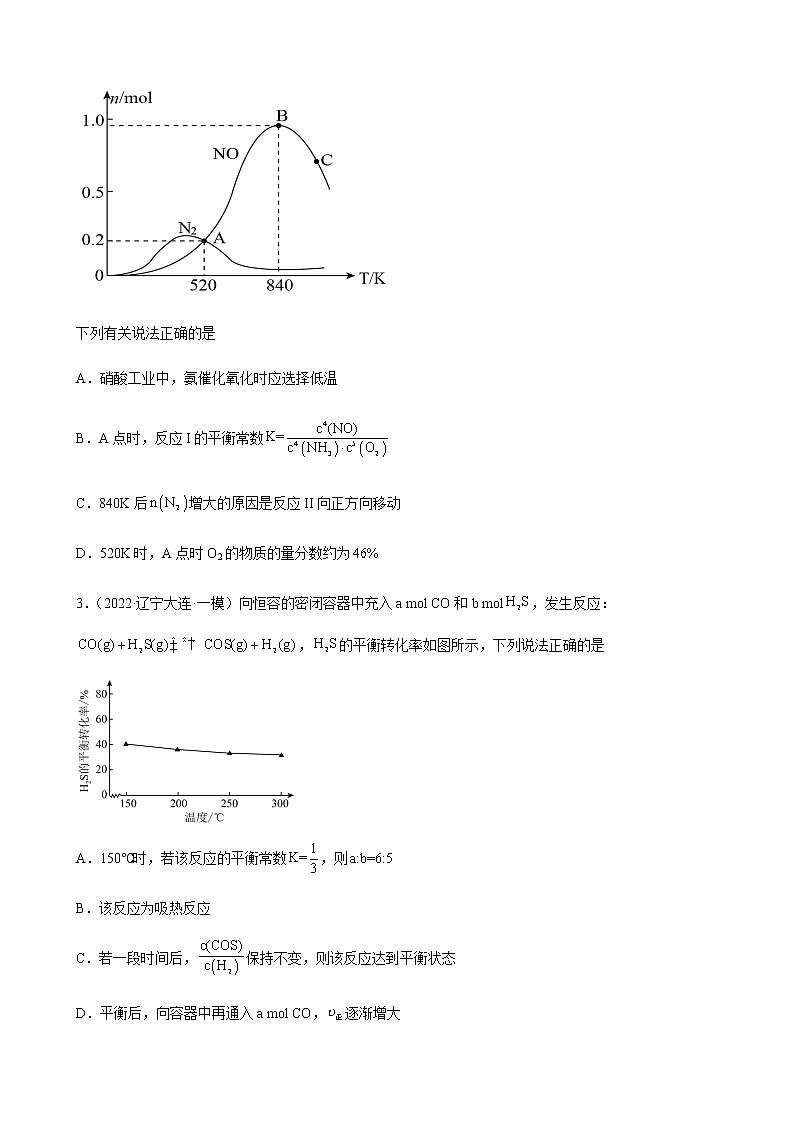
2.(2022·江苏扬州·一模)氨的催化氧化是工业制硝酸的基础,反应时会发生如下两个竞争反应I、II。
I
II
为分析催化剂对该反应的选择性,在密闭容器中充入和,测得有关产物的物质的量与温度的关系如图。
下列有关说法正确的是
A.硝酸工业中,氨催化氧化时应选择低温
B.A点时,反应I的平衡常数
C.840K后增大的原因是反应II向正方向移动
D.520K时,A点时O2的物质的量分数约为
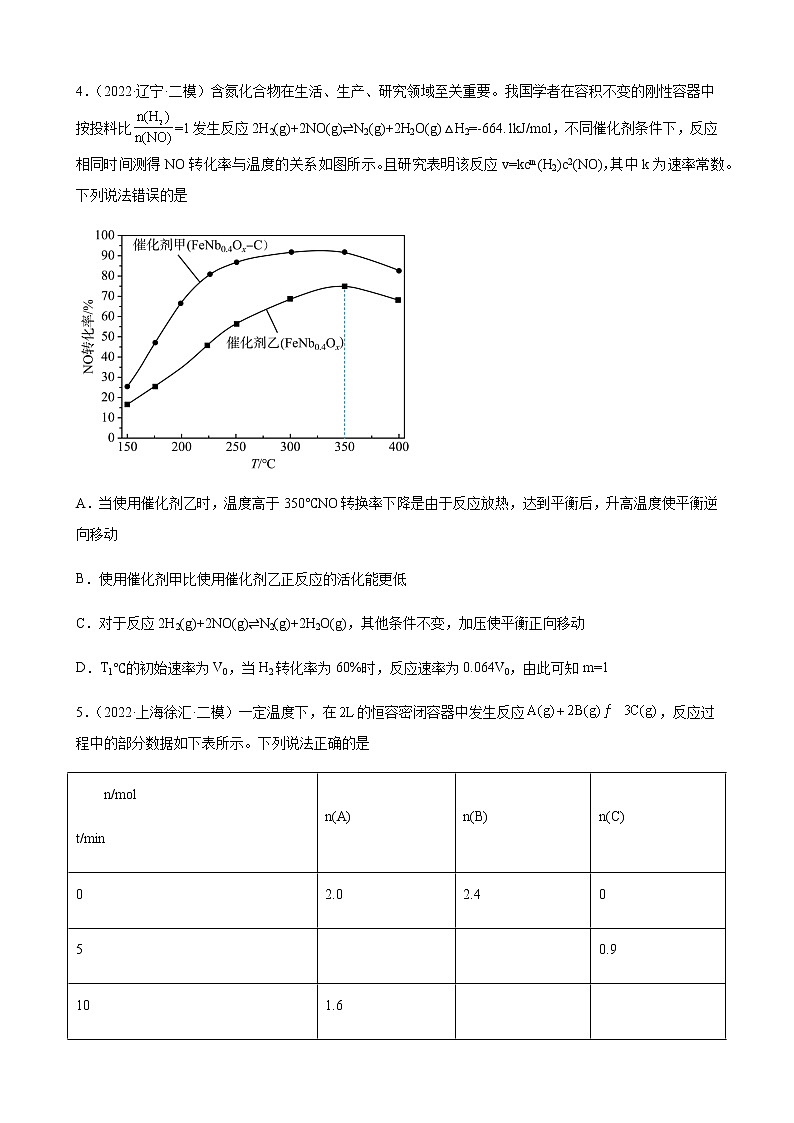
3.(2022·辽宁大连·一模)向恒容的密闭容器中充入a mol CO和b mol,发生反应:,的平衡转化率如图所示,下列说法正确的是
A.150℃时,若该反应的平衡常数,则
B.该反应为吸热反应
C.若一段时间后,保持不变,则该反应达到平衡状态
D.平衡后,向容器中再通入a mol CO,逐渐增大
4.(2022·辽宁·二模)含氮化合物在生活、生产、研究领域至关重要。我国学者在容积不变的刚性容器中按投料比=1发生反应2H2(g)+2NO(g)⇌N2(g)+2H2O(g) △H2=-664.1kJ/mol,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图所示。且研究表明该反应v=kcm(H2)c2(NO),其中k为速率常数。下列说法错误的是
A.当使用催化剂乙时,温度高于350℃NO转换率下降是由于反应放热,达到平衡后,升高温度使平衡逆向移动
B.使用催化剂甲比使用催化剂乙正反应的活化能更低
C.对于反应2H2(g)+2NO(g)⇌N2(g)+2H2O(g),其他条件不变,加压使平衡正向移动
D.T1℃的初始速率为V0,当H2转化率为60%时,反应速率为0.064V0,由此可知m=1
5.(2022·上海徐汇·二模)一定温度下,在的恒容密闭容器中发生反应,反应过程中的部分数据如下表所示。下列说法正确的是
n/mol
t/min
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
A.物质B的平衡转化率为
B.该反应在后才达到平衡
C.平衡状态时,
D.用A表示的平均反应速率为
6.(2022·辽宁大连·一模)某温度下,改变0.1mol/L溶液的pH时,各种含铬元素粒子及浓度变化如图所示(已知a是二元酸),下列有关说法正确的是
A.该温度下的
B.溶液中存在平衡,且该温度下此反应的平衡常数
C.E点溶液中存在:
D.向溶液中,加入一定量NaOH固体,溶液橙色加深
7.(2022·江苏·模拟预测)氮及其化合物在生产生活中具有广泛用途。是一种重要的化工原料,主要用于化肥工业,也广泛用于生产硝酸。 △H=-/mol;氮的氧化物对空气有污染,已知能被溶液吸收生成配合物。对于反应 △H=-/mol,下列说法正确的是
A.该反应只有在高温条件下能自发进行
B.升高温度,该反应的平衡常数减小
C.和充分反应放出的热量为
D.断裂键的同时生成键,说明反应达到平衡状态
8.(2022·上海·二模)某温度下,改变0.1mol/LK2Cr2O7溶液的pH时,各种含铬元素微粒及OH-浓度变化如图所示(已知H2CrO4是二元酸),下列有关说法中正确的是
A.该温度下的Kw=10-13
B.溶液中存在平衡+H2O⇌2+2H+,该温度下此反应的K=10-13.2
C.向0.1mol/LK2Cr2O7溶液中加入一定量NaOH固体,溶液橙色加深
D.E点溶液中存在:c(K+) > 增加 正向
(3) 9 3.4
【解析】
(1)
由图可知,作催化剂时,CO2的转化率大、CH4的选择性高,所以工业上应选择的催化剂是,320℃时CO2的转化率最大,CH4的选择性高,即的催化效率最高,所以合适温度是320℃;
(2)
①根据盖斯定律,由Ⅰ+Ⅱ=Ⅲ,则,,由图可知,当温度为时,,则。
②由图可知,横坐标为,则横坐标越大,温度越低,反应Ⅱ和Ⅲ的随着温度的降低而增大,反应Ⅲ的增大的幅度小于反应Ⅱ,降低温度,减小,则反应Ⅰ为吸热反应,因此正反应的活化能>逆反应的话化能;AB两点都是平衡点,温度越高反应速率越大,A点温度高于B点,因此对于反应Ⅱ>;
③将容器的体积压缩为原来的一半,压强增大,反应Ⅱ平衡均正向移动,则的物质的量增加;CO2浓度增大、CO浓度减小,所以平衡Ⅰ将正向移动;
(3)
条件下,向某真空容器中充入和的混合气体(体积之比为1∶4),容器中初始压强为,反应初始、,在催化剂作用下反应经达到平衡,测得容器中、,反应Ⅱ生成的,反应Ⅰ消耗的,所以反应Ⅰ生成的9;反应Ⅰ消耗的、反应Ⅱ消耗的 , 3.4。
20.(1)-1222.9kJ/mol
(2)小于
(3) a 2
(4) 4SO2+2V2O5+O2=4VOSO4 4VOSO4+O2=2V2O5+4SO3 氧气浓度过高,SO2、NO分子不能很好地被吸附
【解析】
(1)
由①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-233kJ·mol-1,②N2(g)+O2(g)⇌2NO(g)△H2=+179kJ·mol-1,
③2NO(g)+O2(g)⇌2NO2(g)△H3=-111.9kJ·mol-1
根据盖斯定律,反应2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)可由①×4-②+③得到,因此△H=△H1×4-△H2+△H3=-233kJ·mol-1×4-179kJ·mol-1+(-111.9kJ·mol-1)=-1222.9kJ/mol。
(2)
活化能越大反应速率越慢,第一步反应为快反应,反应的活化能小,则Ea(第一步)小于Ea(第二步)。
(3)
由反应iii.可知,升高温度,反应iii的化学平衡逆向移动,平衡时NO2的物质的量分数随温度升高而增大,N2O4的物质的量分数随温度升高而减小,则曲线表示NO2的物质的量分数与温度的变化关系,若时,混合气体的物质的量为,温度升高至,反应进行至时,恰好达到平衡,该过程以表示的平均化学反应速率为,根据三段式分析可得:,则条件下,由图可知,(a+2V0Vt)=Z-a-V0Vt,解得:a=,平衡时的的物质的量Z-a-V0Vt=mol,此时摩尔分数平衡常数==2,故答案为:NO2;mol;2;
(4)
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,说明VOSO4是中间体,反应过程中生成了VOSO4、又消耗了VOSO4,因此该脱硫反应过程可描述为:SO2与V2O5作用形成具有VOSO4结构的中间体;VOSO4中间体与气相的O2反应生成SO3和,或者用化学方程式表示为:4SO2+2V2O5+O2=4VOSO4,4VOSO4+O2=2V2O5+4SO3。
②若氧气浓度过高,O2、SO2和NO分子会产生竞争吸附的局势,当O2分子占据催化剂过多的活性位时,剩余的SO2、NO分子就不能很好地被吸附,从而导致脱硫脱硝率下降。
21.(1)-a-3b-
(2) 3 30% 0.57 增大CO的物质的量
(3) C 反应Ⅰ的活化能小于反应Ⅱ的活化能,反应Ⅰ的反应速率快于反应Ⅱ,相同时间内获得的产物的浓度自然反应Ⅰ比反应Ⅱ多 温度590K,R=2.5
【解析】
(1)
①2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
②NaCl(aq)+H2O(l)=NaClO(aq)+H2(g) ΔH=b kJ·mol-1
③4Na2FeO4(aq)+10H2O(l)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) ΔH=c kJ·mol-1
根据盖斯定律,-③-②×3-①×得2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(l)的ΔH=-a-3b-c kJ·mol-1。
(2)
①0~15 s时CO的变化物质的量为2.5mol-1.75mol=0.75mol,则Cl2的变化物质的量也为0.75mol,Cl2的平均反应速率为=0.05mol/(L·s)=3mol·L-1·min-1;
②反应进行到15s时达到第一次平衡,CO的平街转化率为=30%;此时平衡体系内CO为1.75mol/L、Cl2为0.75mol/L、COCl2为0.75mol/L,该反应的平衡常数K==0.57;
③在第20 s时,CO的物质的量瞬间迅速增大,然后平衡正向进行,说明此时改变的条件是增大CO的物质的量;
(3)
①A.反应前后气体分子总数不变,总物质的量不变,利用相同条件下,压强之比等于气体物质的量之比,即气体压强始终保持不变,压强不变不能说明该反应达到平衡,故A不符合题意;
B.平衡常数只与温度有关,温度不变平衡常数始终不变,因此平衡常数不变不能说明反应达到平衡,故B不符合题意;
C.正(H2S)表示正反应速率,逆(HCl)表示逆反应速率,化学反应速率之比等于化学计量数之比,因此正(H2S)=逆(HCl)说明反应达到平衡,故C符合题意;
D.组分都是气体,则气体总质量始终不变,容器为恒容状态,气体总体积保持不变,根据密度的定义,气体密度始终不变,气体密度不变,不能说明反应达到平衡,故D不符合题意;
故答案为C;
②C6H5-Cl由反应Ⅰ生成,C6H6由反应Ⅱ生成,图2显示温度较低时C6H5-Cl浓度的增加程度大于C6H6,说明反应Ⅰ的活化能小于反应Ⅱ的活化能,反应Ⅰ的反应速率快于反应Ⅱ,相同时间内获得的产物的浓度自然反应Ⅰ比反应Ⅱ多;根据图2和图3的数据信息,该模拟工业生产制备C6H5-Cl的适宜条件为温度590K,R=2.5。
22.(1) 对实验无影响 滴加NaOH溶液至
(2) 和
(3) Mg和溶液反应使溶液中的被消耗,反应体系的碱性增强,不利于释放 当容器中反应物量大时,产生的热量会加速溶液分解
【解析】
(1)
碳酸氢钠溶液呈碱性,原因是碳酸氢根水解,离子方程式为:;实验组1中用的是溶液,实验现象与对照组一样,则说明对实验无影响;为了控制变量与对照组一致,实验组2应在1mo/L 溶液中滴加NaOH溶液至;故答案为:;对实验无影响;滴加NaOH溶液至;
(2)
同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声,说明该气体可燃,应该含有氢气,再将产生的气体通入澄清石灰水,溶液变浑浊,应该含有二氧化碳,由此推测气体成分为和;
溶液可以通过自耦电离产生,该反应的平衡常数为:,故答案为:和;;
(3)
由图像可知,加入Mg条后,释放受到抑制,原因是Mg和溶液反应使溶液中的被消耗,反应体系的碱性增强,不利于释放;实验时取少量溶液、少量镁条的原因是当容器中反应物量大时,产生的热量会加速溶液分解;故答案为:Mg和溶液反应使溶液中的被消耗,反应体系的碱性增强,不利于释放;当容器中反应物量大时,产生的热量会加速溶液分解。
相关试卷
这是一份新高考化学二轮复习精选练习专题09 化学反应速率与化学平衡 (含解析),共15页。
这是一份新高考化学二轮复习检测卷专题09 化学反应速率与化学平衡(含解析),共15页。试卷主要包含了25倍,5和pH = 8等内容,欢迎下载使用。
这是一份新高考化学二轮复习精品讲义专题09 化学反应速率与化学平衡(含解析),共14页。









