





所属成套资源:【新教材】高中化学苏科版(2019)选择性必修2同步精品课件=教案
苏教版 (2019)选择性必修2第一单元 分子的空间结构评课ppt课件
展开
这是一份苏教版 (2019)选择性必修2第一单元 分子的空间结构评课ppt课件,文件包含41分子的空间结构第3课时教案docx、41分子的空间结构第3课时课件pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
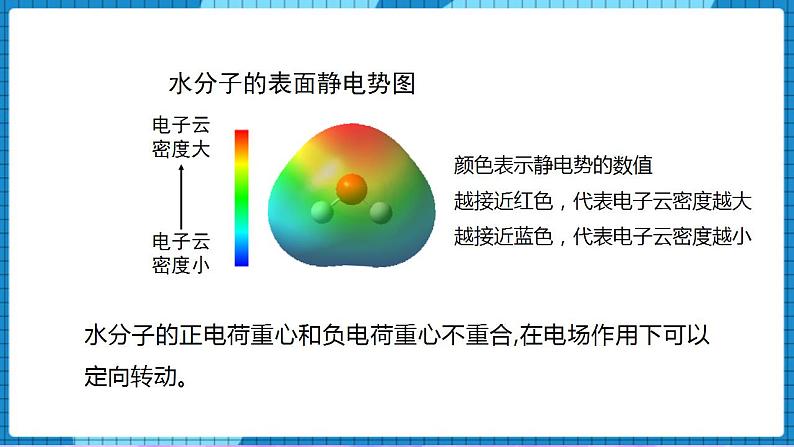
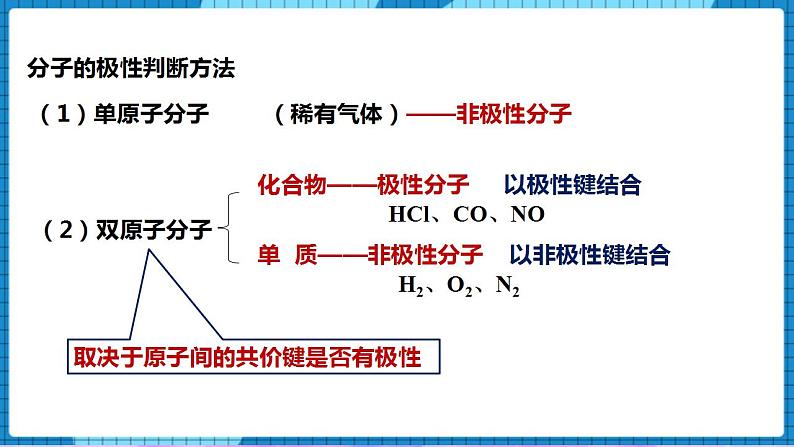
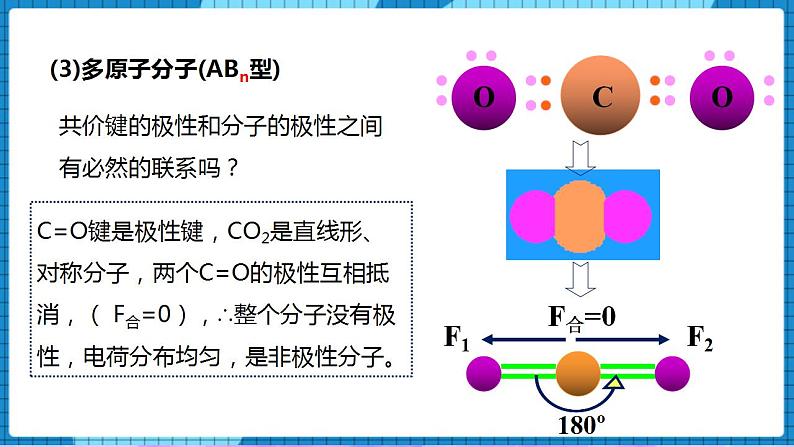
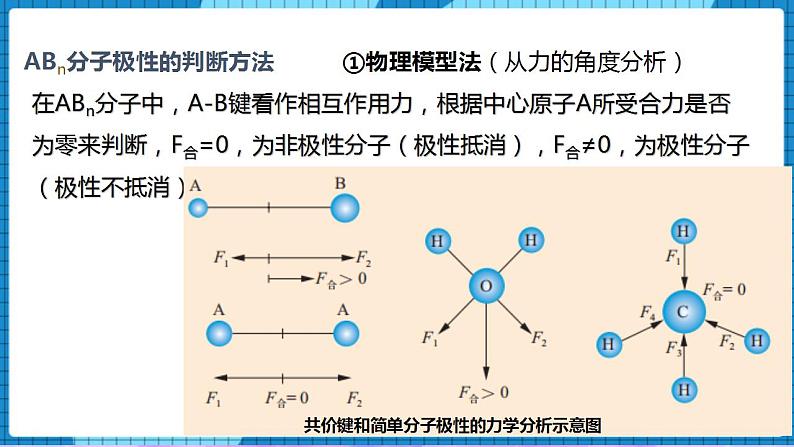
4.1分子的空间结构(第3课时)一、核心素养发展目标1、了解极性分子、非极性分子、手性分子的概念,能从微观角度理解分子具有极性或手性的原因;2、会判断分子的极性,了解分子的极性对分子性质的影响。二、教学重点及难点重点 极性分子、非极性分子、手性分子的判定难点 极性分子、非极性分子的判定三、教学方法讲授法、讨论法四、教学工具PPT、视频五、教学过程【展示】微波炉的加热原理过程【讲述】众多的水分子随电磁场定向转动,因频繁相互间摩擦损耗,使电磁能转化为热能。【展示】水分子的表面静电势图【讲述】水分子的正电荷重心和负电荷重心不重合,在电场作用下可以定向转动。一、分子的极性【讲述】分子是电中性的,但任何分子都有一个正电荷重心和一个负电荷重心。极性分子:正电荷重心和负电荷重心不相重合的分子非极性分子:正电荷重心和负电荷重心相重合的分子【问】写出氢气和HF的电子式和结构式,并判断是否属于极性分子或非极性分子。【生】独立完成氢气和HF的电子式和结构式。H2 H—H 非极性共价键,由同种原子形成的共价键,电子对不发生偏移,非极性分子;HF H—F 极性共价键,由不同种原子形成的共价键,电子对发生偏移,极性分子; 分子的极性判断方法【讲述】(1)单原子分子:(稀有气体)——非极性分子 (2)双原子分子(取决于原子间的共价键是否有极性):化合物——极性分子,以极性键结合。举例:HCl、CO、NO单 质——非极性分子,以非极性键结合。举例:H2、O2、N2(3)多原子分子(ABn型)【问】共价键的极性和分子的极性之间有必然的联系吗?【展示】CO2物理受力分析模型【讲述】C=O键是极性键,CO2是直线形、对称分子,两个C=O的极性互相抵消,( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子。【展示】共价键和简单分子极性的力学分析示意图①物理模型法(从力的角度分析)在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)【展示】水的分子极性的力学分析示意图【讲述】O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子【展示】甲烷的分子极性的力学分析示意图【讲述】正四面体形 ,对称分子,C-H键的极性互相抵消( F合=0) ,是非极性分子【展示】氨气的分子极性的力学分析示意图【讲述】三角锥形, 不对称分子,键的极性不能抵消,是极性分子【展示】BF3的分子极性的力学分析示意图【讲述】平面三角形,对称分子,键的极性互相抵消( F合=0) ,是非极性分子 ②根据所含共价键的类型及分子的空间结构判断分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响。【展示】蔗糖、硼酸、萘、碘分别在H2O和CCl4溶解情况。蔗糖和硼酸易溶于H2O,难溶于CCl4;萘和碘却易溶于CCl4,难溶于H2O。【讲述】非极性溶质一般能溶于非极性溶剂,而极性溶质一般能溶于极性溶剂。“相似相溶”规则 二、手性分子【讲述】如果一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像(对映异构),在三维空间里不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。【展示】手性分子图像;左手和右手互为镜像,但不能相互叠合。【问】手性分子形成的条件是什么?【生】同一个碳原子上连有四个不同的原子(基团),互为镜像的分子在三维空间里不能叠合,互为手性异构体。【讲述】一对手性异构体的物理性质(如沸点、熔点、密度等)基本相同,但它们的旋光性和生理作用往往不同。例如,苧烯的一对手性异构体的气味就完全不同,其中一种异构体存在于云杉的球果中,具有松节油的气味;而另一种存在于橙子中,具有橙子的气味。【讲述】手性药物的研究20世纪60年代,欧洲发生的“反应停”药物事件引起了科学家的高度重视,这也引发了手性药物研究和开发的课题。人们把含有手性分子的药物称为手性药物。一种药物分子必须包含适宜的官能团,这些官能团还必须以具有生物活性的构型排列。因此,在药物的合成过程中,“左”旋和“右”旋的药物手性异构体往往会被同时制造出来。目前所用的很多药物都具有手性,它们主要通过与体内的酶、核苷酸等大分子作用,抑制(或激发)该大分子的生理活性,达到治疗疾病的目的。常用的手性药物有维生素E制剂、止痛药布洛芬等。药品布洛芬是D-异构体和L-异构体的外消旋混合物。L-布洛芬是止痛药,而D-布洛芬不是。但在人体内D-布洛芬可被转化为L-布洛芬。因此,人们直接服用外消旋混合物即可达到同样的治疗效果,而不需要服用更昂贵的L-布洛芬。手性分子的应用2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成为药物生产造福人类并带来巨大的经济效益。 【课堂小结】师生一起回顾和总结。【课堂练习】1.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )A.①④⑥ B.②③⑥ C.①④ D.①③④⑤答案:C2、根据等电子原理,下列各组分子或离子的空间结构不相似的是( )A. SO2和O3 B. NH4+和CH4 C. H3O+和NH3 D. CO2和H2O答案:D3.下列关于粒子结构的描述不正确的是( )A.H2S和NH3均是价电子总数为8的极性分子B.HS-和HCl均是含1个极性键的18电子粒子C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形 答案:C
相关课件
这是一份高中鲁科版 (2019)第2节 共价键与分子的空间结构授课ppt课件,共17页。PPT课件主要包含了一手性分子,手性异构体,CHBrClF分子,看图整理,手性分子,有手性异构体的分子,手性碳原子,乳酸分子两种异构体,手性分子的判断方法,不能重合是手性分子等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优秀课件ppt,共27页。PPT课件主要包含了核心素养,杂化轨道理论,激发态,对杂化过程的理解,归纳总结,正四面体,°28′,平面三角形,CH2CH2中的C,基态原子等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第二节 分子的空间结构精品ppt课件,共28页。PPT课件主要包含了核心素养,分子结构的测定,化学性质,红外光谱,晶体X射线衍射,化学键,吸收峰,谱图库,量子化学,官能团等内容,欢迎下载使用。









