




高中化学苏教版 (2019)选择性必修2第二单元 配合物的形成和应用教案配套ppt课件
展开4.2配合物的形成和应用(第1课时)
一、核心素养发展目标
1、认识简单配位化合物的成键特征;能正确运用化学符号描述配合物的组成;
2、学会简单配合物的实验制备;能联系配合物的组成和结构解释相关的实验现象;
二、教学重点及难点
重点 运用化学符号描述配合物的组成
难点 运用化学符号描述配合物的组成
三、教学方法
讲授法、讨论法
四、教学工具
PPT、视频
五、教学过程
【讲述】配位化合物在生产、生活和科技等方面都具有十分重要的应用。植物光合作用所需要的叶绿素是一种镁的配合物,动物细胞中载氧的血红素是一种铁的配合物,化工生产、污水处理、汽车尾气的净化、模拟生物固氮等领域都需要一些特殊性能的配合物作催化剂。 因此,认识配合物的结构和性能有着重要的意义。
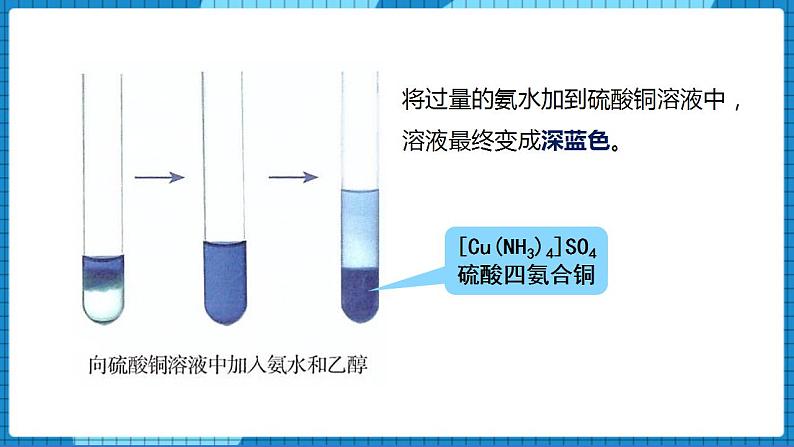
【展示】实验视频:
向试管中加入2 mL 5%的硫酸铜溶液,再逐滴加入浓氨水,振荡,观察并记录实验现象。
【问】现象是什么?
【生】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,加入乙醇后析出深蓝色晶体。
【讲述】深蓝色的物质是[Cu(NH3)4]SO4 ,名称是:硫酸四氨合铜
将[Cu(NH3)4]SO4 溶于水,[Cu(NH3)4]SO4 发生下列电离:
[Cu(NH3)4]SO4 === [Cu(NH3)4]2+ + SO42-
[Cu(NH3)4]2+ 是四氨合铜离子,其中Cu2+和NH3分子没有电离出来,说明[Cu(NH3)4]2+中Cu2+和NH3分子之间存在较为强烈的相互作用。
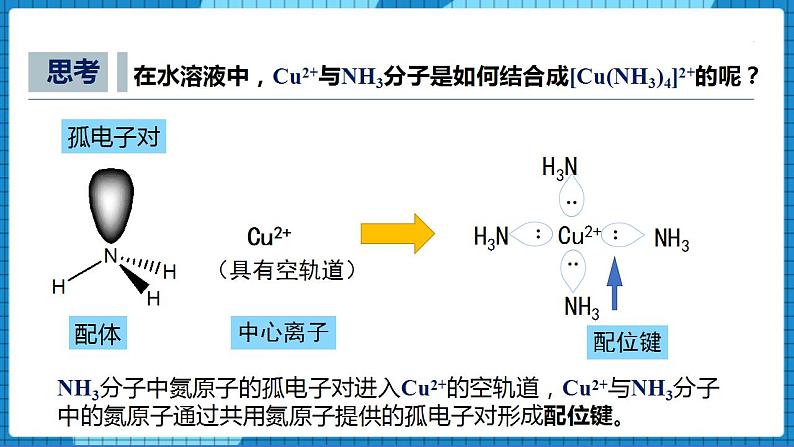
【问】思考:在水溶液中,Cu2+和NH3分子是如何结合成[Cu(NH3)4]2+ 的呢?
【展示】Cu2+和NH3分子是如何结合成[Cu(NH3)4]2+ 的过程图片
【生】NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
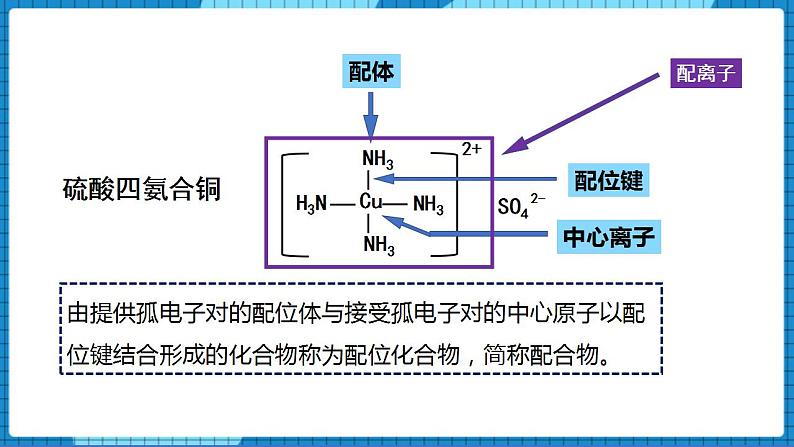
【讲述】由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物,简称配合物。
【展示】硫酸四氨合铜的配体、配位键、中心离子、配离子分别是哪些部分。
及內界和外界分别是哪些部分。
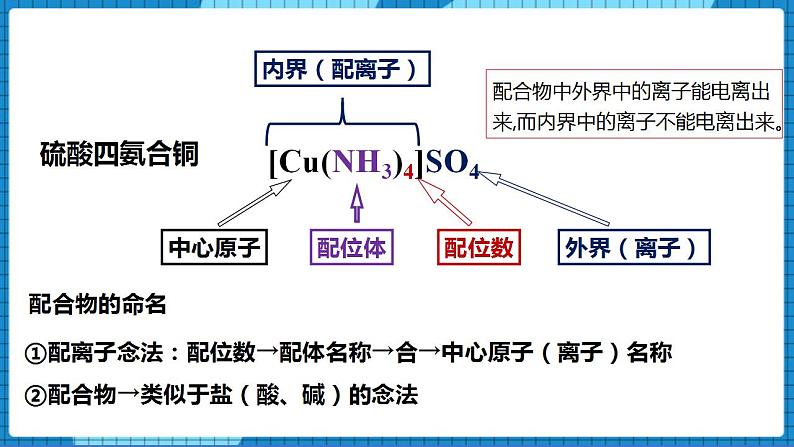
【讲述】配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
配合物的命名
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
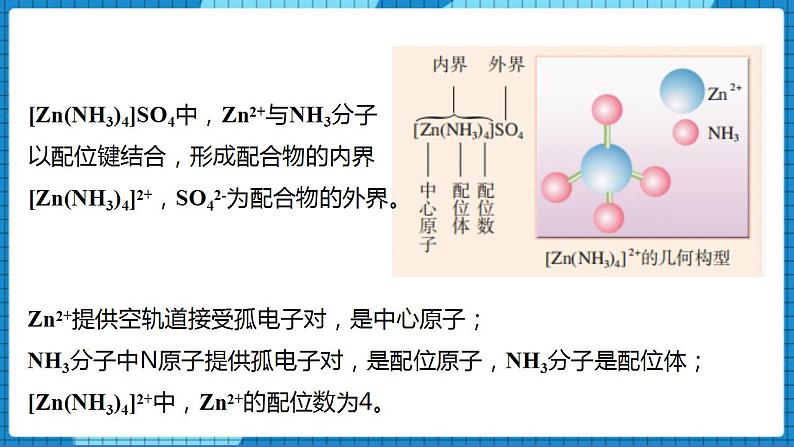
【展示】[Zn(NH3)4]SO4的组成部分及几何构型
[Zn(NH3)4]SO4中,Zn2+与NH3分子以配位键结合,形成配合物的内界[Zn(NH3)4]2+,SO42-
为配合物的外界。
【生】Zn2+提供空轨道接受孤电子对,是中心原子;
NH3分子中N原子提供孤电子对,是配位原子,NH3分子是配位体;
[Zn(NH3)4]2+中,Zn2+的配位数为4。
【问】配位键形成的条件是什么?
【生】一方提供孤电子对(配体);一方提供空轨道。
【问】在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、CO、F-、CN-中,哪些可作中心原子?哪些可作配位体?
【生】中心原子:Fe3+、Cu2+、Zn2+、Ag+
配位体:H2O、NH3、CO、F-、CN-
【讲述】中心原子(离子):提供空轨道,接受孤电子对。
通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等;
其他可提供空轨道的粒子有H+、B、Al。
配位体:提供孤电子对的分子或离子,
通常是含第ⅤA、ⅥA、ⅦA族元素形成的分子或离子,如NH3、CO、H2O、F-、Cl-、OH-、CN-、SCN-。
配位键的特点:
①配位键是一种特殊的共价键,配位键与共价键性质完全相同。
②配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
③H3O+、NH4+中含有配位键。
配位键的表示方法
(电子对给予体)A→B(电子对接受体)或A—B
【展示】H3O+、[Cu(H2O)4]2+、[Cu(NH3)4]SO4的配位键结构式图片。
【问】思考:共价键有饱和性,但NH3为什么仍能与H+结合生成NH4+呢?
【展示】NH4+形成过程动画。
【生】NH3有孤电子对,H+有空轨道,NH3中的孤电子对进入H+的空轨道,两者共用形成配位键。
二、配合物的空间结构
【讲述】含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同几何构型的配合物。
如Pt(NH3)2Cl2就有顺式和反式两种异构体。
【展示】Pt(NH3)2Cl2顺式和反式两种异构体图片。
【讲述】顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的颜色、在水中的溶解性等性质有一定的差异。
【展示】顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的颜色和抗癌活性的性质对比。
配合物离子的空间结构
过渡金属元素(特别是过渡金属元素的离子)一般都能形成配合物。因为过渡金属原子或离子都有接受电子对的空轨道,它们都能与可提供孤电子对的分子或离子以配位键结合形成配合物。
配合物的中心原子、配位体的种类和数目不同,可以形成不同空间结构的配合物。
【展示】[Ag(NH3)2]+ [Zn(NH3)4] 2+ [Ni(CN)4] 2- [AlF6] 3-的空间结构图片。
【生】[Ag(NH3)2]+ 配位数:2;杂化轨道类型:sp,空间结构:直线形;
[Zn(NH3)4] 2+ 配位数:4;杂化轨道类型:sp3,空间结构:正四面体型;
【课堂小结】师生一起回顾和总结。
一、配合物的形成
配位键:形成的条件、特点及表示方法
配合物:形成及各部分意义
二、配合物的空间结构
配合物离子的空间结构
【课堂练习】
1.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
答案:B
2.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
答案:B
3.3.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
答案:B
4.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4的中心离子是_______,配体是_________,配位数是_______。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 ,提供孤电子对的成键原子是 。
答案:Ni2+ NH3 6 配位键 N
人教版 (2019)选择性必修1第二节 电解池优秀ppt课件: 这是一份人教版 (2019)选择性必修1第二节 电解池优秀ppt课件,共24页。PPT课件主要包含了思考上述装置的缺点,电解精炼,精铜精炼,电冶金等内容,欢迎下载使用。
人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池完美版课件ppt: 这是一份人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池完美版课件ppt,共32页。PPT课件主要包含了学习目标,用途广泛的电池,笔记本电脑专用电池,手机专用电池,摄像机专用电池,各式各样的纽扣电池,一化学电池,①比能量,②比功率,化学电池等内容,欢迎下载使用。
化学选择性必修2专题4 分子空间结构与物质性质第二单元 配合物的形成和应用课前预习ppt课件: 这是一份化学选择性必修2专题4 分子空间结构与物质性质第二单元 配合物的形成和应用课前预习ppt课件,文件包含42配合物的形成和应用第2课时课件pptx、42配合物的形成和应用第2课时教案docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。













