








高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体授课课件ppt
展开3.1金属键 金属晶体(第2课时)
一、核心素养发展目标
1.能结合实例描述离子键的成键特征及其本质,能根据晶格能大小解释和预测同类型离子化合物的某些性质;
2.能描述常见类型的离子化合物的晶体结构;
3.能运用模型和有关理论解释不同类型离子化合物的晶胞构成。
二、教学重点及难点
重点 根据晶格能大小解释和预测同类型离子化合物的某些性质
难点 晶体结构及相关计算
三、教学方法
讲授法、讨论法
四、教学工具
PPT、视频、晶胞模型
五、教学过程
【导入】大多数活泼金属的氯化物和一些盐类在熔融状态下能够导电,说明这些化合物中存在
着带正电荷的阳离子和带负电荷的阴离子,这些阴、阳离子结合形成离子化合物。
钠原子与氯原子是如何结合形成氯化钠的?
【展示】氯化钠形成过程动画。
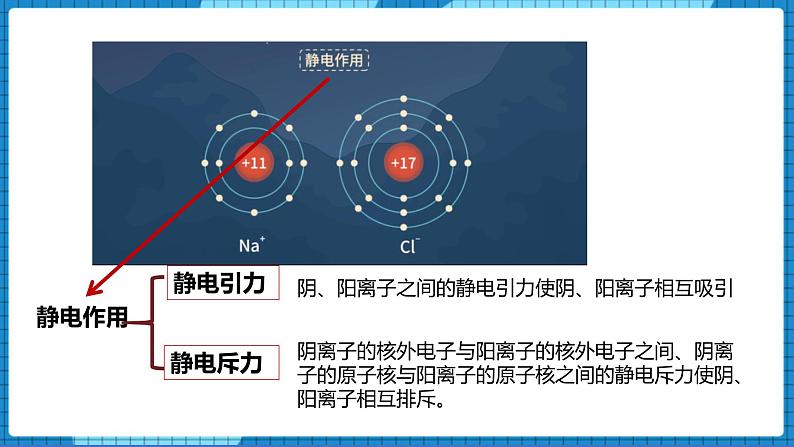
【问】静电作用包括什么?
【生】静电引力、静电斥力。
【讲述】静电引力:阴、阳离子之间的静电引力使阴、阳离子相互吸引。
静电斥力:阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。
【讲述】当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态。
【展示】钠原子与氯原子是如何结合形成氯化钠的电子式过程。
【讲述】成键条件:成键元素的原子得、失电子的能力差别很大,电负性差值大于1.7。
存在:只存在于离子化合物中:大多数盐、强碱、活泼金属氧化物、氢化物等。
离子化合物中的化学键
表示方法:电子式
有的离子化合物中只含有离子键,如MgO、NaF、MgCl2等;
有的离子化合物中既含有离子键又含有共价键,如NaOH等。
【问】请写出MgCl2和NaOH的电子式。
【生】独立写出MgCl2和NaOH的电子式。
【问】离子键有方向性和饱和性吗?
【生】通常情况下,阴、阳离子可以看成是球形对称的。阴、阳离子的电荷分布也是球形对称的,它们在空间各个方向上的静电作用相同,所以在各个方向上都可以与带相反电荷的离子发生静电作用,且在静电作用能达到的范围内,只要空间条件允许,一个离子可以同时吸引多个带相反电荷的离子。
因此,离子键没有方向性和饱和性。
二、离子晶体
【展示】常见离子晶体的图片。
【讲述】1、定义:由阴、阳离子按一定方式有规则地排列形成的晶体。
2、成键粒子:阴、阳离子
3、相互作用力:离子键
4、常见的离子晶体:强碱、活泼金属氧化物、大部分的盐类。
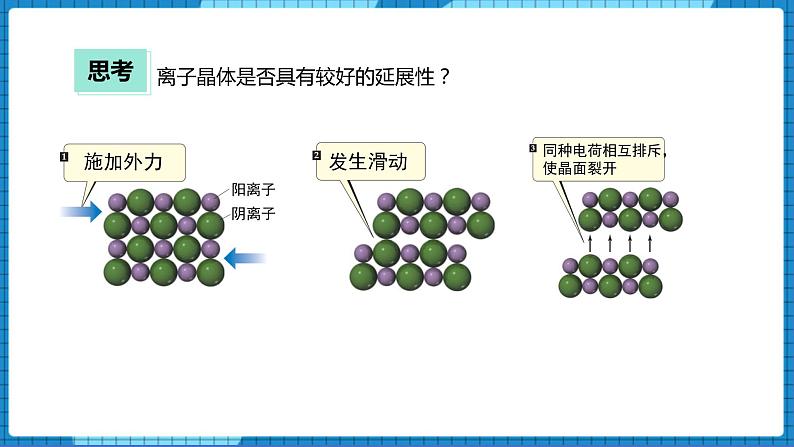
【问】离子晶体是否具有较好的延展性?
【展示】离子晶体形变的过程图片。
【生】施加外力,发生滑动,同种电荷相互排斥,使晶面裂开。
【展示】食盐晶体。
用手揉捏食盐——硬度大
烧烤、爆炒等加入食盐,未见其熔融——熔点较高(801 oC)
【讲述】离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
离子晶体中阴、阳离子间相互作用力的大小可用晶格能来衡量。
晶格能是指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量。
符号为:U
NaCl(s)→ Na+(g)+Cl-(g) U=786 kJ·mol-1
晶格能越大,离子晶体中的离子键越牢固,离子晶体的熔点越高、硬度越大。
【展示】氯化钠、溴化钠等的晶格能、离子电荷数、核间距、熔点、莫氏硬度数据。
【问】影响晶格能的因素有哪些?
【生】阴、阳离子的电荷数越多,离子半径越小,晶格能越大。
离子晶体的结构
【讲述】1、氯化钠型
【展示】NaCl晶胞的模型
【讲述】属于氯化钠型离子晶体的还有KCl、NaBr、LiF、CaO、MgO、NiO、CaS等。
【问】每个NaCl晶胞中微粒数是多少?
【展示】计算过程
【生】每个NaCl晶胞中含有4个Na+和4个Cl-, 个数比1:1。
【讲述】离子晶体中不存在单个分子,其化学式表示离子的个数比。
这几个Na+在空间构成的几何构型为正八面体。
【展示】NaCl晶胞配位数计算动画。
【讲述】每个Cl- 周围与之最接近且距离相等的Na+共有6个,每个Cl- 周围与它最近且等距的Cl- 有12个。
配位数:一个离子周围最邻近的异电性离子的数目。
2、氯化铯型
【展示】CsCl晶胞的模型
【讲述】CsCl、CsBr、CsI、NH4Cl等晶体都属于氯化铯型离子晶体。
每个CsCl晶胞中含有1个Cs+和1个Cl-, 个数比1:1。
【展示】NaCl晶胞配位数计算动画。
【讲述】Cs+和Cl- 配位数均为8。
【问】NaCl、CsCl都是AB型离子化合物,其中一种离子周围紧邻的带相反电荷的离子数目却不同。原因是什么?
【生】在NaCl晶体中,每个Na+的周围有6个Cl-,而在CsCl晶体中,每个Cs+的周围有8个Cl-。
两者的数目之所以不同,主要在于离子半径的差异。Cs+的半径要大于Na+,因而可以吸引更多的Cl-。
可见,离子晶体中不同离子周围异电性离子数目的多少主要取决于阴、阳离子的相对大小。
【讲述】硫酸铵晶体的结构
实验测得,图中“H…O”原子间的距离为199 pm,小于H与O的范德华半径之和272 pm,大于H—O共价键的键长96 pm,说明二者之间的作用力大小在范德华力和共价键之间,且N—H与H…O之间的角度为156°,也符合形成氢键的条件。
由此,可以判断SO42-与NH4+之间形成的是氢键(N—H…O),而非离子键。
晶体相关计算
1、晶体化学式的确定
【讲述】晶体的化学式表示的是晶体(也可以说是晶胞)中各类原子或离子数目的最简整数比。
【展示】四种不同晶胞类型的图片
【讲述】四种不同晶胞类型的分子式相关计算过程。
2、晶体密度
【讲述】根据晶胞结构确定各种粒子的数目求出晶胞质量,根据晶胞的边长或微粒间的距离求出晶胞体积。
单位:g·cm-3
【问】若氯化钠晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
【生】独立计算。
【问】若氯化铯晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
【生】独立计算。
【课堂小结】师生一起回顾和总结。
【课堂练习】
1、 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
答案:D
3、下图所示为某离子化合物的晶胞结构示意图,X、Y、Z表示该晶胞中三种不同的微粒,该化合物的化学式可表示为 。
答案:XY3Z
3、某离子化合物A3B的晶胞结构示意图如上图所示。晶胞中与一个B相紧邻的A有 个,与一个A相紧邻的B有 个。
答案:6 2
化学选择性必修2第3章 晶体结构与性质3.2离子晶体完美版ppt课件: 这是一份化学选择性必修2<a href="/hx/tb_c4036503_t3/?tag_id=26" target="_blank">第3章 晶体结构与性质3.2离子晶体完美版ppt课件</a>,文件包含32离子晶体教学课件pptx、32离子晶体分层作业原卷版docx、32离子晶体分层作业解析版docx等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体教学课件ppt: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体教学课件ppt,共42页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体精品ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体精品ppt课件,共13页。PPT课件主要包含了学习目标,离子键的形成等内容,欢迎下载使用。













