

山东省临沂市莒南县第二中学2022-2023学年高三上学期期末线上检测化学试题(Word版含答案)
展开A. 第一电离能:Q>Z>W
C. 简单离子半径:Z>Q>W
莒南二中20 级高三上学期期末线上测试
化学试题
相对原子质量: H 1 C 12 N14 O 16 P 31 Ca 40 V 51 Fe 56 Y 89 I 127 一、选择题:本题共 10 小题,每小题 2 分, 共 20 分, 每小题只有一个选项符合题目要求。
1. 化学与生产、生活、科技等方面密切相关,下列有关说法正确的是
A .核酸检测是确认病毒类型的有效手段,核酸是一类不含磷的高分子化合物
B .“墨子号”卫星成功发射实现了光纤量子通信, 生产光纤的原料为晶体硅
C .纤维素可以为运动员提供能量
D .“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
2. 下列说法正确的是
A .I 的原子半径大于 Br ,HI 比 HBr 的热稳定性强
B .P 的非金属性强于 Si ,H3PO4 比 H2 SiO3 的酸性强
C .Al2O3 和 MgO 均可与 NaOH 溶液反应
D .SO2 和 SO3 混合气体通入 Ba(NO3)2 溶液可得到 BaSO3 和 BaSO4
3. 1- 乙基-3- 甲基咪唑 被广泛应用于有机合成和聚合反应、分离提纯以及电化
学研究中,下列关于 1- 乙基-3- 甲基咪唑说法错误的是
A. 五元环处于同一平面,则两个氮原子的杂化方式分别为 sp3 、sp2
B. 1mol 阳离子中含有σ键数目为 19NA
C. 对无机物、有机化合物等不同物质具有良好的溶解性
D. 熔点比NaBF4 低
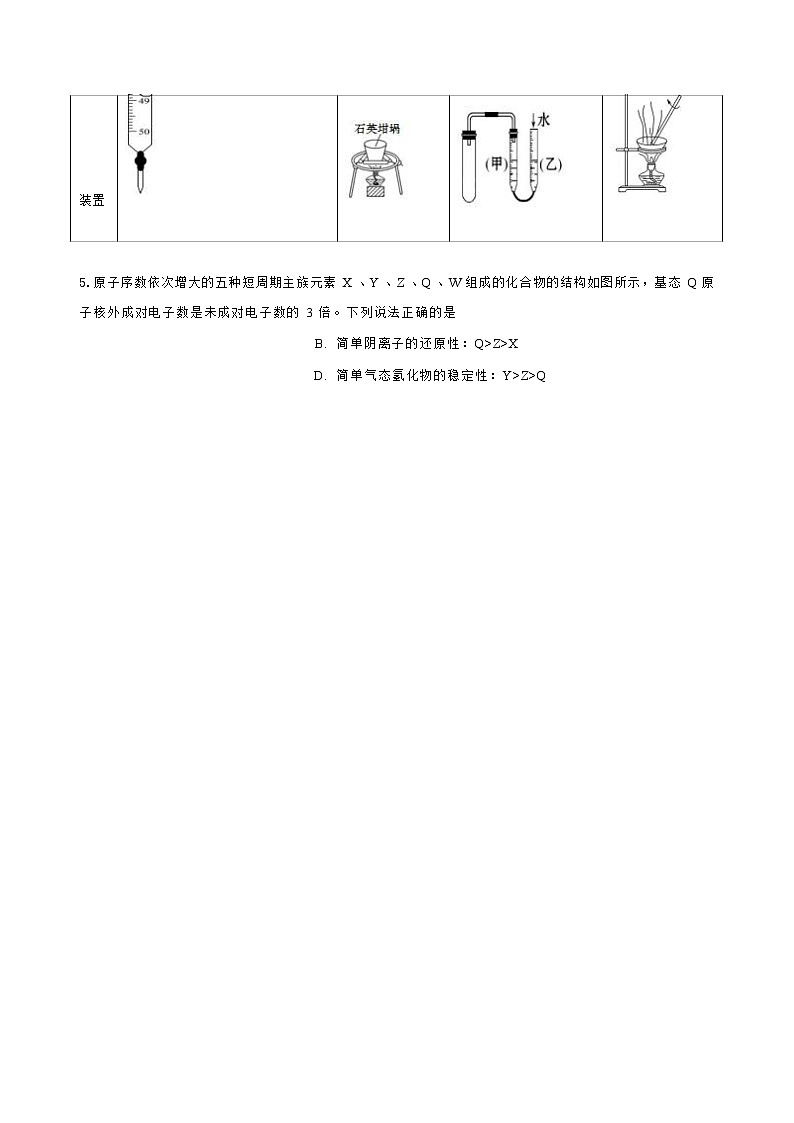
4.完成下列实验所选择的装置正确的是
选项
A
B
C
D
实验
准确量取一定体积的KMnO4 标准 溶液
高温熔融烧碱
用图示的方法检查此 装置的气密性
蒸发FeCl3 溶液
制取无水FeCl3
装置
5.原子序数依次增大的五种短周期主族元素 X 、Y 、Z 、Q 、W 组成的化合物的结构如图所示,基态 Q 原
子核外成对电子数是未成对电子数的 3 倍。下列说法正确的是
B. 简单阴离子的还原性:Q>Z>X
D. 简单气态氢化物的稳定性:Y>Z>Q
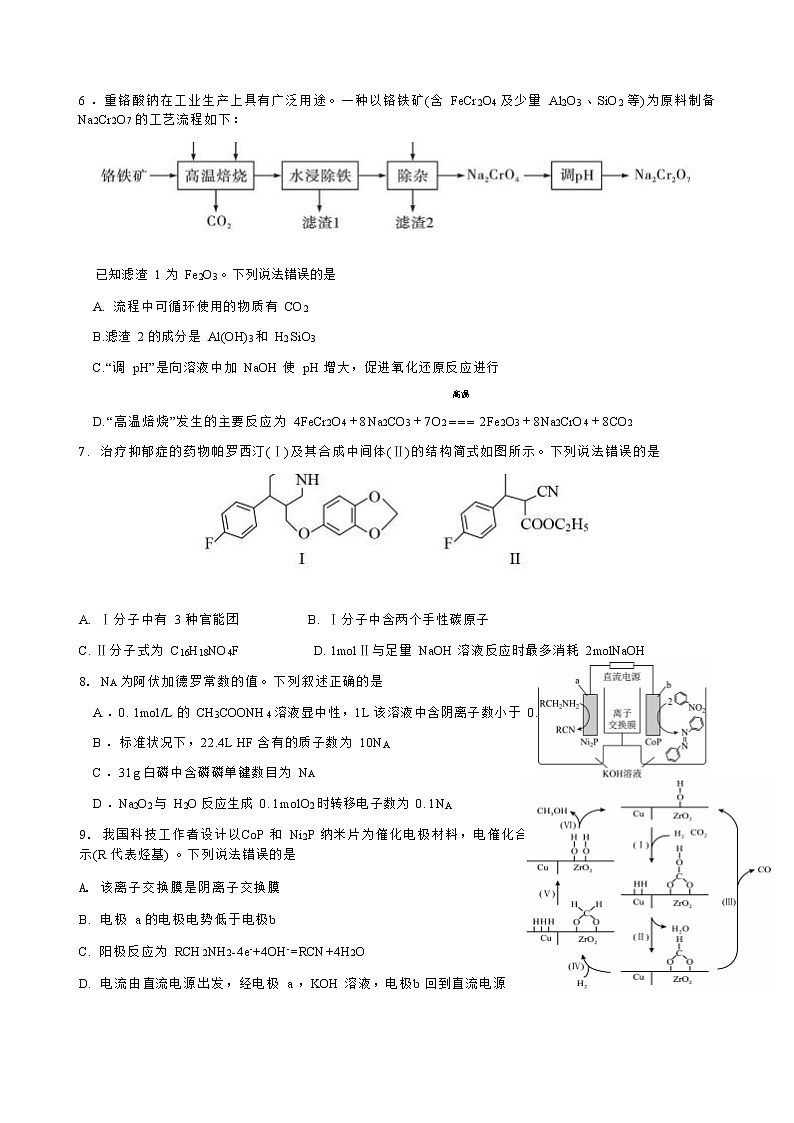
6 .重铬酸钠在工业生产上具有广泛用途。一种以铬铁矿(含 FeCr2O4 及少量 Al2O3 、SiO2 等)为原料制备 Na2Cr2O7 的工艺流程如下:
已知滤渣 1 为 Fe2O3 。下列说法错误的是
A. 流程中可循环使用的物质有 CO2
B.滤渣 2 的成分是 Al(OH)3 和 H2 SiO3
C.“调 pH”是向溶液中加 NaOH 使 pH 增大,促进氧化还原反应进行
高温
D.“高温焙烧”发生的主要反应为 4FeCr2O4+8Na2CO3+7O2 === 2Fe2O3+8Na2CrO4+8CO2
7. 治疗抑郁症的药物帕罗西汀(Ⅰ)及其合成中间体(Ⅱ)的结构简式如图所示。下列说法错误的是
A. Ⅰ分子中有 3 种官能团 B. Ⅰ分子中含两个手性碳原子
C. Ⅱ分子式为 C16H18NO4F D. 1molⅡ与足量 NaOH 溶液反应时最多消耗 2molNaOH
8. NA 为阿伏加德罗常数的值。下列叙述正确的是
A .0. 1mol/L 的 CH3COONH4 溶液显中性,1L 该溶液中含阴离子数小于 0. 1NA
B .标准状况下,22.4L HF 含有的质子数为 10NA
C .31g 白磷中含磷磷单键数目为 NA
D .Na2O2 与 H2O 反应生成 0. 1molO2 时转移电子数为 0. 1NA
9. 我国科技工作者设计以CoP 和 Ni2P 纳米片为催化电极材料,电催化合成偶氮化合物的新装置如图所 示(R 代表烃基) 。下列说法错误的是
A. 该离子交换膜是阴离子交换膜
B. 电极 a 的电极电势低于电极b
C. 阳极反应为 RCH2NH2-4e-+4OH-=RCN+4H2O
D. 电流由直流电源出发,经电极 a ,KOH 溶液,电极b 回到直流电源
10. 氢气和二氧化碳在催化剂作用下,在 180-280℃温度条件下合成甲 醇。该反应为放热反应。催化过程可解释为“吸附-活化-解离”的过程。 催化反应机理如图所示。下列说法正确的是
A. 反应过程中 I-VI 步,C 化合价一直发生变化,Cu 、Zr 的化合价一直 不变
B. 单位时间,在某一温度下,生成水最多,则此温度下甲醇产率最大
C. 增大催化剂的表面积,可以提高甲醇的平衡产率
D. 由于电负性 O>C,所以CO2 与氧化锆及吸附在氧化锆晶格表面的 OH 结合
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目要 求,全部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11. 室温下,下列实验探究方案不能得到相应结论的是
选 项
探究方案
探究结论
A
向饱和的 FeSO4 溶液中加入 CuS 固体 ,测得溶液中
c (Fe2 + ) 不变
Ksp(CuS) < Ksp(FeS)
B
将 25℃ 0. 1mol . L 1Na2 SO3 溶液加热到 40℃ ,用传感 器检测到溶液 pH 逐渐变小
温度升高, Na2 SO3 水解平衡正向移动,
HSO浓度增大
C
用 一 定 浓 度 的 NaOH 滴 定 一 定 体 积 、 浓 度 的 草 酸 ( H2 C2 O4 、弱酸)溶液(用甲基橙作指示剂)
确定草酸是二元酸
D
利用晶体 X 射线衍射可测定原子坐标
确定分子的空间结构
A. A B. B C. C D. D
12. 对废催化剂进行回收可有效利用金属资源,某含银废催化剂主要含 Ag 、 Al2O3 ( Al2 O3 为载体, 不溶于硝酸)及少量 MgO 、 SiO2 、 K2 O 、 Fe2 O3 等,一种回收制备高纯银粉工艺的部分流程如图:下列说
法正确的是
A .滤渣只含SiO2
B .气体 B 可以通入 NaOH 溶液除去
C .溶解过程的氨水可以换成氢氧化钠溶液
D .“还原”过程中生成无毒气体,B 与 C 的物质的量的理论比值为 4 ∶3
13. 据 2022 年 1 月统计,我国光伏发电并网装机容量突破 3 亿千瓦,连续七年稳居全球首位。已知四甲 基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成
[(CH3)4NOH] ,工作原理如图。下列说法正确的是
A .光伏并网发电装置中 N 型半导体为正极
B .c 、e 为阳离子交换膜,d 为阴离子交换膜
C .保持电流恒定,温度越高合成四甲基氢氧化铵的速率越快
D .制备 182g 四甲基氢氧化铵,两极共产生 33.6L 气体(标准状况)
14. 常温下,用0. 1000 molL 的 NaOH 溶液滴定 20.00mL 浓度分别为c1 、c2 的一元酸(HA) 、二元酸(H2 B)
溶液,得到如图滴定曲线,其中 c 、d 为两种酸恰好完全中和的化学计量点。忽略溶液混合时体积变化。 下列叙述正确的是。
A .X 曲线代表H2 B ,Y 曲线代表 HA , c1 > c2
B .两种酸恰好完全中和时,均可用酚酞或甲基橙作指示剂
C .若 a 点V(NaOH)=7.95mL ,则 a 点 c (Na+ ) < 2c(HB ) + c (B2 ) + 3c(H2 B)
D .若c1 = 0. 1000 molL ,对于 HA 而言,滴定过程中有c (HA)+ 2c(A ) + c (OH ) = c (H+ ) + 0. 1000 molL
15. 在一定温度下,以 I2 为催化剂,氯苯和Cl2 在CS2 中发生平行反应,生成邻二氯苯和对二氯苯,其反 应式为:反应①C6H5Cl+Cl2 =C6H4Cl2 (邻二氯苯) +HCl ΔH1
反应②C6H5Cl+Cl2 =C6H4Cl2 (对二氯苯) +HCl ΔH2
反应①和②的速率方程式分别为:① v正 =k1正 . X (C6 H5 Cl)X (Cl2 ) ;② v正 =k2正 . X (C6 H5 Cl)X (Cl2 ) ,
k正 为速率常数且只与温度有关。图为反应①和②的 lnk ~ 曲线。下列说法错误的是
A. 对二氯苯比邻二氯苯稳定,则ΔH1 <ΔH2
B. 相同温度下,反应开始后,体系中两种有机产物的浓度之比保持不变
C. 提高产物中对二氯苯的比例,适当降低反应温度和改变催化剂
D. v正 (C6 H5 Cl)=v正 (C6 H4 Cl2 ) (对二氯苯) +v正(C6 H4 Cl2) (邻二氯苯)
三、非选择题:本题共 5 小题,共 60 分。
16. 硅、硼和铁材料在生活中占有重要地位。请回答:
(1) Si(NH2)4 分子的空间结构 (以 Si 为中心) 名称为 ,分子中氮原子的杂化轨道类型是 。 Si(NH2)4 受热分解生成 Si3N4 和 NH3 ,其受热不稳定的原因是 。
(2) 由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2 、②[Ne]3s23p1 、③[Ne]3s23p14s1 ,有 关这些微粒的叙述,正确的是 。
A.微粒半径:③>①>② B. 电子排布属于基态原子 (或离子) 的是:①②
C. 电离一个电子所需最低能量:①>②>③ D.得电子能力:①>②
(3) 在BBr3 分子中,有 B 的sp2 杂化轨道与 Br 的 4p 轨道形成的_______________键(填“σ”或“π”) ,并且 还有 B_______(填“杂化”或“未杂化”)的 2p 空轨道与 Br 的 4p 轨道形成 4 中心 6 电子的大π键( π 4(6)) 。
(4)已知 NH3 分子中 H-N-H 的键角为 107.3°,则配合物[Cu(NH3)4]SO4 中 H-N-H 的键角_______ 107.3°(填“大 于”“小于”“等于”)。
(5)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。
已知 1 号 O 原子空间坐标为(0 ,0 , ) ,2 号 O 原子空间坐标为( , −m , −n) ,则 3 号 Fe 原子的空 间坐标为______________________ ,若晶胞参数分别为 apm 、bpm 和 cpm ,阿伏加德罗常数的值用 NA 表 示,则该晶体的密度为________________________________g ·cm−3(列出表达式)。
17. 五氧化二钒(V2 O5 )广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。 从废钒催化剂(含有K2 SO4 、V2 O5 、V2 O4 、SiO2 、Fe2O3 、NiO 等)中回收钒,既能避免对环境的污染,又
能节约宝贵的资源,回收工艺流程如下:
已知:①“酸浸”时V2 O5 和V2 O4 与稀硫酸反应分别生成VO和VO2+ 。 ②溶液中VO 与VO3(_) 可相互转化: VO + H2 O 一VO3(_) + 2H+ ,且NH4 VO3 为沉淀。 ( 1)“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是____________________________________ 。 (2)“还原转化”中加入FeSO4 的目的是将VO 转化为VO2+ ,写出反应的离子方程式:__________________。 (3)加入H2 O2 的目的是将过量的Fe2+ 转化为Fe3+ 。“氧化 1”后,溶液中含有的金属阳离子主要有Fe3+ 、Ni2+ 、 VO2+ ,调节pH 使离子沉淀,若溶液中c (Ni2+ ) = 0.2mol . L_ 1 ,则调节溶液的pH 最小值为___________可 使Fe3+ 沉淀完全(离子浓度≤1.0根10_5 mol . L_1 时沉淀完全) ,此时___________(填“有”或“无”) Ni (OH)2 沉淀 生成。{假设溶液体积不变, lg 6 ~ 0.8 , Ksp [Fe(OH)3 ]=2. 16 根10 -39 , Ksp [Ni(OH)2 ] = 2 根10 _ 15 } (4)“氧化 2”过程中发生反应的离子方程式为___________________________________________________ 。 (5)“沉钒”时,通入氨气的作用是_____________________________________________________________ 。 (6)若该废钒催化剂中V2 O5 的含量为 10%(原料中所有的钒已换算成V2 O5 ) 。取 100g 待处理样品,按照上 述流程进行实验。当加入150mL0. 1mol . L_1KClO3 溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒 的回收率是__________________________%(假设与KC1O3 反应后的操作步骤中钒元素无损失) 。 18. 碘酸钙是一种无机精细与专用化学品。一种制备并测定六水合碘酸钙含量的实验设计如下:
已知:碘酸钙为白色固体,微溶于水。
步骤 I :碘酸氢钾(KIO3 .HIO3 )的制备 在三颈烧瓶中加入 2.54g 碘、2.60g 氯酸钾和 50mL 水,滴加 6mol . L_ 1 的盐酸至 pH= 1 ,控制温度 85℃左
右,装置如图所示。
步骤 II:碘酸钙晶体Ca(IO3 )2 . 6H2 O (M = 498g . mol_ 1 ) 的制备将反应
后溶液转入烧杯中,加入 X 溶液,调节 pH= 10.滴加 11mL1mol . L_ 1CaCl2 溶
液,充分反应后用冰水冷却,抽滤、洗涤、晾干,得粗产品碘酸钙晶体 4.50g。
步骤 III:产品中碘酸钙晶体含量测定
①准确称取 1.2000g 粗产品,置于烧杯中,加入 20mL HClO4 溶解样品,
转移到 250mL 容量瓶定容。量取 25.00mL 溶液于碘量瓶中,加入稍过量的
KI ,然后用 0. 1000mol . L_ 1Na2 S2 O3 溶液滴定至浅黄色,加入 2 滴淀粉溶
液,继续滴定至终点,平行测定三次后取平均值,用去 25.24mL 标准溶液
( I2 + 2S2 O 2I_ + S4 O 6(2)_ )。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗 0.04mL Na2 S2 O3 标准溶液。
请回答下列问题:
(1)仪器c 的名称为_________________。干燥管d 中的试剂是_____________________________________。
(2) 步骤 I 中有黄绿色气体产生,制备KIO3 HIO3 反应的化学方程式为___________________________。
(3)步骤 I 中温度不宜过高的原因是__________________,判断反应结束的实验现象是_______________。
(4) 步骤 II 中 X 溶液是____________________________________________________。
(5) 碘酸钙晶体中Ca(IO3 )2 6H2 O 的纯度为______________________(保留两位小数)。
(6) 下列有关该实验的叙述正确的是________________________________。
A. 步骤 I 中球形冷凝管的冷水进口为b B. 步骤 II 中用冰水冷却有利于碘酸钙晶体析出
C. 步骤 III 中空白实验的主要目的是排除空气中CO2 的干扰
D. 本实验中制得的Ca(IO3 )2 6H2 O 产品的产率约为 78.8%
19. 以烃 A 为原料合成物质 J 的路线如下(部分反应条件或试剂省略) ,其中 1mol C 与足量钠反应生成标 准状况下22.4L H2 ,D 只有一种结构,G 为五元环状化合物。
②
已知:①
回答下列问题:
( 1)A 的名称为___________________________,D 的结构简式为____________________________________。
(2)步骤③的反应类型为______________________,F 中官能团的名称为_____________________________。
(3)步骤⑦反应的化学方程式为_______________________________________________________________。
(4)能发生银镜反应的 C 的链状同分异构体有_______种(不考虑立体异构) ,其中含手性碳的同分异构体的 结构简式为__________________________________________(写一种即可)。
(5)已知:( R 1 、R 2 、R3 均为烃基)。参照上述路线, 设计由制备的合成路线_______(其它试剂任选)。
20. “碳达峰 ·碳中和”是我国社会发展重大战略之一,CH4 还原 CO2 是实现“双碳”经济的有效途径之一, 相关的主要反应有:
I :CH4(g)+CO2(g) 2CO(g)+2H2(g) H1=+247 kJ ·mol- 1 ,K1
Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) H2=+41 kJ ·mol- 1 ,K2
请回答:(1) 有利于提高 CO2 平衡转化率的条件是 。
A .低温低压 B .低温高压 C .高温低压 D .高温高压
(2) 反应 CH4(g)+3CO2(g) 4CO(g)+2H2O(g) 的H= kJ ·mol- 1 ,K= (用 K1 ,K2 表示)。
(3) 恒压、750℃时,CH4 和 CO2 按物质的量之比 1 ︰ 3 投料,反应经如下流程 (主要产物已标出) 可实
现 CO2 高效转化。
①下列说法正确的是 。
A .Fe3O4 可循环利用,CaO 不可循环利用
B .过程ⅱ ,CaO 吸收 CO2 可促使 Fe3O4 氧化 CO 的平 衡正移
C .过程ⅱ产生的 H2O 最终未被 CaO 吸收,在过程ⅲ 被排出
D .相比于反应 I ,该流程的总反应还原 1mol CO2 需 吸收的能量更多
②过程ⅱ平衡后通入 He ,测得一段时间内CO 物质的量上升,根据过程ⅲ ,结合平衡移动原理,解释 CO 物质的量上升的原因 。
(4) CH4 还原能力 (R) 可衡量 CO2 转化效率,R=n(CO2)/ n(CH4) (同一时段内 CO2 与 CH4 的物质的
量变化量之比)。
①常压下 CH4 和 CO2 按物质的量之比 1 ︰ 3 投料,某一时段内 CH4 和 CO2 的转化率随温度变化如图 1, 请在图 2 中画出 400~ 1000℃之间 R 的变化趋势,并标明 1000℃时 R 值。
图 1 图 2
...
②催化剂 X 可提高 R 值,另一时段内 CH4 转化率、R 值随温度变化如下表:下列说法不正确的是 。
温度/℃
480
500
520
550
CH4 转化率/%
7.9
11.5
20.2
34.8
R
2.6
2.4
2.1
1.8
A .R 值提高是由于催化剂 X 选择性地提高反应Ⅱ的速率
B .温度越低,含氢产物中 H2O 占比越高
C .温度升高,CH4 转化率增加,CO2 转化率降低,R 值减小
D .改变催化剂提高 CH4 转化率,R 值不一定增大
山东省临沂市莒南县第二中学2022-2023学年高二上学期期末线上检测化学试题(Word版含答案) (1): 这是一份山东省临沂市莒南县第二中学2022-2023学年高二上学期期末线上检测化学试题(Word版含答案) (1),文件包含高二上学期期末考试化学试题原卷版定稿docx、高二期末答案docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
山东省临沂市莒南县第二中学2022-2023学年高一上学期期末线上检测化学试题(Word版含答案): 这是一份山东省临沂市莒南县第二中学2022-2023学年高一上学期期末线上检测化学试题(Word版含答案),文件包含高一化学期末测试题docx、高一化学期末测试题答案docx等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
山东省临沂市兰陵四高2022-2023学年高二上学期线上期末考试化学试题(Word版含答案): 这是一份山东省临沂市兰陵四高2022-2023学年高二上学期线上期末考试化学试题(Word版含答案),文件包含化学docx、参考答案docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。












