











所属成套资源:【新教材】人教版(2019)高中化学选择性必修一课件+练习【成套】
高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt,文件包含221化学平衡分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、221化学平衡分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、221化学平衡教学课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
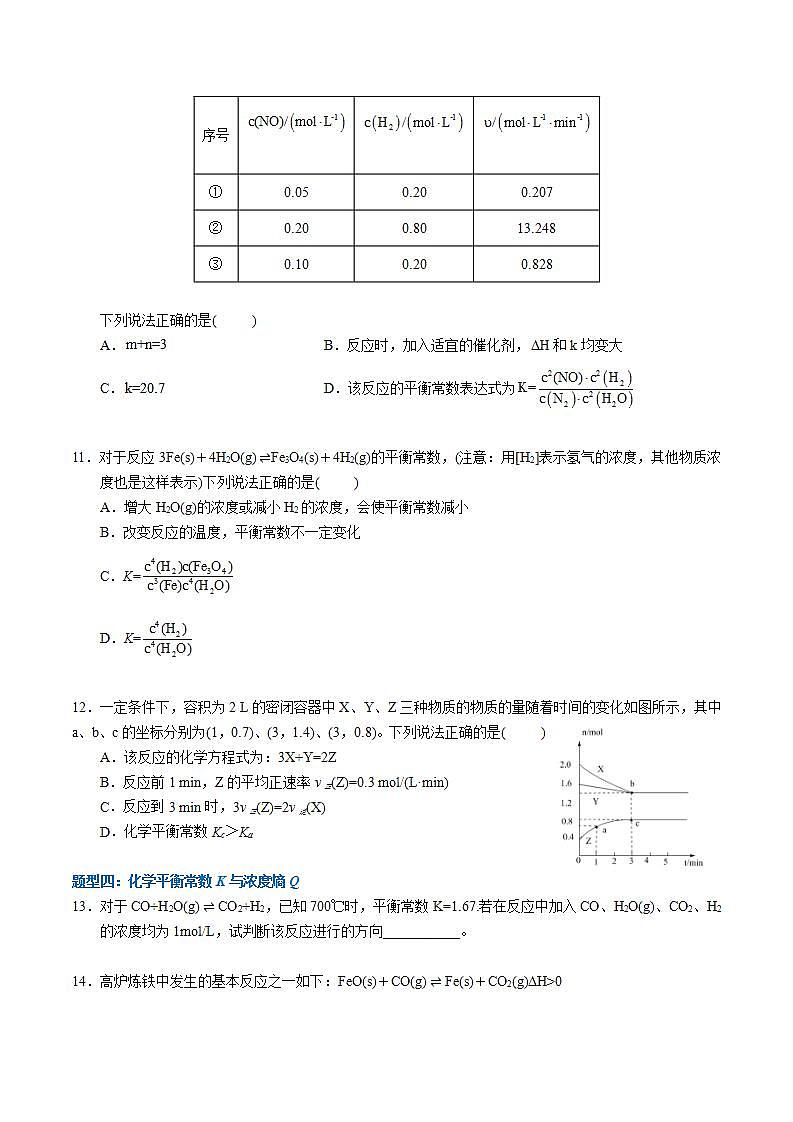
第五讲《化学平衡》题型一:化学平衡状态的判断 1.一定温度下,某密闭恒容的容器内可逆反应A(g) + B(g) 2C(g)达到平衡状态的标志 ( )A.A的消耗速率是C的分解速率倍 B.容器内混合气体的密度不随时间而变化C.单位时间内生成nmolA,同时生成3nmolB D.A、B、C的浓度之比为不再变化 2.下列说法正确的是( )A.H2(g) + I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变B.C(s) + H2O(g) H2(g) + CO(g),碳的质量不再改变说明反应已达平衡C.若压强不再随时间变化能说明反应2A (?) + B(g) 2C(?) 已达平衡,则A、C不能同时是气体D.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,则和充分反应,放热量为 3.在某绝热刚性容器中充入5molCO和10mol发生反应CO (s) + 2H2 (g) CH3OH(g) ,下列说法中能够判断该反应一定处于平衡状态的有 ( )①容器中CO、、共存 ②单位时间内生成1mol的同时消耗2mol③CO与体积之比恒定不变 ④容器中温度恒定不变⑤与速率之比恒定不变 ⑥反应容器中压强不随时间变化A.①④⑥ B.③④⑥ C.④⑤⑥ D.②③④ 题型二:化学平衡常数 4.对于可逆反应8NH3(g) +3Cl2(g) ⇌ 6NH4Cl(s) +N2(g),下列能正确表示该反应的平衡常数表达式的是( )A. B.C. D.5.书写下列反应的K的表达式:(1)3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)K=___________(2)NH4+(aq)+H2O(l) NH3·H2O(aq)+OH-(aq)K=___________(3)已知 N2(g)+3H2(g) 2NH3(g)的平衡常数为K1,N2(g)+H2(g) NH3(g)的平衡常数为K2,NH3(g) N2(g)+ H2(g)的平衡常数为K3,① 写出K1和K2的关系式___________。② 写出K2和K3的关系式___________。③ 写出K1和K3的关系式___________。 6.反应H2(g) + I2(g) ⇌ 2HI(g) 的平衡常数为,反应2HI(g) ⇌ H2(g) + I2(g) 的平衡常数为,则、 的关系为(平衡常数为同温度下的测定值) ( )A. B. C. D. 7.某温度下,反应2A (g) + B(g) 2C(g)的平衡常数,在同一温度下,反应2C(g) 2A (g) + B(g)的平衡常数为( )A. B. C. D. 题型三:化学平衡常数的影响因素8.反应CO (g) + H2O (g) CO2 (g) + H2 (g) 在800℃达到平衡时,分别改变下列条件,平衡常数K值会发生变化的是( )A.将体积减小至原来的一半 B.加催化剂C.将反应温度升高至1000℃ D.增大水蒸气的浓度 9.反应NO2(g) + SO2(g) SO3(g) + NO(g) 达到平衡后,保持温度不变,再通入,重新达到平衡,则新平衡与旧平衡相比的值( ) A.变小 B.变大 C.不变 D.无法确定 10.在恒容密闭容器中发生反应:,其反应速率与浓度关系式为(k为常数,只与温度有关,m、n为反应级数,均为正整数),在某温度下测得有关数据如表所示:序号①0.050.200.207②0.200.8013.248③0.100.200.828 下列说法正确的是( )A. B.反应时,加入适宜的催化剂,和k均变大C. D.该反应的平衡常数表达式为 11.对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)的平衡常数,(注意:用[H2]表示氢气的浓度,其他物质浓度也是这样表示)下列说法正确的是( )A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小B.改变反应的温度,平衡常数不一定变化C.K=D.K= 12.一定条件下,容积为2 L的密闭容器中X、Y、Z三种物质的物质的量随着时间的变化如图所示,其中a、b、c的坐标分别为(1,0.7)、(3,1.4)、(3,0.8)。下列说法正确的是( )A.该反应的化学方程式为:3X+Y=2ZB.反应前1 min,Z的平均正速率v正(Z)=0.3 mol/(L·min)C.反应到3 min时,3v正(Z)=2v逆(X)D.化学平衡常数Kc>Ka 题型四:化学平衡常数K与浓度熵Q13.对于CO+H2O(g) CO2+H2,已知700℃时,平衡常数K=1.67.若在反应中加入CO、H2O(g)、CO2、H2的浓度均为1mol/L,试判断该反应进行的方向___________。 14.高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH>0其平衡常数可表示为K=,已知1100℃时K=0.263.化学平衡常数只与温度有关,不随浓度和压强的变化而变化。(1) 温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比___________,平衡常数K___________。(以上均填“增大”“减小”或“不变”)(2) 1100℃时测得高炉中c(CO2)=0.025mol·L-1、c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态:___________(填“是”或“否”,若填“是”,则后面问题可不答),此时反应向___________(填“正反应”或“逆反应”)方向进行,其原因是___________。 题型五:图像题 & “三段式”计算15.I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。(1)从反应开始到10s时,用Z表示的反应速率为___________。(2)该反应的化学方程式为___________。II.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之比等于化学计量数之比。(3)一定能证明2SO2(g) + O2(g) 2SO3(g)达到平衡状态的是___________(填序号,下同)。(4)一定能证明H2(g) + I2(g) ⇌ 2HI(g) 达到平衡状态的是___________。 16.在容积为1L的密闭容器里,装有4molNO2,在一定温度时进行下面的反应:2NO2(g) N2O4(g),该温度下反应的平衡常数K=0.25,则平衡时该容器中NO2的物质的量为 ( )A.0mol B.1mol C.2mol D.3mol 17.在5 L的密闭容器内充入10 mol A气体和5 mol B气体发生如下反应:2A(g)+B(g)⇌2C(g),2s后达到平衡,此时测得平衡混合物中C的浓度为0.6 mol/L。则:(1)用A的浓度变化表示该反应的平均反应速率_______;(2)达到平衡后A的转化率为_______;(3)平衡混合物中B的浓度为_______;(4)平衡混合物中C气体的体积分数为_______。 18.将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g) + CO2(g)。下列各项:①; ②密闭容器中压强不变; ③密闭容器中混合气体的密度不变;④密闭容器中氨气的体积分数不变; ⑤密闭容器中不变。能判断该反应已经达到化学平衡状态的是 ( )A.②③⑤ B.②③④ C.①④ D.全部 19.已知下列反应:CH3OH(g)+ H2O (g) CO2 ((g)) + 3H2 (g) ;CO2 ((g)) + H2 (g) CO ((g)) + 2H2O (g) ;则反应CH3OH(g) CO ((g)) + 2H2 (g) 的平衡常数可以表示为( )A. B. C. D. 20.化学工作者对NO与H2的反应进行研究,提出下列3步机理(k为速率常数)第一步:2NO N2O2 快速平衡【其速率方程为v正=k正c2(NO);v逆=k逆c(N2O2)】第二步:N2O2+H2 N2O+H2O 慢反应第三步:N2O+H2=N2+H2O 快反应其中可看似认为第二步反应不能影响第一步平衡,下列说法错误的是( )A.总反应为2NO+2H2 N2+2H2O B.总反应快慢主要由第二步反应决定C.平衡时,2c(NO)=c(N2O2) D.第一步反应的平衡常数K= 21.在新型催化剂RuO2作用下,O2氧化HCl可获得Cl2,反应为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H<0。下列说法正确的是( )A.该反应中反应物键能总和大于生成物键能总和B.正反应的平衡常数为C.上述反应过程中有极性键和非极性键的断裂和形成D.RuO2的使用能降低该反应的焓变 22.(1) 高炉炼铁基本反应如下:FeO(s) + CO(g) Fe(s) + CO2(g) ①该反应的平衡常数表达式为___________。②若平衡后,保持温度不变,加入后,将___________(填“增大”、“减小”或“不变”)。1100℃时,测得高炉中,,此时,化学反应速率是___________(填“>”、“<”、“=”),其理由是___________。(2) 温度升高,化学平衡移动后达到新的平衡,___________。(填“增大”、“减小”或“不变")。指出两条提高的平衡转化率的措施___________。 23.将2molA和1molB混合置于一容积可变的密闭容器中,在温度T下发生如下反应:2A(g)+B(g) 2C(g)+Q,反应进行tmin后达到平衡,测得混合气体的总物质的量为2.1mol。试回答:(1)该反应的平衡常数表达式为___________;(2)下列有关化学平衡常数K的说法正确的是___________(填字母)A.在任何情况下,化学平衡常数K均为一个定值B.改变气体A或C的浓度,都会改变平衡常数KC.平衡常数K只与温度有关,与反应物的浓度无关D.从平衡常数K的大小可以推断一个反应进行的限度(3)若降低温度,则该反应的K值___________(填“增大”、“减小”或“不变”,下同),A的转化率___________,化学反应速率___________;(4)反应进行tmin后,C的体积分数为___________。
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课ppt课件,共23页。PPT课件主要包含了模块一速率图像,m+np+q,模块二平衡图像,正反应吸热,两个变量影响平衡等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt,共28页。PPT课件主要包含了V正≠V逆,V正V逆≠0,条件改变,建立新平衡,破坏旧平衡,一定时间,化学平衡移动,实验2-1,硫氰化铁,正反应等内容,欢迎下载使用。
这是一份高中人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡备课课件ppt,共36页。PPT课件主要包含了化学平衡常数,称为浓度商,c为平衡浓度,c为任一时刻浓度,一定温度下,某温度下,模块三速率常数,压强平衡常数,p分压,第三段等内容,欢迎下载使用。










