











所属成套资源:【新教材】人教版(2019)高中化学选择性必修一课件+练习【成套】
- 2.2.2影响化学平衡的因素(同步课件+同步练习)高二化学同步备课系列(人教版2019选择性必修1) 课件 1 次下载
- 2.2.3化学反应的方向(同步课件+同步练习)高二化学同步备课系列(人教版2019选择性必修1) 课件 0 次下载
- 2.2.5微专题1—化学反应速率&化学平衡的图像(教学课件)高二化学同步备课系列(人教版2019选择性必修1) 课件 1 次下载
- 3.1.1强电解质和弱电解质(同步课件+同步练习)高二化学同步备课系列(人教版2019选择性必修1) 课件 0 次下载
- 3.4.1 难溶电解质的沉淀溶解平衡(同步课件+同步练习)高二化学同步备课系列(人教版2019选择性必修1) 课件 0 次下载
人教版 (2019)选择性必修1第四节 化学反应的调控备课ppt课件
展开
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控备课ppt课件,文件包含224化学反应的调控分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、224化学反应的调控分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、224化学反应的条控教学课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
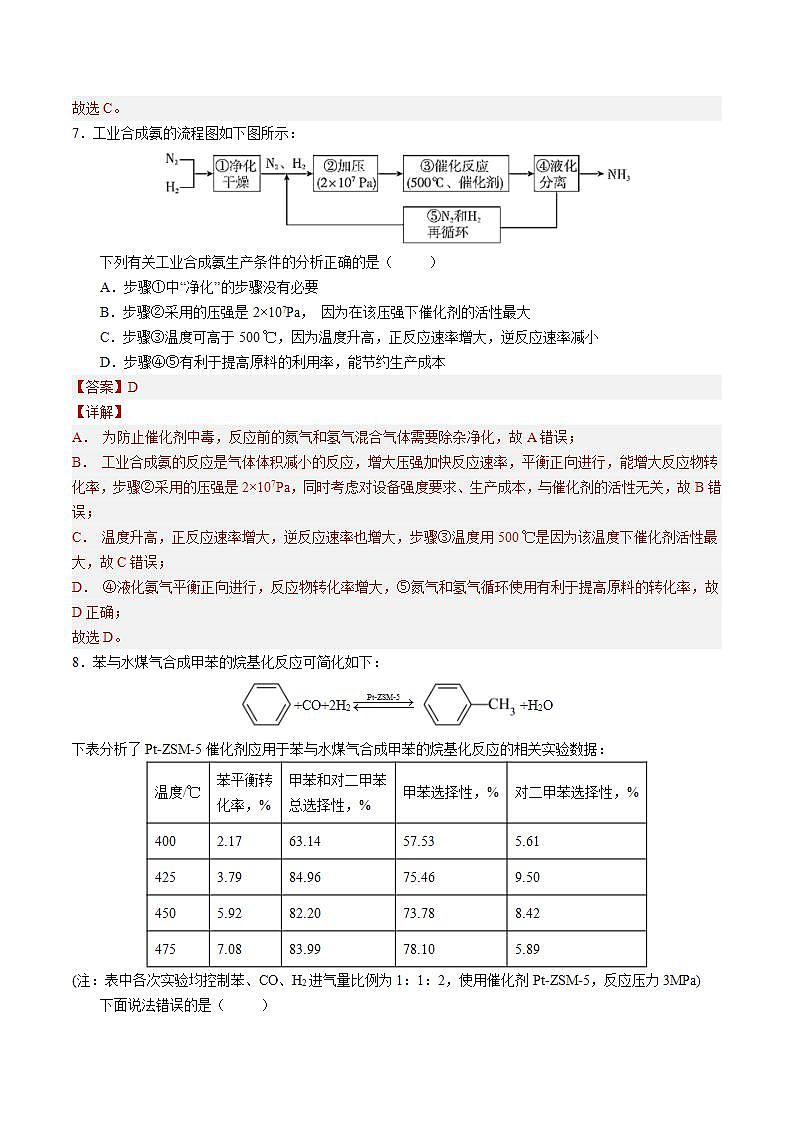
第八讲《化学反应的调控》题型一:工业合成氨的适宜条件1.下列有关合成氨工业的说法中正确的是( )A.铁触媒作催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动B.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动C.增大压强能缩短达到平衡状态所用的时间D.合成氨采用的压强是10~30MPa,因为该压强下铁触媒的活性最高 2.将和充入某密闭容器中,控制适当条件使其充分反应生成。下列关于合成氨反应的说法正确的是( )A.该反应是吸热反应 B.温度越高,压强越大,氨的平衡产率越高C.达到限度时正逆反应速率相等 D.该容器中最终得到 3.合成氨工业中采用循环操作,主要是为了( )A.增大化学反应速率 B.提高平衡混合物中氨的含量C.降低氨的沸点 D.提高氮气和氢气的利用率 4.下列关于工业生产过程的叙述正确的是( )A.联合制碱法中循环使用CO2和NH3,以提高原料利用率B.硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率C.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率D.SO2在接触室被氧化成SO3,SO3在吸收塔内被吸收制成浓硫酸 题型二:工业生产中反应条件的调控5.有平衡体系:CO(g)+2H2(g)CH3OH(g)(正反应为放热反应),为了增加甲醇的产量,提高生产效益,应采取的正确措施是( )A.高温、高压 B.适宜的温度、高压、催化剂C.低温、低压 D.高温、高压、催化剂 6.已知工业上常用石灰乳吸收尾气中的NO和NO2,涉及的反应为:NO+NO2+Ca(OH)2=Ca(NO2)2+H2O、4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O。下列措施一定能提高尾气中NO和NO2去除率的是( )A.加快通入尾气的速率 B.用石灰水替代石灰乳C.适当补充O2 D.升高温度 7.工业合成氨的流程图如下图所示:下列有关工业合成氨生产条件的分析正确的是( )A.步骤①中“净化”的步骤没有必要B.步骤②采用的压强是2×107Pa, 因为在该压强下催化剂的活性最大C.步骤③温度可高于500 ℃,因为温度升高,正反应速率增大,逆反应速率减小D.步骤④⑤有利于提高原料的利用率,能节约生产成本 8.苯与水煤气合成甲苯的烷基化反应可简化如下:+CO+2H2 +H2O下表分析了Pt-ZSM-5催化剂应用于苯与水煤气合成甲苯的烷基化反应的相关实验数据:温度/℃苯平衡转化率,%甲苯和对二甲苯总选择性,%甲苯选择性,%对二甲苯选择性,%4002.1763.1457.535.614253.7984.9675.469.504505.9282.2073.788.424757.0883.9978.105.89(注:表中各次实验均控制苯、CO、H2进气量比例为1:1:2,使用催化剂Pt-ZSM-5,反应压力3MPa)下面说法错误的是( )A.表中数据分析了反应温度对苯与水煤气烷基化反应的影响B.反应温度升高,催化剂对目标产物选择性增大,副产物选择性降低C.450℃下若苯与氢气投料比为1:4,则苯的平衡转化率大于5.92%D.获取上述实验数据需保证各次实验中Pt-ZSM-5催化剂的比表面积一致9.不同条件下,用氧化溶液过程中所测的实验数据如图所示。下列分析或推测合理的是。下列分析或推测不合理的是( )A.内,的氧化率随时间延长而逐渐增大B.由曲线②和③可知,越大,的氧化速率越快C.由曲线①和③可知,温度越高,的氧化速率越快D.时,内的平均消耗速率大于 10.将一定比例混合均匀的O2、NH3和NOx气体, 匀速通入装有催化剂M的反应器中反应,模拟NOx的去除。在不同温度下,相同时间内,测得NOx的去除率如图所示,下列说法不合理的是( )A.混合气体通过催化剂,所有气体与催化剂接触时间基本相同B.低于50 ℃时,NOx去除率较低可能是因为反应速率较慢C.50-100℃ 时,NOx去除率迅速上升,主要是温度升高导致反应速率加快引起的D.380℃ 以上, 可能发生副反应,导致NOx的去除率降低 11.以丙烯、氨气和空气(空气中O2体积分数约为20%)为原料,在催化剂条件下生产丙烯腈(CH2CHCN)的过程中会同时生成副产物丙烯醛,发生的主要反应如下:C3H6(g)+NH3(g)+3/2O2(g)=CH2CHCN(g)+3H2O(g)C3H6(g)+O2(g)=CH2CHCHO(g)+H2O(g)在恒压、460℃时,保持丙烯和氨气的总进料量和空气的进料量均不变,丙烯腈和丙烯醛的平衡产率随进料气中n(氨气)/n(丙烯)的比值变化的曲线如图所示。下列有关说法正确的是( )A.图中曲线a表示丙烯腈的平衡产率随n(氨气)/n(丙烯)比值的变化B.增大压强有利于提高反应速率和丙烯腈的平衡产率C.使用合适的催化剂可以使丙烯腈的平衡产率达到100%D.由图可知,原料氨气、丙烯和空气的理论最佳进料体积比为2∶2∶3 12.合成氨工艺是人工固氮最重要的途径,已知N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1,实际工业生产中,合成氨的原料气N2可通过分离空气得到,H2可通过天然气和水蒸气转化制得,原料气中N2和H2物质的量之比为1∶2.8,常用工艺条件:铁触媒作催化剂,控制温度773K、压强3.0×107Pa。假设起始反应物N2和H2物质的量之比为1∶3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中NH3的物质的量分数如下表所示 400℃450℃500℃600℃20MPa0.3870.2740.1890.08830MPa0.4780.3580.2600.129则下列说法正确的是( )A.上述任何条件下,反应达到平衡时N2和H2的转化率之比均为1B.体系中NH3的物质的量分数越小,反应一定越先达到平衡C.反应达到平衡时,放出的热量均为92.4kJD.600℃、30MPa条件下加入更高效的催化剂,平衡时NH3的物质的量分数大于0.129 13.在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是( )温度/℃平衡时SO2的转化率/%0.1MPa0.5MPa1MPa5MPa10MPa45097.598.999.299.699.750085.692.994.997.798.3A.从理论上分析,为了使二氧化硫尽可能多转化为三氧化硫,应选择的条件是450℃,10MPaB.在实际生产中,选定的温度为400~500℃原因是考虑催化剂的活性最佳C.在实际生产中,为了增大SO2的转化率可以无限量通入空气D.在实际生产中,采用的压强为常压原因是常压时转化率已经很高,增大压强对设备及成本要求太高 14.紫外光照射时,在不同催化剂作用下,可将和转化为和,产量随光照时间的变化如图1所示。以为催化剂,可以将和直接转化成乙酸,催化剂的催化效率、乙酸的生成速率与温度的关系如图2所示。下列有关说法正确的是( )A.由图1可知,0~15h内,的平均生成速率从大到小的顺序:Ⅲ>Ⅱ>ⅠB.由图1可知,25~35h内,的平均生成速率从大到小的顺序:Ⅱ>Ⅲ>ⅠC.由图2可知,250℃时催化剂的催化活性最高D.由图2可知,乙酸的生成速率主要取决于温度的影响范围是100~250℃ 15.(双选)工业上可通过甲醇羰基化法制取甲酸甲酯:CH3OH(g)+ CO(g)HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示。下列说法不正确的是( )A.增大压强甲醇转化率减小 B.b点反应速率υ正=υ逆C.平衡常数K(75℃)>K(85℃),反应速率υb<υd D.生产时反应温度控制在80~85℃为宜 16.丙烷氧化脱氢制备丙烯的主要反应为。在催化剂作用下,氧化脱氢除生成外,还生成CO、等物质。实验测得的转化率和的产率随温度变化关系如下图所示。 已知:。下列说法正确的是( )A.的转化率和的产率随温度变化曲线分别是b、aB.温度升高催化剂的活性增大,的转化率增大C.时的选择性为66%D.选择相对较低的温度能够提高的选择性 17.已知合成氨反应3H2(g)+N2(g)2NH3(g)ΔH<0.某科研小组研究:在其他条件不变的情况下,改变起始时氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)(1)图像中T2和T1的关系是:T2___________T1(填“>”“<”“=”或“无法确定”)。(2)在a、b、c三点所处的平衡状态中,反应物N2转化率最小的是___________(填字母)。(3)若容器容积为2L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为___________mol·L-1,此条件下(T2),反应的平衡常数K=___________。 18.汽车尾气是城市主要空气污染物,利用反应2NO(g)+2CO(g) N2+2CO2(g)可实现汽车尾气的无害化处理。向甲、乙两个体积都为2.0L的恒容密闭容器中分别充入2molCO和2molNO,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(CO2)随时间(t)变化情况见下表:时间/s0246810甲容器(T1)n(CO2)/mol00.721.201.601.601.60乙容器(T2)n(CO2)/mol00.601.001.401.701.70(1)T1___________T2(填“>”、“<”或“=”下同),该反应ΔH___________0.(2)甲容器中NO平衡转化率为___________,T1温度下该反应的平衡常数为___________。(3)该反应达到平衡后,为提高NO的转化率,可采取的措施有___________(填字母序号)。a、增大NO浓度b、压缩容器体积c、移去部分N2 d、改用高效催化剂 19.在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率温度\压强1×105Pa5×105Pa1×106Pa1×107Pa400℃99.2%99.6%99.7%99.9%500℃93.5%96.9%97.8%99.3%600℃73.7%85.8%89.5%96.4%(1)在生产中常用过量的空气是为了___________(2)在实际生产中,操作温度选定400—500℃,是因为___________(3)硫酸工业选定压强通常采用常压,做出这种选择的依据是___________ 20.(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM﹣5催化下合成ETBE,反应的化学方程式为:。回答下列问题:反应物被催化剂HZSM﹣5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=_____kJ•mol﹣1。反应历程的最优途径是______(填C1、C2或C3)。(2)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为。 图3①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:______。②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了n(CO):n(SO2)为1:1、3:1时SO2转化率的变化情况(图2)。则图2中表示n(CO):n(SO2)=3:1的变化曲线为______。(3)已知NO2存在如下平衡:,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:,,相应的速率与其分压关系如图3所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在图标出点中,指出能表示反应达到平衡状态的点是______,理由是_______。 21.汽车尾气是雾霾形成的原因之一、研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝: 4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0 根据下图判断提高脱硝效率的最佳条件是___________;氨氮比一定时,在400 ℃时,脱硝效率最大,其可能的原因是___________。 22.和氮氧化物都是空气污染物,科学处理及综合利用是环境科学研究的热点。(1)某科研小组研究不同条件下溶液常压下吸收烟气的吸收率。①溶液pH:随着含烟气的不断通入,和硫的吸收率如图1所示:i:当,硫的总吸收率不断减小,因为浓度较高与反应,生成S,同时产生大量的___________,导致硫的总吸收率减小。ii:当,硫的总吸收率增大,生成的主要产物为和。和一定条件下反应,生成硫磺和最终回收,反应的化学方程式为___________。iii:当时,___________导致和硫的总吸收率降低。②温度:如图2所示,该项目选择常温,一是为了节能,另一个原因是___________。③其他条件:___________。(任举一例)(2)联合脱硫脱硝技术,是一种工业工艺技术,采用“35%的氯酸同时脱硫脱氮技术”,处理烟气(含、NO)可获得、HCl、副产品,通过实验发现,当氯酸的浓度小于35%时,和NO的脱除率几乎不变,但生成的量远小于理论值,可能的原因是___________。 23.(1)用O2将HCl转化为Cl2,可提高效益、减少污染。新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图,则总反应的ΔH__0(填“>”、“=”或“<”);A、B两点的反应速率中较大的是__。②下列措施有利于提高αHCl的有____(填字母)。A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O(2)乙苯催化脱氢制苯乙烯反应:+H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。 ①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:_________。②控制反应温度为600 ℃的理由是_______。
相关课件
这是一份高中化学第二节 化学反应的速率与限度备课ppt课件,共36页。PPT课件主要包含了化学反应速率,反应物浓度的减少量,生成物浓度的增加量,均取正值,模块三活化能,HI→H2+2I·,I·→I2,自由基,基元反应,又称反应机理等内容,欢迎下载使用。
这是一份化学第三节 化学反应的方向备课课件ppt,共20页。PPT课件主要包含了气体的自发扩散过程,△S0熵增反应,△S0熵减反应,△S0,焓判据,熵判据,复合判据,ΔS0等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课ppt课件,共23页。PPT课件主要包含了模块一速率图像,m+np+q,模块二平衡图像,正反应吸热,两个变量影响平衡等内容,欢迎下载使用。









