

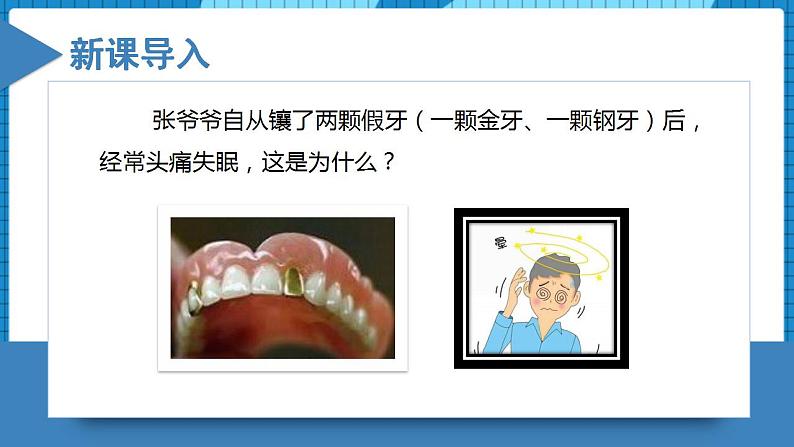






所属成套资源:【新教材】人教版(2019)高中化学选择性必修一课件+练习【成套】
高中化学人教版 (2019)选择性必修1第一节 原电池备课ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池备课ppt课件,文件包含411原电池分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、411原电池分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、411原电池的工作原理教学课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
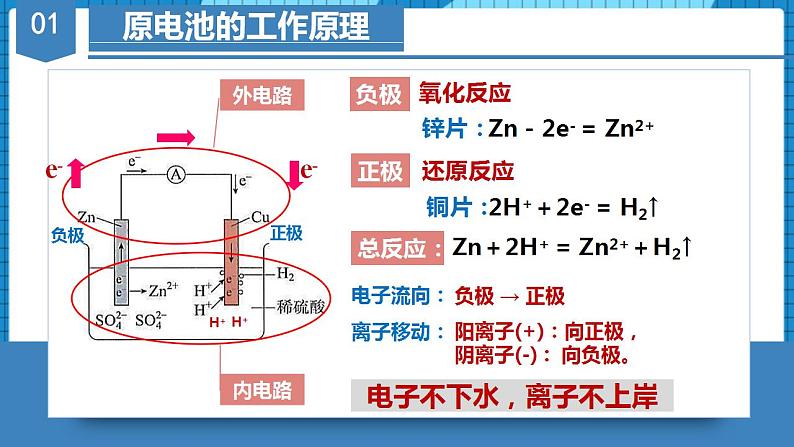
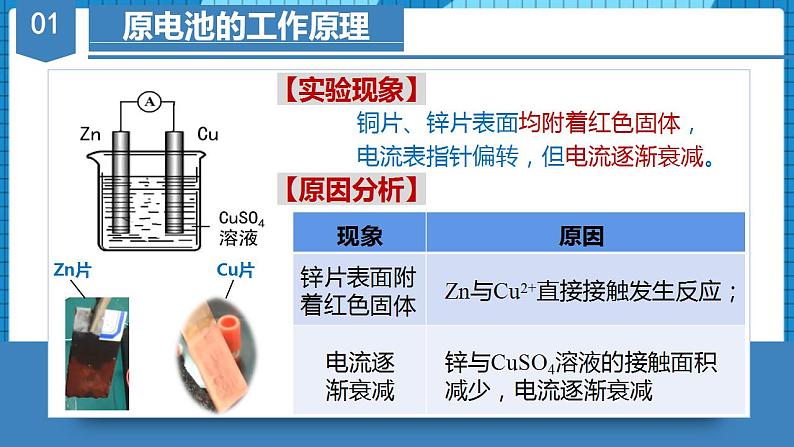
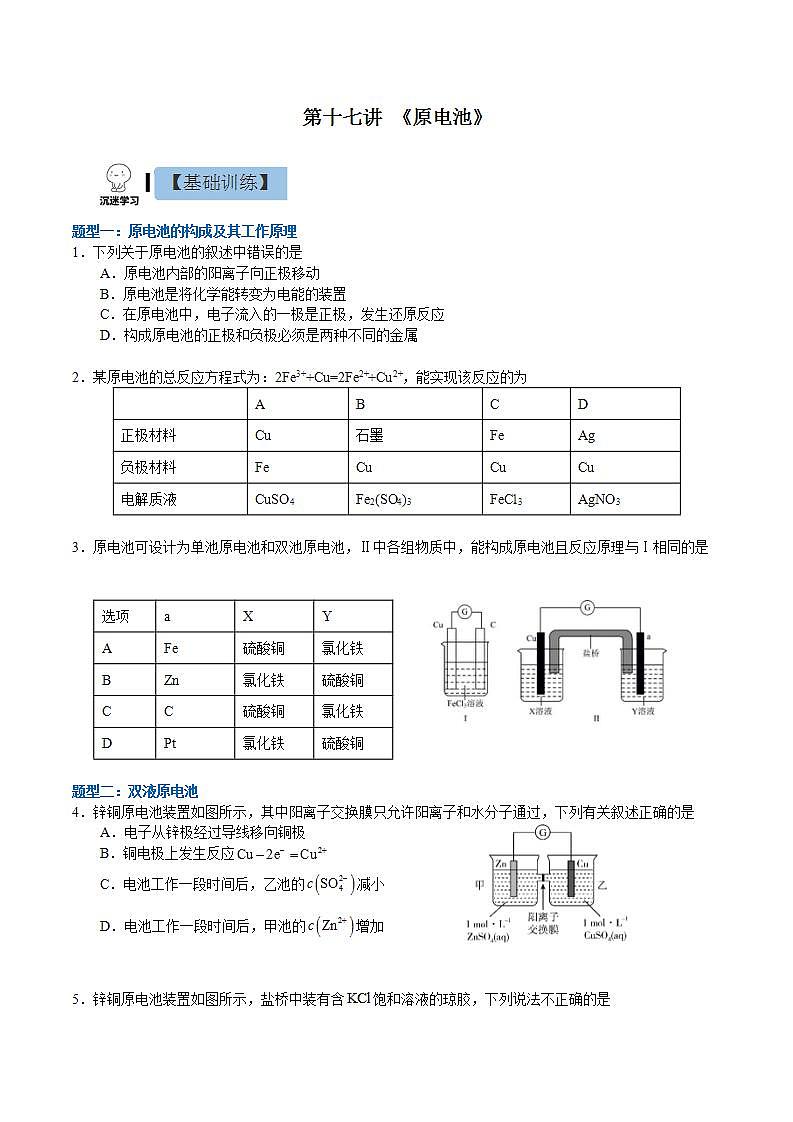
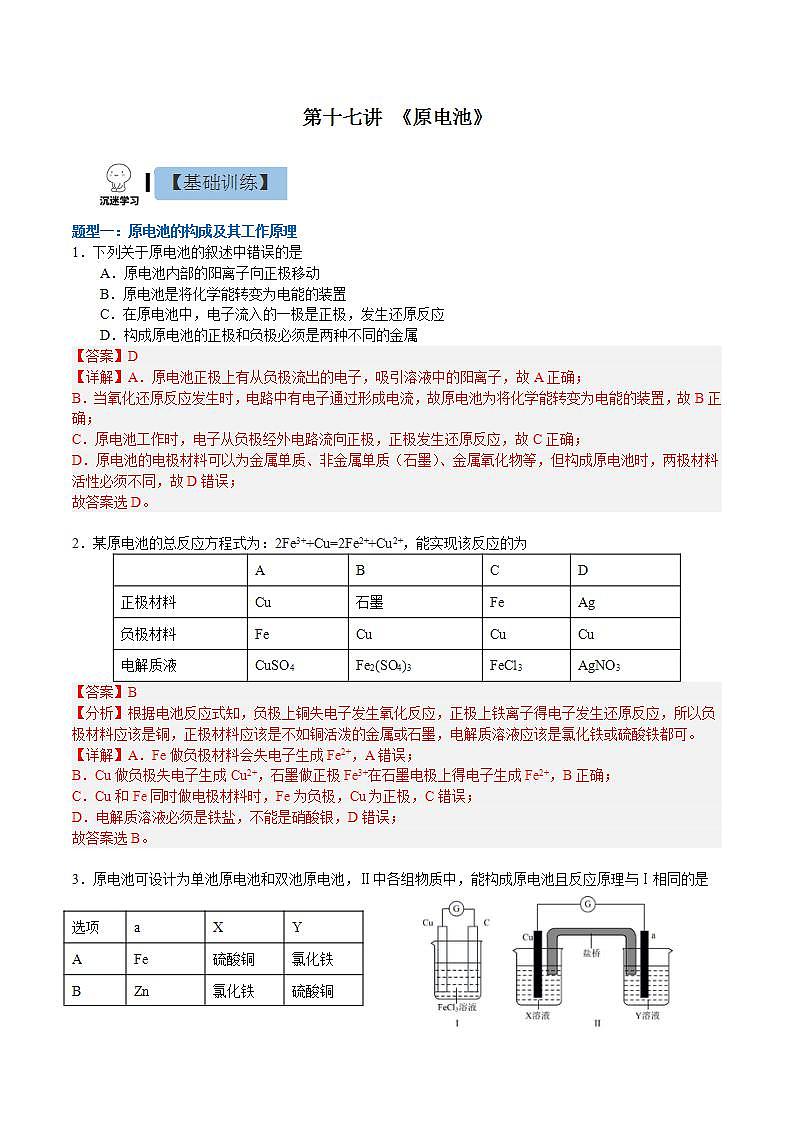
第十七讲 《原电池》题型一:原电池的构成及其工作原理1.下列关于原电池的叙述中错误的是A.原电池内部的阳离子向正极移动B.原电池是将化学能转变为电能的装置C.在原电池中,电子流入的一极是正极,发生还原反应D.构成原电池的正极和负极必须是两种不同的金属【答案】D【详解】A.原电池正极上有从负极流出的电子,吸引溶液中的阳离子,故A正确;B.当氧化还原反应发生时,电路中有电子通过形成电流,故原电池为将化学能转变为电能的装置,故B正确;C.原电池工作时,电子从负极经外电路流向正极,正极发生还原反应,故C正确;D.原电池的电极材料可以为金属单质、非金属单质(石墨)、金属氧化物等,但构成原电池时,两极材料活性必须不同,故D错误;故答案选D。 2.某原电池的总反应方程式为:2Fe3++Cu=2Fe2++Cu2+,能实现该反应的为 ABCD正极材料Cu石墨FeAg负极材料FeCuCuCu电解质液CuSO4Fe2(SO4)3FeCl3AgNO3【答案】B【分析】根据电池反应式知,负极上铜失电子发生氧化反应,正极上铁离子得电子发生还原反应,所以负极材料应该是铜,正极材料应该是不如铜活泼的金属或石墨,电解质溶液应该是氯化铁或硫酸铁都可。【详解】A.Fe做负极材料会失电子生成Fe2+,A错误;B.Cu做负极失电子生成Cu2+,石墨做正极Fe3+在石墨电极上得电子生成Fe2+,B正确;C.Cu和Fe同时做电极材料时,Fe为负极,Cu为正极,C错误;D.电解质溶液必须是铁盐,不能是硝酸银,D错误;故答案选B。 3.原电池可设计为单池原电池和双池原电池,Ⅱ中各组物质中,能构成原电池且反应原理与Ⅰ相同的是选项aXYAFe硫酸铜氯化铁BZn氯化铁硫酸铜CC硫酸铜氯化铁DPt氯化铁硫酸铜【答案】C【分析】对于单池原电池(Ⅰ),负极(Cu)反应式为,正极(C)反应式为,总反应式为;对于双液原电池(Ⅱ),负极(Cu)对应电解质溶液为负极金属对应阳离子的盐溶液;正极可选用比负极活泼性弱的金属(Pt)或导电非金属(C),正极对应的电解质溶液为与负极发生氧化还原反应的电解质溶液。据此解答。【详解】A.根据分析,a极选用Fe,其活泼性强于Cu,不符合题意,故A项错误;B.根据分析,a极选用Zn,其活泼性强于Cu,且X溶液应为含Cu2+的盐溶液,故B项错误;C.根据分析,a极选用碳棒,其活泼性弱于Cu,且电解质溶液均符合要求,故C项正确;D.a极选用碳棒符合题意,X、Y电解质溶液应分别为CuSO4、FeCl3溶液,故D项错误。故答案选:C。 题型二:双液原电池4.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是A.电子从锌极经过导线移向铜极 B.铜电极上发生反应C.电池工作一段时间后,乙池的减小 D.电池工作一段时间后,甲池的增加【答案】A【分析】由图可知,该装置为原电池,Zn比Cu活泼,Zn作负极失电子发生氧化反应,Cu作正极,铜离子在Cu表面得电子发生还原反应,据此作答。【详解】A. Zn作负极失电子发生氧化反应,电子从锌极经过导线移向铜极,故A正确;B.铜离子在Cu表面得电子发生还原反应,电极上发生反应,故B错误;C.阳离子交换膜只允许阳离子和水分子通过,乙池的不变,故C错误;D.阳离子交换膜只允许阳离子和水分子通过,甲池电极反应为,甲中锌离子通过阳离子交换膜移向乙池,结合电荷守恒,不变,故D错误;故选:A。5.锌铜原电池装置如图所示,盐桥中装有含饱和溶液的琼胶,下列说法不正确的是A.Ⅱ中盐桥的作用是形成闭合回路,平衡溶液电荷B.电池工作时,Ⅱ中盐桥内向右侧烧杯移动C.Ⅰ和Ⅱ的反应原理均为:D.Ⅱ中盐桥可用吸有饱和溶液的滤纸条代替【答案】B【详解】A.由原电池的工作原理可知,Ⅱ中盐桥的作用是通过阴阳离子的定向移动形成闭合回路,维持平衡溶液中的电荷守恒,故A正确;B.由图可知,Ⅱ中锌为原电池的负极,铜为正极,则电池工作时,Ⅱ中盐桥内氯离子向左侧烧杯移动,故B错误;C.由原电池的工作原理可知,Ⅰ和Ⅱ的反应原理均为,故C正确;D.若用吸有氯化钾饱和溶液的滤纸条代替盐桥,也能起到通过阴阳离子的定向移动形成闭合回路,维持平衡溶液中的电荷守恒的作用,所以Ⅱ中盐桥可用吸有氯化钾饱和溶液的滤纸条代替,故D正确;故选B。6.如图所示的电池,盐桥由琼脂和饱和KCl溶液构成。下列有关说法正确的是A.电池负极反应:Fe2+-e-=Fe3+B.盐桥中K+移向FeCl3溶液C.当有6.02×1023个电子转移时,Fe电极减少56gD.电池总反应:Fe+Fe3+=2Fe2+【答案】B【详解】A.Fe为负极,石墨为正极,电池负极反应:Fe-2e-=Fe2+,故A错误;B.原电池中阳离子移向正极,石墨电极为正极,故盐桥中K+移向FeCl3溶液,故B正确;C.当有6.02×1023个电子转移时,根据电池负极反应:Fe-2e-=Fe2+,Fe电极减少28g,故C错误;D.电荷不守恒,电池总反应:Fe+2Fe3+=3Fe2+,故D错误;故答案为B7.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++e-=Ag③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同⑤盐桥中的K+移向Cu(NO3)2溶液⑥电子的移动方向:Cu极-导线-Ag电极-AgNO3溶液-盐桥-Cu(NO3)2溶液上述①~⑥中正确的有A.4个 B.3个 C.2个 D.1个【答案】C【分析】在原电池中,较活泼的金属作负极,负极上金属失去电子发生氧化反应;较不活泼的金属作正极,正极上得电子发生还原反应。在外电路上,电子从负极沿导线流向正极,以此解答该题。【详解】由于金属活动性Cu>Ag,所以Cu为原电池的负极,Ag为原电池的正极,Cu失去电子发生氧化反应产生Cu2+进入溶液,在正极上Ag+得到电子变为Ag单质。①在外电路中,电流由正极银电极流向负极铜电极,①错误;②正极上得电子发生还原反应,所以正极的电极反应式为:Ag++e-=Ag,②正确;③实验过程中取出盐桥,由于不能形成闭合回路,所以原电池不能继续工作,③错误;④该原电池的电极反应式为:负极:Cu-2e-=Cu2+;正极:Ag++e-=Ag,故总反应为Cu+2Ag+=Cu2++2Ag,铜片与硝酸银反应的离子方程式为:Cu+2Ag+=Cu2+ +2Ag,与原电池的总反应相同,④正确;⑤盐桥中的K+移向负电荷较多的正极,即K+移向AgNO3溶液,⑤错误;⑥电子只能在外电路中移动,而不能进入电解质溶液,⑥错误;综上所述可知:说法正确的有②④,故合理选项是C。8.某课外小组用下图装置进行实验,当两侧通入气体、时,电流表的指针发生偏转。下列说法正确的是A.Fe为负极B.烧杯Ⅰ中的溶液pH升高C.烧杯Ⅰ中的阴离子通过盐桥移向烧杯Ⅱ中D.当消耗1mol 时,外电路中有2mol电子通过【答案】B【详解】A.锌比铁活泼,锌为负极、 Fe为正极,A错误;B.Fe为正极,烧杯Ⅰ中得电子,电极反应为,则烧杯Ⅰ中c()增大,溶液pH升高,B正确;C.电池工作时,盐桥中阳离子向正极移动、阴离子向负极移动,C错误;D. 结合选项B可知:当消耗1mol 时,外电路中有4mol电子通过,D错误;答案选B。 题型三:原电池综合9.电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是A.电流由a极流向b极B.溶液中的OH-向b极移动C.a极的电极反应式为:4NH3-12e-=2N2+12H+D.b极的电极反应式为:3O2+12e-+6H2O=12OH-【答案】D【分析】左侧通入氨气,氨气失去电子,发生氧化反应,故电极a作负极,则电极b为正极,以此解题。【详解】A.b电极为正极、a电极为负极,电流由b极经过电压表流向a极,故A错误;B.b电极为正极、a电极为负极,内电路中:阳离子移向正极、阴离子移向负极,所以溶液中的OH-向a极移动,故B错误;C.a极上NH3被氧化生成氮气,发生失去电子的氧化反应,结合碱性条件有2NH3-6e-+6OH-=N2+6H2O,故C错误;D.b极上氧气得电子被还原,电极反应式为O2+4e-+2H2O═4OH-或3O2+12e-+6H2O═12OH-,故D正确;故选D。10.利用原电池原理,我国科学家设计了一种SO2 + H2O2协同转化装置,实现对燃煤发电厂烟气中SO2的高效去除,协同转化装置如图所示,电极为惰性电极。放电时,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。该装置工作时,下列叙述错误的是A.左侧电极区的总反应式为SO2+4OH-_2e-=SO +2H2OB.协同转化的总反应为SO2+O2+2NaOH=H2O2+Na2SO4C.反应过程中不需补加稀硫酸D.左侧电极上的电势比右侧电极上的高【答案】D【分析】该装置为原电池,根据电子转移,推出左侧电极为负极 ,右侧电极为正极,然后根据原电池工作原理进行分析解答;【详解】A.根据上述分析,左侧电极为负极,根据装置图可知,该电极反应式为SO2+4OH-_2e-=SO +2H2O,故A说法正确;B.右侧电极的电极反应为O2+2e-+2H+=H2O2,根据得失电子数目守恒,协同转化的总反应为SO2+O2+2NaOH=H2O2+Na2SO4,故B说法正确;C.根据B选项分析,右侧消耗H+,根据原电池工作原理,双极膜中H+向右侧电极移动,根据得失电子数目守恒,右侧消耗H+的量等于从双极膜迁移过来的H+的量,硫酸的总量不变,因此反应过程中不需补加稀硫酸,故C说法正确;D.原电池中,负极的电势低,正极的电势高,即左侧电极上的电势比右侧电极上低,故D说法错误;答案为D。11.十九大报告提出要“打赢蓝天保卫战”,意味着对污染防治提出更高要求。实验室中尝试对垃圾渗透液再利用,实现发电、环保二位一体,当该装置工作时,下列说法错误的是A.微生物细菌在氮的硝化中起氧化作用B.X电极的电势低于Y电极的电势C.工作时,Y极区溶液pH减小D.电路中流过10 mol电子时,Y极产生标况下22.4 L N2【答案】C【分析】根据装置图可知,该装置为化学电源,X电极上NH3→N2,N的化合价升高,根据原电池工作原理,X电极为负极,则Y电极为正极,据此分析;【详解】A.根据装置图,垃圾渗透中NH→NO,N元素化合价由-3价转化成+5价,化合价升高,因此微生物细菌在氮的硝化中起氧化作用,故A说法正确;B.根据上述分析,X电极为负极,Y电极为正极,则X电极的电势低于Y电极的电势,故B说法正确;C.Y电极为正极,电极反应式为2NO+6H2O+10e-=N2↑+12OH-,溶液的pH增大,故C说法错误;D.Y电极为正极,电极反应式为2NO+6H2O+10e-=N2↑+12OH-,转移10mol电子,产生标准状况下氮气的体积为22.4L,故D说法正确;答案为C。12.锂/亚硫酰氯电池是目前世界上实际应用的电池系列中比能量最高的一种电池,也是无机电解质锂电池中研制最为成熟的一种电池,该电池的工作原理如图所示。下列说法错误的是A.X为电极,发生还原反应B.电池工作时,通过交换膜C.四氯铝酸锂的溶液不含水D.正极的电极反应式为【答案】A【分析】电子从X极流出,说明X极是失去电子一极,做负极,发生氧化反应,电极反应方程式为Li-e-=Li+。电子从Y极流入,说明Y极是得到电子一极,做正极,发生还原反应,电极反应方程式为。外电路中电子移动形成电流,内电路中离子移动形成电流。阳离子交换膜只允许阳离子通过。原电池中,阳离子向正极移动,阴离子向负极移动。Li+透过阳离子交换膜向Y极移动。【详解】A.根据电子流向可知,X为负极,Y为正极,故X上发生氧化反应,为Li电极,A错误。B.Li+为阳离子,应透过阳离子交换膜向正极移动,B正确;C.Li的性质较活泼,易与水反应,所以四氯铝酸锂的溶液不能含水,C正确;D.由装置图可知,正极有生成,故电极反应式为,D正确;故选A。 题型四:原电池的应用13.10mL浓度为的溶液与过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是A.加入适量的的溶液 B.加入适量的蒸馏水C.加入数滴硫酸铜溶液 D.加入适量的硫酸钠溶液【答案】C【详解】A.加入适量的的溶液,增大了氢离子的浓度,也增大了氢离子的物质的量,生成的总量会增多,A错误;B.加入适量蒸馏水,氢离子的浓度减小,化学反应速率减小,B错误;C.加入数滴硫酸铜溶液,Zn足量,构成锌铜原电池,加快反应速率,且没有改变氢离子的物质的量,不影响生成氢气的总量,C正确;D.加入适量的硫酸钠溶液,氢离子的浓度减小,化学反应速率减小,D错误;故选C。 14.某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:(1)锌电极为电池的_______极,电极上发生的是_______反应(“氧化”或“还原”),电极反应式为_______。(2)导线中电子流向为_______(用a、b表示)。(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为_______;(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是_______。A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动C.盐桥中的K+、Cl-都向右侧烧杯移动D.盐桥中的K+、Cl-几乎都不移动(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的_______(填代号)。A.NaOH B.Zn C.Fe D.H2SO4(6)反应一段时间后右侧烧杯中Cu2+浓度是_______(填增大,减小或不变)【答案】(1) 负 氧化 Zn-2e-=Zn2+(2)a到b(3)1.204×1022或0.02NA(4)B(5)B(6)减小 【分析】图为原电池装置,锌较为活泼Zn为负极,Cu为正极;(1)锌为电池的负极,锌失去电子发生氧化反应生成锌离子,Zn-2e-=Zn2+;(2)子由负极流向正极,则电子流向为由a到b(或a→b);(3)铜电极发生Cu2++2e-=Cu,增加0.64g,n(Cu)==0.01mol,转移0.02mol电子,转移电子数目为0.02mol×NA=1.204×1022;(4)原电池中阳离子向正极移动,阴离子向负极移动;右侧为正极,左侧为负极,盐桥中的K+、Cl-的移动方向为阳离子向正极移动,阴离子向负极移动,只有B正确,故答案为B;(5)A.氢氧化钠会和锌离子、铜离子均反应,A错误;B.锌可以和铜离子生成铜单质除去铜,生成锌离子,不引入新杂质,B正确;C.铁和铜离子生成铜和亚铁离子,引入新杂质,C错误;D.稀硫酸和铜离子不反应,D错误;故选B。(6)反应一段时间后因Cu2+被还原生成铜,故右侧烧杯中Cu2+浓度减小。 15.有如图所示的两个原电池装置,下列说法不正确的是A.A池中负极的电极反应为Mg-2e-=Mg2+B.Mg在A池中为负极,在B池中为正极C.B池中电子的流向:Mg→AlD.原电池工作一段时间后,A池溶液的pH会增大【答案】C【详解】A. 镁比铝活泼,A池中电解质是稀硫酸,负极为镁,电极反应为Mg-2e-=Mg2+,A正确;B. Mg在A池中为负极,在B池中发生的氧化还原反应为铝与氢氧化钠溶液的反应,铝为负极,则镁为正极,B正确;C. B池中铝为负极,原电池中电子的流向:Al→导线→Mg,C错误;D. 原电池工作一段时间后,A池溶液中的氢离子浓度减小,pH增大,D正确;答案选C。16.某实验小组用铜和溶液来制备溶液,同时获得电能,装置如图所示,其中M、N为电解质,下列说法正确的是A.电极A为铜B.a为阴离子交换膜,电解质N为C.理论上每生成1molN时会消耗1molMD.当B电极质量减少6.4克,则N溶液质量增加6.4克【答案】B【分析】用铜和溶液来制备溶液,同时获得电能,该装置为原电池装置,铜为负极,即B电极为Cu,电解质溶液N为CuCl2溶液,氯化铁溶液在正极得电子,M溶液为氯化铁溶液。【详解】A.根据分析,B电极为铜,A错误;B.负极铜失去电子生成铜离子,氯离子通过a膜迁移至负极区,a为阴离子交换膜,B正确;C.理论生成1molCuCl2时,铜失去2mol电子,则Fe3+得2mol电子,消耗2molFeCl3,C错误;D.当B电极质量减少6.4克,转移电子的物质的量为,正极Fe3+得0.2mol电子生成0.2mol Fe2+,同时0.2molCl-迁移至负极区,溶液质量减少,D错误;故选B。17.已知的氧化性大于。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和溶液),下列叙述错误的是A.a为原电池的负极,b为原电池的正极B.电池工作时,盐桥中的移向甲烧杯C.a极的电极反应式为D.工作一段时间后,乙烧杯中溶液的减小(忽略溶液体积变化)【答案】D【详解】A.已知的氧化性大于,故应该是Fe2+失电子,作为负极反应,所以a为负极,B为正极,故A正确;B.原电池中阴离子移向负极,电池工作时,盐桥中的移向甲烧杯,故B正确;C.a为负极,电极反应为,故C正确;D.b为正极,电极反应为,工作一段时间后c()下降,乙烧杯中溶液的增大,故D错误; 故答案为D。18.如图所示的电化学装置中,电极I为Al,其他电极均为Cu,则下列说法正确的是A.盐桥中电子从右侧流向左侧B.三个烧杯中的浓度都始终保持不变C.电极Ⅱ的质量减少,电极Ⅲ的质量增加D.电极Ⅲ的电极反应:【答案】B【分析】电极Ⅰ为Al,其它均为Cu ,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,以此解答该题。【详解】A.电子只能在外电路移动,不能在盐桥中移动,故A错误;B.硫酸根离子不参加反应,且溶液体积不变,浓度不变,故B正确;C.电极Ⅱ是正极,正极上发生反应为Cu 2++2e-=Cu,所以电极Ⅱ质量逐渐增大,电极Ⅲ为阳极,铜失去电子变为铜离子,质量应减小,故C错误;D .电极Ⅱ是正极,正极上发生反应为Cu 2++2e-=Cu,故D错误;故选:B。 19.某同学组装了如图所示的电化学装置,则下列说法正确的是A.图中甲池为原电池装置,Cu电极发生还原反应B.实验过程中,甲池左侧烧杯中的浓度不变C.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变D.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是足量溶液【答案】C【分析】甲池为原电池装置,活泼的铜失电子作负极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,铜放电生成铜离子,盐桥中的硝酸根离子向左边移动,如果用铜制U形物代替“盐桥”,甲池中的右边一个池为原电池装置,以此解答该题。【详解】A.图中甲池为原电池装置,Cu电极为负极发生氧化反应,故A错误;B.实验过程中,铜放电生成铜离子,盐桥中的硝酸根离子向左边移动,所以左侧烧杯中硝酸根离子的浓度变大,故B错误;C.用铜制U形物代替“盐桥”,右边铜的质量减少,而左边铜的质量增加,而整个电路转移电子数相等,所以减少的质量与增加的质量相等,U型管的质量不变,故C正确;D.若甲池中Ag电极质量增加5.4g时,即生成银5.4g,物质的量为mol=0.05mol,所以整个电路转移0.05mol的电子,如果硝酸银足量应生成5.4g的银,说明硝酸银不足,故D错误;故选:C。 20.Ⅰ.回答下列问题(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计成如图所示的原电池,回答下列问题:①写出电极反应式。正极:_______;负极:_______。②图中X溶液的溶质是_______(填化学式,下同),Y溶液的溶质是_______。③原电池工作时,盐桥中的_______(填“阳”或“阴”)离子向X溶液方向移动。(2)控制合适的条件将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。请回答下列问题:①反应开始时,乙中石墨电极上发生_______(填“氧化”或“还原”,下同)反应,电极反应式为_______。甲中石墨电极上发生_______反应,电极反应式为_______。②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_______。(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_______。Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·L-1 FeCl3溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;②当离子浓度相同时,氧化性:Ag+>Fe3+;③ 若浓度减小时,离子的氧化性也会随之减弱。(4)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(加入几滴淀粉溶液)加入0.1mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式_______。实验结果未见到蓝色。(5)乙同学认为甲同学的实验方案有问题,理由是_______。请设计原电池证明Ag+也能氧化 Iˉ,画出装置图,并标明电极材料及电解质溶液。______【答案】(1) 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2 阳(2) 氧化 2I--2e-=I2 还原 2Fe3++2e-=2Fe2+ 正 I2+2e-=2I-(3)O2+4e-+4H+=2H2O(4)2Ag++2Iˉ=2Ag+I2(5) Ag+会与Iˉ发生反应生成AgI沉淀,使Ag+的浓度下降,从而减弱Ag+的氧化性,使上述反应很难发生 【解析】(1)从反应Cu+2FeCl3=CuCl2+2FeCl2可得出,负极材料为Cu,电解质为FeCl3,且正极材料的活动性比Cu弱;①正极:电解质溶液中的Fe3+得电子生成Fe2+,电极反应式为2Fe3++2e-=2Fe2+;负极:Cu失电子生成Cu2+,电极反应式为Cu-2e-=Cu2+;②由分析知,X溶液的溶质是FeCl3,从总反应式看,Y溶液应为CuCl2;③原电池工作时,盐桥中的阳离子向正极的溶液方向移动,即向X溶液方向移动。答案为:2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;FeCl3;CuCl2;阳;(2)从反应2Fe3++2I-2Fe2++I2看,甲池中Fe3+得电子生成Fe2+,甲池内石墨电极为正极;乙池中I-失电子生成I2,乙池中石墨电极为负极:①由分析可知,反应开始时,乙中石墨电极为负极,I-失电子发生氧化反应,电极反应式为2I--2e-=I2。甲中石墨电极为正极,Fe3+得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+;②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,增大溶液中FeCl2浓度,促使平衡逆向移动,即FeCl2向生成FeCl3的方向转化,甲池石墨为负极,则乙中的石墨作正极,该电极I2得电子生成I-,电极反应式为I2+2e-=2I-。答案为:氧化;2I--2e-=I2;还原;2Fe3++2e-=2Fe2+;正;I2+2e-=2I-;(3)若将反应2Cu+O2+2H2SO4=2CuSO4+2H2O设计为原电池,其正极O2得电子产物与电解质反应生成H2O等,电极反应式为O2+4e-+4H+=2H2O。答案为:O2+4e-+4H+=2H2O;(4)由已知信息可知,氧化性:Ag+>Fe3+>I-,则0.1 mol·Lˉ1 KI 溶液(加入几滴淀粉溶液)加入0.1mol·Lˉ1AgNO3 溶液中,I-应被Ag+氧化生成I2和Ag,I2使淀粉溶液变蓝色。此猜测对应的离子方程式2Ag++2Iˉ=2Ag+I2。答案为:2Ag++2Iˉ=2Ag+I2;(5)设计原电池证明Ag+也能氧化 Iˉ,则应让Ag+与I-不接触,分别放在两个烧杯内,用石墨作电极,用盐桥连接,则装置图为:。答案为:Ag+会与Iˉ发生反应生成AgI沉淀,使Ag+的浓度下降,从而减弱Ag+的氧化性,使上述反应很难发生;。【点睛】设计原电池,为避免阴、阳离子发生反应生成沉淀等,可将含两种离子的电解质放在两只烧杯中,用盐桥形成闭合回路。 21.某实验小组同学对电化学原理进行了一系列探究活动(1)如图为该实验小组设计的原电池装置,Fe电极的电势______(填“高于”或“低于”)石墨的。反应前,两电极质量相等,一端时间后,两电极质量相差24g,则导线中通过_______mol电子。(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应式为_________,该电池电流由_______(填“铁”或“石墨”下同)电极经外电路流向_____电极;(3)用吸管吸出少许铁片附近的溶液置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,写出该过程中发生的氧化还原反应的离子方程式:_____。【答案】(1) 低于 0.4mol(2) 2H++2e-=H2↑ 石墨 铁(3)2Fe2++Cl2=2Fe3++2Cl- 【分析】原电池中,通常活泼金属做负极,故题目中Fe电极做负极,石墨电极为正极;当替换成NH4Cl溶液时, 水解使溶液呈酸性,溶液中的H+到石墨电极上面得电子,参与反应。(1)铁和石墨电极中,铁是活泼金属,能与电解质溶液中的CuCl2发生自发的氧化还原反应,故Fe做负极,石墨为正极,正极的电势高于负极;根据该原理的总反应方程式,设该过程中消耗的Fe的质量为x, ,有,解得x=11.2g,消耗的n(Fe)= =0.2mol,由于Fe从0价→+2价,故共转移0.2mol×2=0.4mol电子;(2)H+得电子生成氢气,电极方程式为:2H++2e-=H2↑;更换电解质溶液之后,电池的正负极没有发生改变,电流由正极(石墨)流出,经外电路(导线)流向负极(Fe);(3)滴入硫氰化钾溶液后变红,说明Fe2+被饱和氯水氧化成了Fe3+,则发生的氧化还原反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。 22.常温下,将除去表面氧化膜的Al、Cu片插入电解质A溶液中组成原电池,如图所示:(1)若A为稀盐酸,则Al片作_______极,该电极的电极反应式为_______。(2)若A为NaOH,则Al片作_______极,该电极的电极反应式为_______。(3)若A为稀HNO3,则Cu片作_______极。【答案】(1) 负 Al-3e-=Al3+(2) 负 Al+4OH--3e-=+2H2O(3)正 【解析】(1)若A为稀盐酸,铝比较活泼,反应中失去电子被氧化、则Al片作负极,该电极的电极反应式为Al-3e-=Al3+。(2)若A为NaOH,在碱性环境下,铝与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,则Al片作负极,Al电极的电极反应式:。(3)若A为稀HNO3,铝比较活泼,反应中失去电子被氧化、Al片作负极,则Cu片作正极。 23.依据电化学原理,回答下列问题:(1)图1是依据氧化还原反应Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。①电极X的材料是_____。②Y上发生的电极反应式为_____。③盐桥中装有含KCl饱和溶液的琼胶,放电过程盐桥中向左侧烧杯移动的离子主要是_____(填离子符号)。(2)科学家研发了一种绿色环保可充电“全氢电池”,其放电时工作原理如图2所示。①吸附层a上的电势_____(填“低于”、“高于”或“等于”)吸附层b上的电势。②吸附层a上的电极反应式为_____。③下列说法错误的是_____。A.该电池充电时,吸附层b接电源正极B.装置中的离子交换膜可以使用质子交换膜C.NaClO4的作用是传导离子和参与电极反应D.导线上通过1mole-,装置内H2总量减少0.5mol【答案】(1) Cu 2Fe3++2e-=2Fe2+ K+(2) 低于 H2-2e-+2OH-=2H2O BCD 【解析】(1)①由Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)可知:Cu失去电子,化合价升高,是电子流出的一极,为原电池的负极,故电极X的材料是铜;②电极Y是原电池的正极,发生Fe3+得电子的还原反应,可选择惰性电极碳或比铜活波性弱的材料做电极,如碳(石墨、金、铂、银)做正极,原电池正极的电极反应式为:2Fe3++2e-=2Fe2+;③盐桥中装有含KCl饱和溶液的琼胶,电池工作时,Cl-向负极移动,K+向正极移动,所以放电过程盐桥中向左侧烧杯移动的离子主要是K+;(2)由电子流向可知,左边吸附层为负极,发生了氧化反应,电极反应是 H2 -2e- +2OH- =2H2O,右边吸附层为正极,发生了还原反应,电极反应是 2H + +2e - =H2↑,结合原电池中阳离子移向正极,阴离子移向负极;①由电子流向可知,左边吸附层为负极,发生了氧化反应,右边吸附层为正极,发生了还原反应,电子总是由电势低的区域向电势高的区域移动,故吸附层 (a) 上的电势比吸附层 (b) 上的低;②由电子流向可知,左边吸附层a上为负极,发生了氧化反应,电极反应是H2 -2e- +2OH- =2H2O;③A.充电时,电池的正极和电源的正极相接,即电极b连接电源的正极,选项A错误;B.装置中的离子交换膜如果使用质子交换膜,则交换膜右侧的氢离子可以通过该交换膜与左侧的氢氧根离子发生反应,不利于电能产生,这个交换膜应该为钠离子交换膜,选项B错误;C.NaClO4的作用是传导离子,没有参与电极反应,选项C错误;D.该电池的总式为: H++OH- = H2O,导线上通过1mole-,装置内H2总量不变,选项D错误;答案选BCD。
相关课件
这是一份化学选择性必修1第三节 金属的腐蚀与防护备课课件ppt,文件包含431金属的腐蚀与防护分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、431金属的腐蚀与防护分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、431金属的腐蚀与防护教学课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池备课ppt课件,文件包含421电解池教学课件高二化学同步备课系列人教版2019选择性必修1pptx、421电解池解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、421电解池原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控备课ppt课件,文件包含224化学反应的调控分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、224化学反应的调控分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、224化学反应的条控教学课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。










