





所属成套资源:高二化学同步课件优化设计(2019鲁科版选择性必修第二册)ppt
第2章 章末整合课件PPT
展开
这是一份第2章 章末整合课件PPT,共60页。
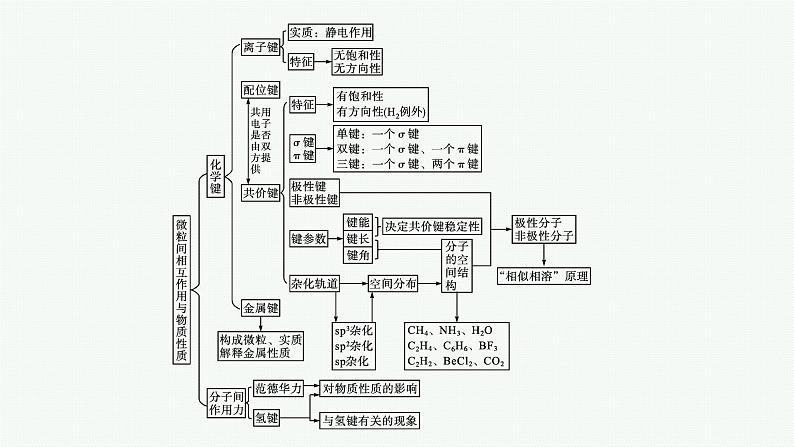
高中同步学案优化设计GAO ZHONG TONG BU XUE AN YOU HAU SHE JI第2章2021内容索引知识网络重难突破知识网络重难突破典例1M、N、X、Y四种短周期主族元素在周期表中的相对位置如下图所示,已知它们的原子序数总和为46。(1)M与Y形成的化合物中含 (填“极性”或“非极性”,下同)键,属 分子。 (2)N元素形成的单质分子中的化学键类型及数目是 (填“σ键”或“π键”)。 (3)由N、Y的氢化物相互作用所生成的物质的电子式为 。其中的化学键有 。 (4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式: 。答案 (1)极性 非极性(2)一个σ键、两个π键 解析 设M的质子数是x,则N的质子数是x+1,X的质子数是x+10,Y的质子数是x+11,4x+22=46,x=6,四种元素分别是C、N、S、Cl。M与Y形成化合物CCl4,分子中化学键是极性键,属于非极性分子。N2分子中有一个σ键、两个π键。碳与浓硫酸在加热条件下反应生成CO2、SO2和H2O。总结提升1.共价键的类型(1)根据共用电子对是否偏移,共价键分为极性键和非极性键。(2)根据共用电子对数,共价键分为单键、双键和三键。(3)根据原子轨道的重叠方式不同,可分为σ键(头碰头重叠)和π键(肩并肩重叠)。(4)配位键是一种特殊的共价键。它是成键元素原子一方提供孤电子对,另一方具有可接受孤电子对的空轨道。2.共价键的特征(1)共价键的饱和性。①按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。氢原子、氯原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。②共价键的饱和性决定了共价化合物的分子组成。(2)共价键的方向性。①共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现概率越大,形成的共价键越牢固。电子所在的原子轨道都有一定的形状,所以要取得最大重叠,共价键必然有方向性。②共价键的方向性决定了分子的空间结构。3.共价键存在范围(1)非金属单质分子(稀有气体除外)。如:O2、F2、H2、C60等。(2)非金属元素形成的化合物。如:H2SO4、CO2、H2O2、有机化合物分子等。(3)某些金属与非金属形成的化合物。如:BeCl2、AlCl3等。(4)部分离子化合物。如:Na2O2、NaOH、Na2SO4、NH4Cl等。4.共价键强弱的判断(1)由原子半径和共用电子对数判断:成键原子的半径越小,共用电子对数越多,则共价键越牢固,含有共价键的分子越稳定。如原子半径FH—I,稳定性HF>HCl>HBr>HI。(2)由键能判断:共价键的键能越大,表示破坏共价键消耗的能量越多,则共价键越牢固。(3)由键长判断:共价键的键长越短,破坏共价键消耗的能量越多,则共价键越牢固。变式训练1设NA表示阿伏加德罗常数的值,则下列说法正确的是( )A.1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道B.1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道C.1 mol C2H2分子中含有2NA个σ键、2NA个π键D.1 mol C2H4分子中含有4NA个σ键、2NA个π键答案 A解析 CO2分子中碳原子发生sp杂化,选项B不正确;碳碳三键是由1个σ键和2个π键构成的,乙炔分子中含有1个碳碳三键和2个C—H键,所以选项C不正确;碳碳双键是由1个σ键和1个π键构成的,乙烯分子中含有1个碳碳双键和4个C—H键,因此选项D不正确。典例2下列现象与化学键有关的是( )A.F2、Cl2、Br2、I2的熔点依次升高B.H2O的沸点远高于H2S的沸点C.H2O在高温下难分解D.干冰升华答案 C解析 A项,卤素单质分子间存在范德华力,且随相对分子质量的增大,范德华力也增大,单质的熔点也就越高;B项,由于H2O分子间存在氢键,所以H2O的沸点要比H2S的高;C项,由于H—O键的键能很大,在较高温度时也难断裂,所以水分子很稳定,与共价键有关;D项,CO2分子间通过范德华力结合在一起,在升华时需要克服范德华力,而CO2分子内的化学键并没有断裂。规律方法化学键的比较 变式训练2-1下列有关化学键的叙述,正确的是( )A.离子化合物中一定含有离子键B.单质分子中均不存在化学键C.含有极性键的分子一定是极性分子D.含有共价键的化合物一定是共价化合物答案 A解析 离子化合物一定含有离子键,A项正确;稀有气体分子中不存在化学键,其他非金属单质分子中存在化学键,B项错误;含有极性键且分子结构不对称的分子是极性分子,结构对称的是非极性分子,如CO2分子含有极性键,但属于非极性分子,C项错误;含有共价键的化合物可能是共价化合物(如HCl),也可能是离子化合物(如NH4Cl),共价化合物是只含有共价键的化合物,D项错误。变式训练2-2光谱证实单质铝与强碱溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中不存在的是( )A.共价键 B.非极性键C.配位键 D.σ键答案 B解析 光谱证实单质Al与强碱性溶液反应有[Al(OH)4]-生成,可看作铝原子和三个羟基形成三对共用电子对,形成三个极性共价键,形成Al(OH)3,Al(OH)3又能溶解在强碱性溶液中,和OH-结合形成[Al(OH)4]-,利用的是铝原子的空轨道和OH-中氧原子的孤电子对形成配位键;由两个原子轨道“头碰头”相互重叠而形成的共价键叫σ键,所以[Al(OH)4]-中也形成了σ键。典例3指出下列分子或离子的中心原子杂化轨道类型,并判断分子或离子的空间结构。(1)GeCl4中Ge的杂化轨道类型为 ,分子空间结构为 。 (2)AsCl3中As的杂化轨道类型为 ,分子空间结构为 。 (3)Se 中Se的杂化轨道类型为 ,离子空间结构为 。 答案 (1)sp3 正四面体形 (2)sp3 三角锥形 (3)sp3 正四面体形 规律方法中心原子杂化轨道类型的判断(1)根据分子或离子的空间结构判断。 (2)根据价电子对互斥理论判断。根据价电子对互斥理论能够比较容易而准确地判断ABm型共价分子或离子的空间结构和中心原子杂化轨道类型,其关系如下表。运用该理论的关键是准确计算中心原子的价电子对数,其计算方法如下:中心原子价电子对数=σ键电子对数+孤电子对数=σ键电子对数+(3)应用等电子原理判断。等电子体具有相同的结构特征,一般来说,等电子体的中心原子的杂化类型相同。对于结构模糊或复杂的分子、离子,可将其转化成熟悉的等电子体,然后进行判断。常见的等电子体往往是同族不同元素或同周期相近元素构成的微粒。(4)根据共价键类型判断。从杂化轨道理论可知,原子之间成键时,未杂化轨道形成π键,杂化轨道形成σ键。对于能够明确结构式的分子、离子,可直接用下式判断其中心原子的杂化轨道类型:杂化轨道数n=中心原子的σ键数+中心原子的孤电子对数(双键、三键中只有一个σ键,其余均为π键)。①SiF4分子中硅原子杂化轨道类型的分析:基态硅原子有四个价电子,与四个氟原子恰好形成四个σ键,无未成键电子,n=4,则SiF4分子中硅原子采用sp3杂化。②基态碳原子有四个价电子,在HCHO分子中,碳原子与两个氢原子形成两个σ键,与氧原子形成C==O键,C==O键中有一个σ键、一个π键,碳原子无未成键电子,n=3,则HCHO分子中碳原子采用sp2杂化。③三聚氰胺(结构简式如图所示)中有两种环境的氮原子,环外氮原子分别形成三个σ键,用去基态氮原子五个价电子中的三个,余下一对孤电子对,n=4,则环外氮原子采用sp3杂化;环内氮原子分别形成两个σ键、一个π键,用去基态氮原子5个价电子中的3个,余下一对孤电子对,n=3,则环内氮原子采用sp2杂化。(5)应用取代法判断。以中学常见的、熟悉的基础物质分子为原型,用其他原子或原子团取代原型分子中的部分原子或原子团,得到的新分子的中心原子与原型分子对应的中心原子的杂化轨道类型相同。如:①CH3CH==CH2可看成乙烯基取代了甲烷分子中的一个氢原子,则甲基碳原子采用sp3杂化,也可看成甲基取代了乙烯分子中的一个氢原子,故两个不饱和碳原子均采用sp2杂化。②(CH3)3N可看成三个甲基取代了NH3分子中的三个氢原子,所以其分子中氮原子采用sp3杂化。③H2O2可看成羟基取代了H2O分子中的一个氢原子,故H2O2中氧原子应采用sp3杂化。④B(OH)3可看成三个羟基取代了BF3中的氟原子,可知B(OH)3中硼原子采用sp2杂化。变式训练3-1甲醛分子的结构式如图所示,用两个Cl取代甲醛分子中的H可得到二氯甲醛,下列描述正确的是( )A.甲醛分子中有四个σ键B.二氯甲醛分子中的碳原子采取sp3杂化C.甲醛分子中的H—C—H键角与二氯甲醛分子中的Cl—C—Cl键角相等D.二氯甲醛分子的空间结构为三角形,分子中存在一个π键答案 D解析 甲醛分子中有三个σ键,A不正确;二氯甲醛分子中的碳原子采取sp2杂化,B不正确;根据价电子对互斥理论可知,二氯甲醛分子中的氯原子有三对孤电子对,孤电子对对成键电子对有更强的排斥作用,所以,甲醛分子中的H—C—H键角与二氯甲醛分子中的Cl—C—Cl键角不相等,C不正确;二氯甲醛分子的空间结构为三角形,碳与氧形成的双键中有一个是π键,D正确。变式训练3-2指出下列原子的杂化轨道类型及分子或离子的空间结构。(1)BCl3中的B采用 杂化,空间结构为 。 (2)PH3中的P采用 杂化,空间结构为 。 (3)N 中的N采用 杂化,空间结构为 。 答案 (1)sp2 三角形(2)sp3 三角锥形(3)sp2 角形解析 (1)BCl3:B采用sp2杂化,三个杂化轨道分别与三个Cl形成σ键,没有孤电子对,分子空间结构为三角形。(2)PH3:P采用sp3杂化,其中一个杂化轨道上有一对孤电子对不参与成键,另外三个杂化轨道分别与三个H形成σ键,由于一对孤电子对的存在,三个H不可能平均占据P周围的空间,而是被孤电子对排斥到一侧,形成三角锥形结构。(3)N :N采用sp2杂化,其中两个杂化轨道分别与两个O形成σ键,另一个杂化轨道有一对孤电子对,离子空间结构为角形。典例4价电子对互斥理论可用于预测简单分子或离子的空间结构。请回答下列问题:(1)利用价电子对互斥理论推断下列分子或离子的空间结构:SeO3 ;SCl2 ;N ; N ;HCHO ;HCN 。 (2)利用价电子对互斥理论推断键角的大小:①甲醛中H—C—H的键角 (填“>”“






