




- 第一节 化学反应速率2.1.1课件PPT 课件 0 次下载
- 第一节 化学反应速率2.1.2课件PPT 课件 0 次下载
- 第二节 化学平衡2.2.1课件PPT 课件 0 次下载
- 第二节 化学平衡2.2.2课件PPT 课件 0 次下载
- 第四节 化学反应的调控2.4课件PPT 课件 0 次下载
高中化学人教版 (2019)选择性必修1第一节 化学反应速率获奖ppt课件
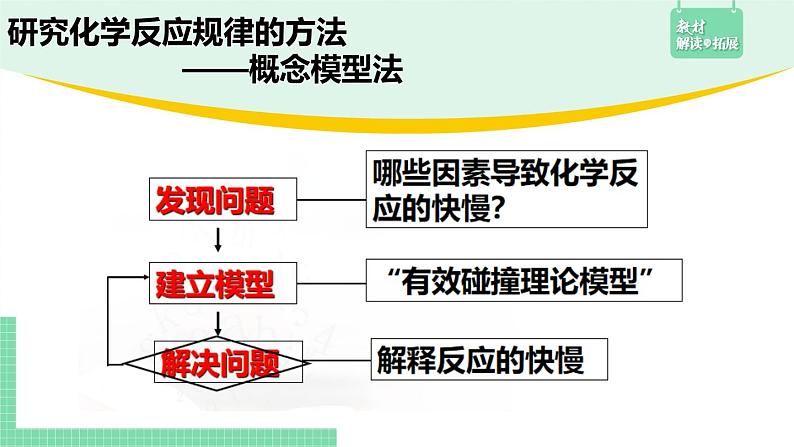
展开研究化学反应规律的方法 ——概念模型法
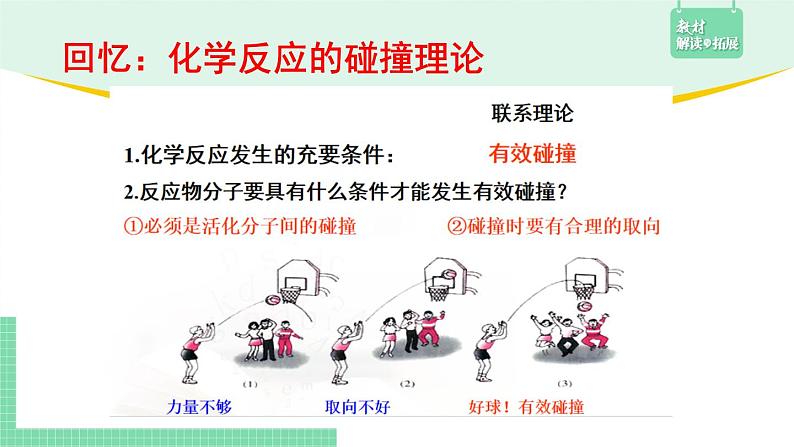
回忆:化学反应的碰撞理论
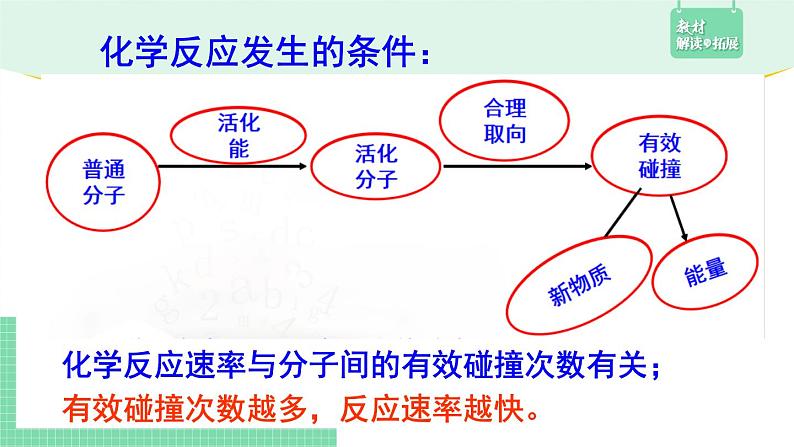
活化分子高出反应物分子平均能量的部分
活化能作用:使反应物活化,从而启动反应或改变反应速率
①活化分子具有较高的能量,能量不足的分子 获取能量(活化能)后才能变成活化分子。
②其他条件不变时,同一反应活化分子在反应物 中所占的百分数是一定的。
有效碰撞次数越多,反应速率越快。
化学反应速率与分子间的有效碰撞次数有关;
一、浓度对反应速率的影响
二、压强对反应速率的影响
三、温度对反应速率的影响
【原因】温度升高(1)分子获得能量,活化分子百分数提高;(2)分子热运动加快,碰撞频率提高。
四、催化剂对反应速率的影响
思考:加了催化剂,反应热有无改变?
催化剂作用:降低化学反应所需活化能, 从而提高反应速率.
1.下列说法错误的是A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应B.发生有效碰撞的分子一定是活化分子C.活化分子间的碰撞一定是有效碰撞D.活化分子间每次碰撞都发生化学反应E.能发生有效碰撞的分子必须具有相当高的能量
2.参照反应Br2 + H2 HBr 的能量对反应历程的示意图,下列叙述中正确的( ) A. 正反应为放热反应 B. 加入催化剂,该化学反应的反应热不改变 C. 正反应为放热反应 D. 加入催化剂可增大正反应速率,降低逆反应速率
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共16页。PPT课件主要包含了有效碰撞,随堂练习,答案C等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共25页。PPT课件主要包含了化学反应速率的应用,催化剂,物质本身的结构和性质,感受实验,探究实验1,→v↑,加催化剂,应用举例,无影响,思考与讨论等内容,欢迎下载使用。
化学选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件: 这是一份化学选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共17页。PPT课件主要包含了慢慢锈蚀的铜钟,化学反应速率,vΔcΔt,数学表达式,是相同的,化学计量数,注意事项等内容,欢迎下载使用。













