






所属成套资源:高二化学同步课件 同步练习 (2019人教版选择性必修第一册)
- 第1章 本章总结课件PPT 课件 1 次下载
- 第1章 第1节 第1课时 反应热 焓变 试卷 试卷 0 次下载
- 第1章 第2节 反应热的计算 试卷 试卷 0 次下载
- 第2章 本章总结课件PPT 课件 0 次下载
- 第2章 第1节 第2课时 影响化学反应速率的因素 活化能课件PPT 课件 0 次下载
高中化学人教版 (2019)选择性必修1第二节 反应热的计算完美版ppt课件
展开
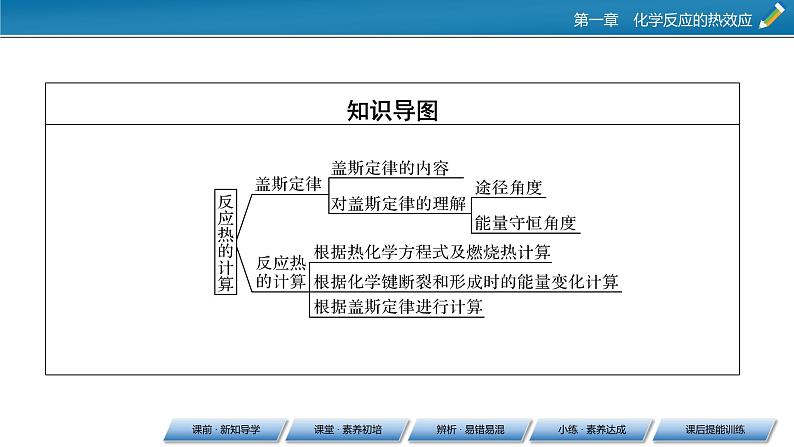
这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算完美版ppt课件,共57页。PPT课件主要包含了课前·新知导学,盖斯定律,ΔH1+ΔH2,-1105,反应热的计算,71kJ,ΔH1-ΔH2,微思考,课堂·素养初培,典例精练等内容,欢迎下载使用。
1.内容一个化学反应 ,不管是一步完成的还是分几步完成的,其反应热是__________的。
2.特点(1)在一定条件下,化学反应的反应热,只与反应体系的始态、终态有关,而与反应进行的________无关。(2)反应热的总值一定,如图表示始态到终态的反应热。则ΔH=__________=_________________。
ΔH3 + ΔH4+ΔH5
1.利用热化学方程式计算25 ℃、101 kPa,使1.0 g Na与足量Cl2反应,生成NaCl晶体并放出17.87 kJ热量,则生成1 ml NaCl的反应热为____________________。2.利用燃烧热计算乙醇的燃烧热为ΔH =-1 366.8 kJ·ml-1,则25 ℃、101 kPa时1 g乙醇完全燃烧放出的热量为________。
-411.01 kJ·ml-1
3.利用盖斯定律计算已知:温度过高时,WO2(s)转变为WO2(g):①WO2(s)+2H2(g)===W(s)+2H2O(g) ΔH1②WO2(g)+2H2(g)===W(s)+2H2O(g) ΔH2则WO2(s)===WO2(g)的 ΔH=______________。
反应①:2C(g)+O2(g)===2CO(g)和反应②:2CO(g)+O2(g)===2CO2(g)。两反应中的CO可看成“中间量”,将两反应直接相加,整理后得到的总反应方程式如何?
【答案】C(g)+O2(g)===CO2(g)。
正误判断。(对的打“√”,错的打“×”)(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量就越多。 ( )(2)化学反应的反应热与化学反应的始态有关,与终态无关。 ( )(3)利用盖斯定律,可计算某些反应的反应热。 ( )(4)任何化学反应的反应热都可以直接测定。 ( )
【答案】(1)× (2)× (3)√ (4)× (5)× (6)×
任务一 盖斯定律的理解与应用
[情境导入]“异曲同工”是指不同的曲调演得同样好,比喻不同的人的辞章或言论同样精彩,或者不同的做法收到同样的效果。热化学奠基人盖斯从化学反应的角度发现了同一反应虽然历经不同途径,但是不影响其反应热的规律,该规律被命名为“盖斯定律”。
(1)物质相互转化过程中,对于同一反应,经历的过程越多,损失的能量越大,正确吗?【答案】不正确。根据盖斯定律可知,反应过程无论经历多少步,其反应热不变。(2)利用盖斯定律计算反应热时需要注意哪些事项?【答案】①求总反应的反应热,不能将各步反应的反应热简单地相加;②不论反应是一步进行还是分步进行,只有始态和终态完全一致,盖斯定律才成立;③某些物质在反应分步进行时作为中间产物出现,最后应该恰好“消耗”完。
[深化理解]运用盖斯定律解题的常用方法(1)虚拟路径法:若反应物A变为生成物D,可以有两个途径:①由A直接变成D,反应热为ΔH;②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。如图所示:则有: ΔH=ΔH1+ΔH2+ΔH3 。
(3)解题注意事项。①热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减,所求之和为其代数和。③将一个热化学方程式颠倒时, ΔH 的“+”“-”号必须随之改变。
煤可通过下列两种途径成为燃料。途径Ⅰ C(s)+O2(g)===CO2(g) ΔH10①再燃烧水煤气:2CO(g)+O2(g)===2CO2(g) ΔH3
相关课件
这是一份高中人教版 (2019)第二节 反应热的计算完整版课件ppt,共32页。PPT课件主要包含了盖斯定律,反应热的计算等内容,欢迎下载使用。
这是一份化学选择性必修1第二节 反应热的计算作业ppt课件,共38页。PPT课件主要包含了bc+d-2a,a-2b等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算评优课ppt课件,共46页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业四,课后作业等内容,欢迎下载使用。










