




所属成套资源:高二化学同步课件 同步练习 (2019人教版选择性必修第一册)
人教版 (2019)选择性必修1第二节 化学平衡获奖课件ppt
展开
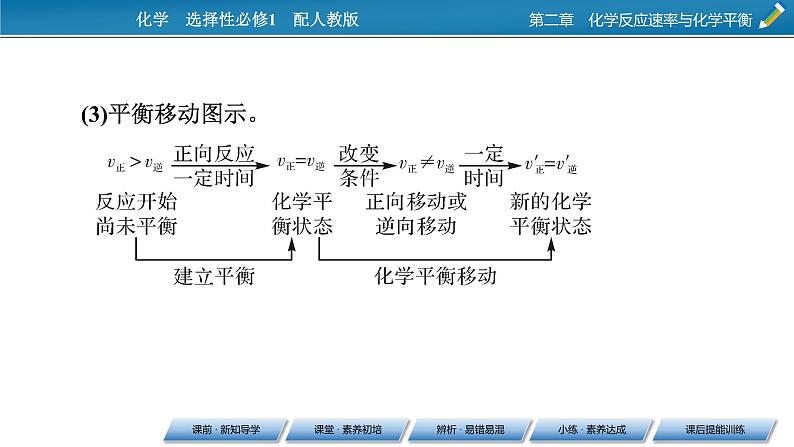
这是一份人教版 (2019)选择性必修1第二节 化学平衡获奖课件ppt,共60页。PPT课件主要包含了课前·新知导学,化学平衡的移动,新的平衡状态,3平衡移动图示,正反应,逆反应,最终比原来深,先变深后变浅,先变浅后变,深最终比原来浅等内容,欢迎下载使用。
1.化学平衡移动(1)含义:当一个可逆反应达到平衡后,如果改变________、________、压强等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到______________。(2)实质:改变条件后。①v正______v逆。②各组分的百分含量发生________。
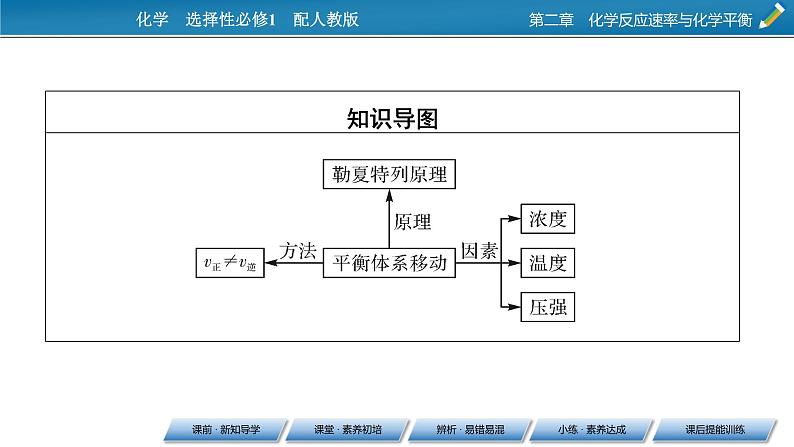
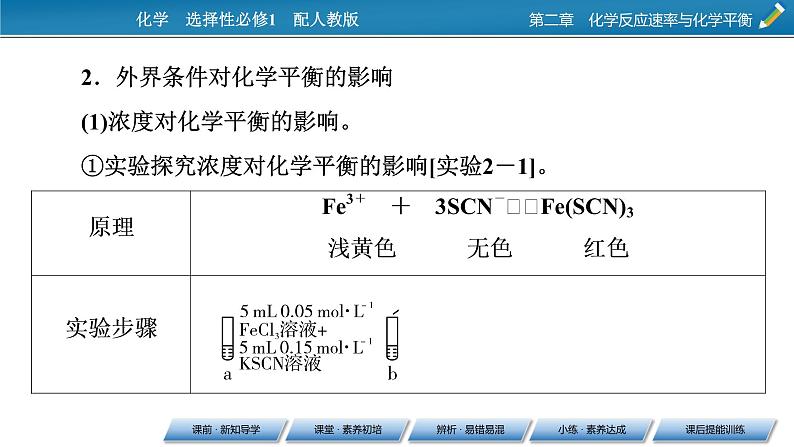
2.外界条件对化学平衡的影响(1)浓度对化学平衡的影响。①实验探究浓度对化学平衡的影响[实验2-1]。
②结论。在可逆反应达到平衡时,在其他条件不变的情况下:c(反应物)增大或c(生成物)减小,平衡向__________方向移动。c(反应物)减小或c(生成物)增大,平衡向__________方向移动。
(2)压强对化学平衡的影响。①实验探究压强对化学平衡的影响[实验2-2]。
(3)温度对化学平衡的影响。①实验探究温度对化学平衡的影响[实验2-3]。
②结论。其他条件不变时,升高温度平衡向着________的方向移动,降低温度平衡向着________的方向移动。(4)催化剂。催化剂可____________地改变正反应速率和逆反应速率,因此催化剂对化学平衡的移动____________。但催化剂可_______反应达到平衡所需的时间。
【名师点拨】平衡移动的结果是“减弱”外界条件的影响,而不是“消除”外界条件的影响,更不是“扭转”外界条件的影响。
3.勒夏特列原理如果改变影响平衡的条件之一,平衡将向着能够__________这种改变的方向移动,该结论就是勒夏特列原理。
(1)对于只有固体或液体参加的反应,体系压强的改变会使化学平衡状态发生变化吗?(2)催化剂对化学平衡有没有影响?工业生产往往使用催化剂,其目的是什么?
【答案】(1)压强的改变只影响有气体参加或生成的可逆反应。(2)催化剂能够同等程度改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但是可以改变达到平衡所需要的时间。工业生产往往使用催化剂,其目的是加快化学反应的速率,提高单位时间内的产量。
【答案】(1)× (2)× (3)× (4)× (5)×(6)× (7)× (8)× (9)√ (10)√
任务 外界条件对化学平衡的影响
(1)阅读材料并解释为什么空气中一氧化碳浓度增大时会发生一氧化碳中毒?【答案】空气中一氧化碳浓度增大,更多的Hb(CO)取代Hb(O2),造成人体缺氧,导致一氧化碳中毒。(2)思考并讨论如何利用平衡移动原理设计合理的方法救治一氧化碳中毒的病人?简述你的理由。【答案】如果有人一氧化碳中毒,应立即切断一氧化碳来源并将中毒者移至空气流通处,必要时可以将其放到高压氧舱中,增大氧气浓度。
(3)已知透光率与气体颜色有关,气体颜色越深,透光率越小。你能用平衡移动的原理解释NO2-N2O4体系体积变化过程中透光率变化的原因吗?【答案】压缩针筒时体系内压强增大,体积减小,气体颜色加深,透光率减小,但平衡会向正反应方向移动,所以透光率又会有所增大;拉伸针筒时体系压强又减小,气体颜色变浅,透光率增大,但平衡又会向逆反应方向移动,所以透光率又会有所减小。
【名师点拨】(1)压强改变只影响有气体参加或生成的可逆反应,对于只涉及固体或液体的反应,压强的影响不予考虑。(2)恒容时,通入稀有气体,压强增大,平衡不移动;恒压时,通入稀有气体,体积增大,平衡向气体体积增大的方向移动。(3)在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。(4)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
【答案】A【解析】B项,通入Z,平衡逆向移动,Z的体积分数增大。C项,W为固体,改变其用量,平衡不移动。D项,ΔH的大小与方程式中各物质的化学计量数及状态有关,与加入反应物的量无关。
【答案】A【解析】一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但其本身的转化率反而降低,故A错误。
【答案】C【解析】反应已达平衡,此时c(X)=0.3 ml/L,其他条件不变,将容器缩小到原来的1/2,若此时平衡不移动,c(X)=0.6 ml/L,但平衡移动之后c(X)=0.5 ml/L,说明加压平衡向正反应方向移动,正反应为气体减少的反应,若Y为固体或液体,则需要满足m>2m,A、B错误;若Y是气体,且m+n>2m,所以n>m,C正确;平衡正向移动,产物Z的体积分数应该增大,D错误。
(4)若x+y=z,缩小体积,增大压强,则平衡________(填“移动”或“不移动”)。【答案】 (1)正反应 (2)不移动 (3)x+y
相关课件
这是一份高中第二章 化学反应速率与化学平衡第二节 化学平衡获奖ppt课件,共32页。PPT课件主要包含了化学平衡的移动,升高温度,降低温度,没有影响,对着干理论,逆反心理,课堂小结,影响化学平衡的因素,勒夏特列原理等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt,共59页。PPT课件主要包含了课前·新知导学,新的平衡状态,3平衡移动图示,正反应,逆反应,溶液逐渐变成黄色,溶液逐渐变成橙色,变大后又减小,减小后又增大,气体体积减小等内容,欢迎下载使用。
这是一份化学人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡精品课件ppt,共29页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。










