





所属成套资源:高二化学同步课件 教学设计 学案设计 作业设计 (2019人教版选择性必修第一册)
选择性必修1 第一章 第二节 第1课时 盖斯定律-教学课件
展开
这是一份选择性必修1 第一章 第二节 第1课时 盖斯定律-教学课件,共29页。
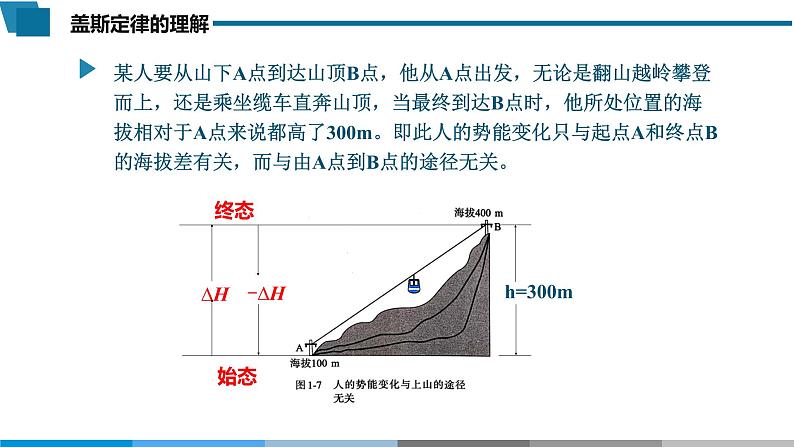
盖斯定律化学(人教版) 选择性必修1 第一章 第二节 第一课时2021年10月16日长征二号F运载火箭发射升空反应热的测定装置在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,难以控制反应的程度不能直接测定反应热∆H = ?但是有些反应热是无法直接测定的。例如:思考:能否利用一些已知反应的反应热来计算它的反应热呢?法国化学家拉瓦锡和法国数学家、天文学家拉普拉斯,利用冰量热计(即以被熔化了的冰的质量来计算热量)测定了碳单质的燃烧热。图1-8 盖斯1836年,盖斯利用自己设计的量热计测定了大量的反应热,并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。盖斯定律:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。盖斯定律例如:反应物A变成生成物C,可以有两个途径:①由A直接变成C,反应热为∆H;②由A先变成B,再由B变成C,每步的反应热分别是∆H1、 ∆H2 。如下图所示:∆H = ∆H1 + ∆H2 盖斯定律:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。盖斯定律也就是说,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。∆H = ∆H1 + ∆H2 某人要从山下A点到达山顶B点,他从A点出发,无论是翻山越岭攀登而上,还是乘坐缆车直奔山顶,当最终到达B点时,他所处位置的海拔相对于A点来说都高了300m。即此人的势能变化只与起点A和终点B的海拔差有关,而与由A点到B点的途径无关。h=300m始态终态盖斯定律的提出要早于能量守恒定律的确认,是热化学领域发现的第一个定律,也是自然科学上首先得出的能量守恒和转化的规律性结论。盖斯定律是化学热力学发展的基础。利用盖斯定律间接求算反应热伴随副反应的反应不容易直接发生的反应速率很慢的反应∆H3∆H1∆H2根据盖斯定律,有:∆H1 = ∆H3 + ∆H2 ∆H3 = ∆H1 - ∆H2 = -393.5kJ/mol - (-283.0kJ/mol) = -110.5kJ/mol 解题模型:虚拟路径法模型建构:计算碳不完全燃烧的反应热解题模型:加合法C(s)+ O2(g) = CO2(g) ∆H1=-393.5kJ/mol += -110.5kJ/mol 若某个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的反应热也可以由这几个反应的反应热相加减而得到。模型建构:计算碳不完全燃烧的反应热运用盖斯定律计算反应热的解题模型:盖斯定律的应用学习任务一:写出肼(N2H4,液态)与NO2反应的热化学方程式①N2(g)+2O2(g)=2NO2(g) ∆H1 = +66.4kJ/mol②N2H4(l)+ O2(g)=N2(g)+2H2O(g) ∆H2 = -534kJ/mol【资料】火箭发射时可以用肼(N2H4,液态)做燃料,NO2做氧化剂,二者反应生成N2和水蒸气。已知:2N2H4(l)+ 2NO2(g)= 3N2(g)+4H2O(g) ∆H = ?学习任务一:写出肼(N2H4,液态)与NO2反应的热化学方程式①N2(g)+2O2(g)=2NO2(g) ∆H1 = +66.4kJ/mol②N2H4(l)+ O2(g)=N2(g)+2H2O(g) ∆H2 = -534kJ/mol2N2H4(l)+ 2NO2(g)= 3N2(g)+4H2O(g) ∆H = ?2∆H1∆H = -∆H1 + 2∆H2 ∆H = -66.4kJ/mol+2*(-534kJ/mol) = -1134.4 kJ/mol学习任务一:写出肼(N2H4,液态)与NO2反应的热化学方程式①N2(g)+2O2(g)=2NO2(g) ∆H1 = +66.4kJ/mol②N2H4(l)+ O2(g)=N2(g)+2H2O(g) ∆H2 = -534kJ/mol2N2H4(l)+ 2NO2(g)= 3N2(g)+4H2O(g) ∆H = ?∆H = -534kJ/mol*2-66.4kJ/mol=-1134.4kJ/molN2(g)+2O2(g) = 2NO2(g) ∆H1 = +66.4kJ/mol2N2H4(l)+ 2O2(g)=2N2(g)+4H2O(g) ∆H3 = -534kJ/mol*22N2H4(l)+ 2NO2(g)= 3N2(g)+4H2O(g) ∆H = ∆H3 + ∆H4+2NO2(g) = N2(g)+2O2(g) ∆H4 = -66.4kJ/mol学习任务二:计算煤的气化反应的反应热C(s)+H2O(g)=CO(g)+H2(g) 【资料】目前,煤在我国仍然是第一能源。工业上通过煤的干馏、气化和液化等方法来实现煤的综合利用。其中,煤的气化是将煤转化为可燃性气体的过程,主要反应为:C(s)+H2O(g)=CO(g)+H2(g) 盖斯定律的应用∆H = ?学习任务二:计算煤的气化反应的反应热盖斯定律的应用C(s)+H2O(g)=CO(g)+H2(g) C(s)+ O2 (g)= CO2(g) ∆H1 = -393.5kJ/mol +C(s)+H2O(g)=CO(g)+H2(g) ∆H = ∆H1+ ∆H5+ ∆H4 学习任务二:计算煤的气化反应的反应热C(s)+H2O(g)=CO(g)+H2(g) 盖斯定律的应用根据目标方程式,同侧相加,异侧相减。学习任务三:能量伴随物质变化而转化盖斯定律的应用已知:研究人员提出利用含硫物质的热化学循环实现太阳能的转化与存储,过程如图1-2所示。反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) H1=+551kJ/mol反应III:S(s)+O2(g)=SO2(g) H3=-296kJ/mol写出反应II的热化学方程式:3SO2(g) + 2H2O(g) = 2H2SO4(l) + S(s)H2=?学习任务三:能量伴随物质变化而转化盖斯定律的应用已知:研究人员提出利用含硫物质的热化学循环实现太阳能的转化与存储,过程如图1-2所示。反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) H1=+551kJ/mol反应III:S(s)+O2(g)=SO2(g) H3=-296kJ/mol写出反应II的热化学方程式:3SO2(g) + 2H2O(g) = 2H2SO4(l) + S(s)SO2(g) = S(s)+O2(g) H3=+296kJ/mol2SO2(g)+2H2O(g)+O2(g) = 2H2SO4(l) H1=-551kJ/mol+3SO2(g) + 2H2O(g) = 2H2SO4(l) + S(s) H2=-255kJ/mol盖斯定律的应用已知:研究人员提出利用含硫物质的热化学循环实现太阳能的转化与存储,过程如图1-2所示。反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) H1=+551kJ/mol反应III:S(s)+O2(g)=SO2(g) H3=-296kJ/mol反应II:3SO2(g) + 2H2O(g) = 2H2SO4(l) + S(s) H2=-255kJ/mol若将反应I、II、III相加,会得到什么结果?说明什么?学习任务三:能量伴随物质变化而转化盖斯定律的应用已知:研究人员提出利用含硫物质的热化学循环实现太阳能的转化与存储,过程如图1-2所示。学习任务三:能量伴随物质变化而转化若将反应I、II、III相加,则该热化学循环过程没有实质意义上的物质转化,物质转化的作用是传递能量,含硫物质在该热化学循环中是储能物质。1.在298 K、101 kPa时,已知:①2H2O(g)===O2(g)+2H2(g) ΔH1②H2(g)+Cl2(g)===2HCl(g) ΔH2③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3则ΔH3与ΔH1、ΔH2之间的关系正确的是( )A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH22.在298K、100kPa时,已知: C(s,石墨) + O2(g) = CO2(g) ∆H1 = - 393.5 kJ/mol 2H2(g) + O2(g) = 2H2O(l) ∆H2 = - 571.6 kJ/mol 2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) ∆H3 = - 2599 kJ/mol根据盖斯定律,计算在298K时由C(s,石墨) 和H2(g)反应生成1molC2H2(g)的反应焓变。3.已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-,两步反应的焓变如图所示。 NH4+被氧化成NO3-的焓变示意图根据图示信息,计算1mol NH4+全部氧化成NO3-(aq)的∆H①C3H8(g)=CH4(g)+C2H2(g)+H2(g) ∆H1 = +255.7kJ/mol②C3H6(g)=CH4(g)+C2H2(g) ∆H2 = +131.5kJ/mol4.2008年北京奥运会“祥云”火炬的燃料是丙烷(C3H8),1996年亚特兰大奥运会火炬的燃料是丙烯(C3H6)。丙烷脱氢可得到丙烯。丙烷脱氢可得到丙烯。已知:盖斯定律的应用计算C3H8(g)=C3H6(g)+H2(g) 的 ∆H 。 图1-2-33. NH4+(aq)+ 2O2(g) = NO3-(g)+2H+(aq)+H2O(l) ∆H = -346kJ/mol 参考答案5. B2. 2C(s,石墨) + H2(g) = C2H2(g) ∆H = +226.7kJ/mol 4. 1. AC3H8(g)=C3H6(g)+H2(g) ∆H =+124.2kJ/mol化学(人教版) 选择性必修1 第一章 第二节 第一课时同学们,再见!






