所属成套资源:高二化学同步课件 教学设计 学案设计 作业设计 (2019人教版选择性必修第一册)
选择性必修1 第一章 第一节 第3课时 热化学方程式 燃烧热-作业设计
展开
这是一份选择性必修1 第一章 第一节 第3课时 热化学方程式 燃烧热-作业设计,共6页。
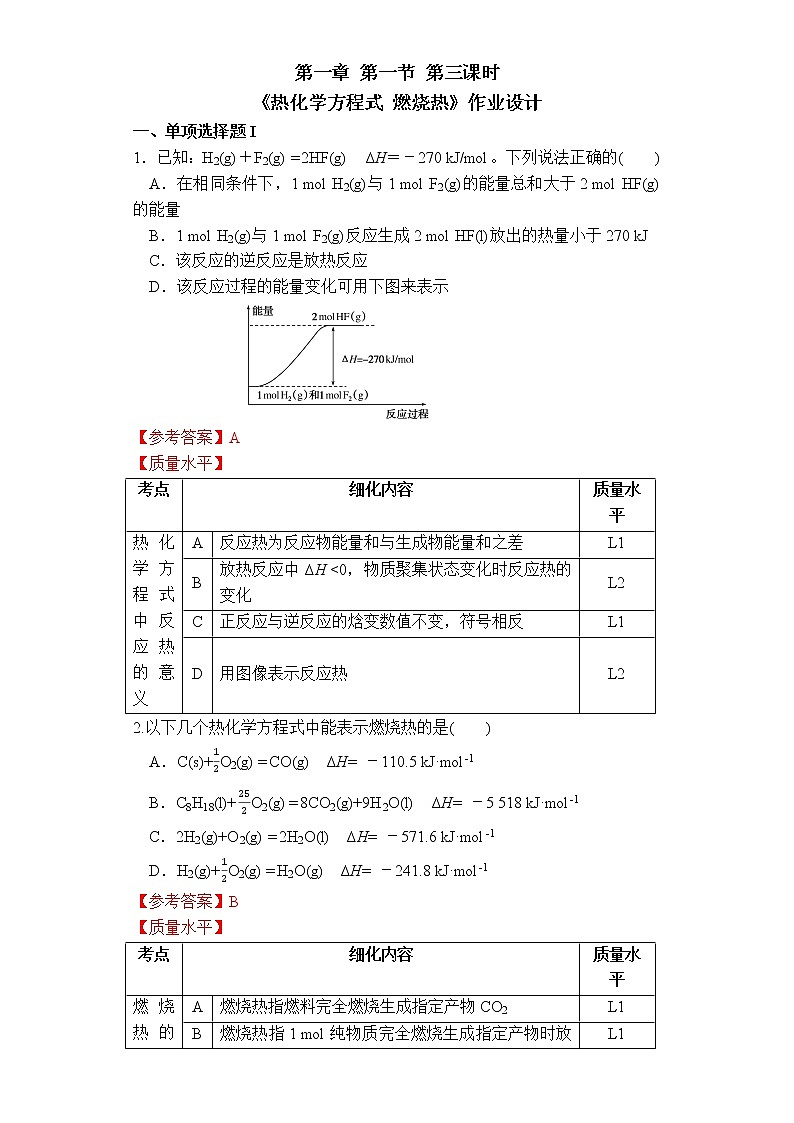
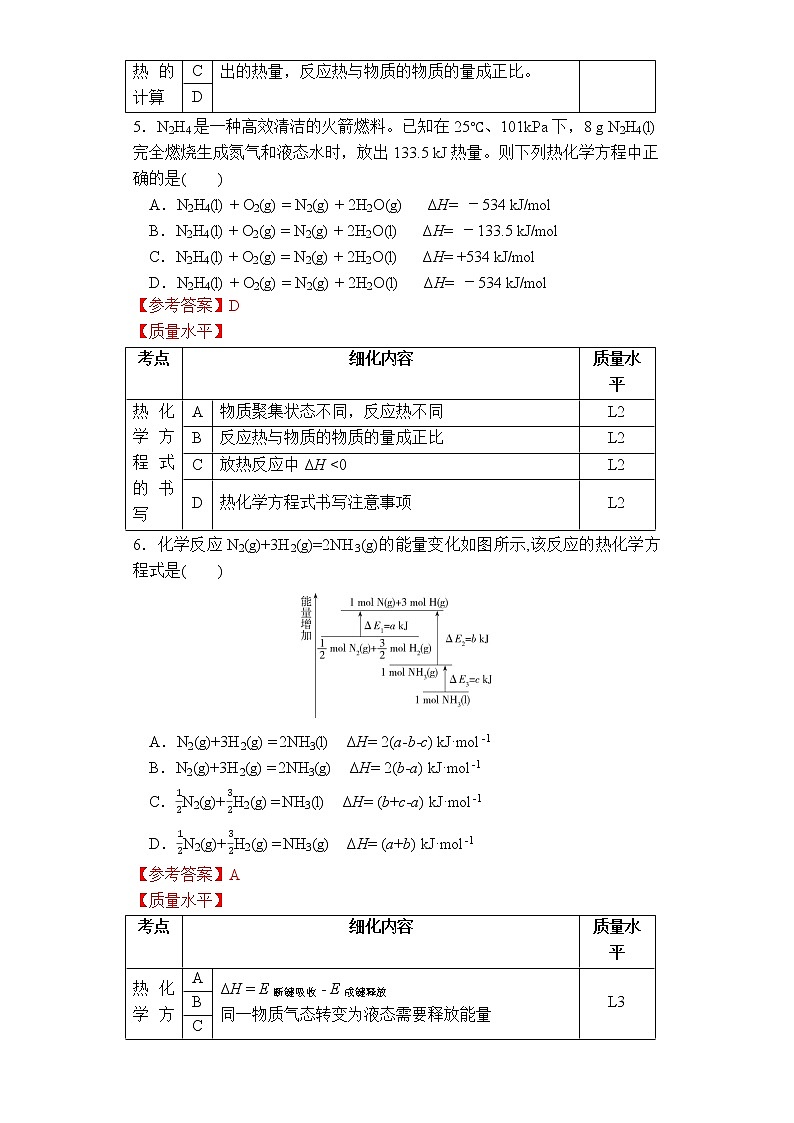
第一章 第一节 第三课时《热化学方程式 燃烧热》作业设计一、单项选择题I1.已知:H2(g)+F2(g) = 2HF(g) ΔH=-270 kJ/mol。下列说法正确的( )A.在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量B.1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(l)放出的热量小于270 kJC.该反应的逆反应是放热反应D.该反应过程的能量变化可用下图来表示【参考答案】A【质量水平】考点细化内容质量水平热化学方程式中反应热的意义A反应热为反应物能量和与生成物能量和之差L1B放热反应中ΔH <0,物质聚集状态变化时反应热的变化L2C正反应与逆反应的焓变数值不变,符号相反L1D用图像表示反应热L22.以下几个热化学方程式中能表示燃烧热的是( )A.C(s)+O2(g) = CO(g) ΔH= -110.5 kJ·mol-1B.C8H18(l)+O2(g) = 8CO2(g)+9H2O(l) ΔH= -5 518 kJ·mol-1C.2H2(g)+O2(g) = 2H2O(l) ΔH= -571.6 kJ·mol-1D.H2(g)+O2(g) = H2O(g) ΔH= -241.8 kJ·mol-1【参考答案】B【质量水平】考点细化内容质量水平燃烧热的概念A燃烧热指燃料完全燃烧生成指定产物CO2L1B燃烧热指1 mol纯物质完全燃烧生成指定产物时放出的热量L1C1 mol燃料完全燃烧生成指定产物放出的热量为燃烧热L1D氢元素完全燃烧生成的指定产物是液态水,而不是气态水L13. 下列关于热能的说法正确的是( )A.同温同压下,H2(g)+Cl2(g) = 2HCl(g)在光照和点燃条件下的ΔH不同B.101kPa时,1mol氢气在氯气中完全燃烧时所放出的热量叫作氢气的燃烧热C.已知C(石墨,s) = C(金刚石,s) ΔH = +1.9 kJ/mol,则金刚石比石墨更稳定D.“煮豆燃豆萁,豆在釜中泣”诗中涉及的能量变化主要是化学能转化为热能和光能【参考答案】D【质量水平】考点细化内容质量水平热化学方程式中反应热的意义A反应前后物质相同,反应热相同,与反应条件无关L1B燃烧热指1 mol纯物质完全燃烧生成指定产物时放出的热量,氢元素完全燃烧生成的指定产物是液态水L1C物质能量越低越稳定L2D能量变化在中国诗词描述中的体现L1 4.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭顺利点火升空,这意味着中国将能常态化发射飞船。偏二甲基肼(NCH3NH2CH3)是长征系列火箭的燃料,已知:25 ℃、101 kPa时,1.5 g偏二甲基肼完全燃烧生成CO2(g)、N2(g)、H2O(l)时,放出50 kJ热量,则偏二甲基肼的燃烧热为( )A.1 000 kJ·mol-1 B.1 500 kJ·mol-1 C.2 000 kJ·mol-1 D.3 000 kJ·mol-1【参考答案】C【质量水平】考点细化内容质量水平燃烧热的计算A燃烧热指1 mol纯物质完全燃烧生成指定产物时放出的热量,反应热与物质的物质的量成正比。L3BCD5.N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8 g N2H4(l)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )A.N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH= -534 kJ/molB.N2H4(l) + O2(g) = N2(g) + 2H2O(l) ΔH= -133.5 kJ/molC.N2H4(l) + O2(g) = N2(g) + 2H2O(l) ΔH= +534 kJ/molD.N2H4(l) + O2(g) = N2(g) + 2H2O(l) ΔH= -534 kJ/mol【参考答案】D【质量水平】考点细化内容质量水平热化学方程式的书写A物质聚集状态不同,反应热不同L2B反应热与物质的物质的量成正比L2C放热反应中ΔH <0L2D热化学方程式书写注意事项L26.化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,该反应的热化学方程式是( )A.N2(g)+3H2(g) = 2NH3(l) ΔH= 2(a-b-c) kJ·mol-1B.N2(g)+3H2(g) = 2NH3(g) ΔH= 2(b-a) kJ·mol-1C.N2(g)+H2(g) = NH3(l) ΔH= (b+c-a) kJ·mol-1D.N2(g)+H2(g) = NH3(g) ΔH= (a+b) kJ·mol-1【参考答案】A【质量水平】考点细化内容质量水平热化学方程式的书写及反应热的计算AΔH = E断键吸收 - E成键释放同一物质气态转变为液态需要释放能量反应热与物质的物质的量成正比L3BCD7.下列有叙述正确的是( )A.已知:2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol,即H2的燃烧热为571.6 kJ/molB.在稀溶液中:H+(aq) + OH—(aq) = H2O(l) ΔH = -57.3 kJ/mol,若将含1 mol CH3COOH的醋酸溶液与含1 mol Ba(OH)2的溶液混合,放出的热量为57.3 kJC.若2C(s) + O2(g) = 2CO(g) ΔH = -221 kJ/mol,则1 mol碳完全燃烧放出的热量小于110.5 kJD.若2NO2(g) N2O4(g) ΔH = -56.9 kJ/mol,则2 mol 置于密闭容器中充分反应吸收热量小于56.9 kJ【参考答案】D【质量水平】考点细化内容质量水平热化学方程式的书写A燃烧热指1 mol纯物质完全燃烧生成指定产物时放出的热量L1B弱酸电离吸热L2CCO进一步燃烧生成CO2释放能量L1D可逆反应为不完全反应L2 二、单项选择题II8.下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据,已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。则下列叙述正确的是( ) 物质CH4C2H2H2燃烧热/kJ/mol890.31 299.6285.8A.C≡C键键能为796.0 kJ/molB.C—H键键长小于H—H键C.2H2(g)+O2(g) = 2H2O(l) ΔH=-285.8 kJ/molD.相同条件下,16 g CH4完全燃烧生成水蒸气放出的热量为890.3 kJ【参考答案】A【质量水平】考点细化内容质量水平燃烧热的概念及计算A熟悉有机物的结构简式,根据ΔH = E断键吸收 - E成键释放计算燃烧热L2B键能越大,键长越小L1C燃烧热的概念辨析,反应热与物质的量成正比L1D燃烧热的概念辨析,CH4生成液态水而不是水蒸气L19.在101 kPa下,1 g物质完全燃烧放出的热量叫做该物质的热值,其中煤炭、氢气、天然气和液态甲醇的热值依次为33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是( )A.C(s) + O2(g) = CO(g) ΔH=-396 kJ/molB.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ΔH=-896 kJ/molC.2H2(g) + O2(g) = 2H2O(l) ΔH=-572 kJ/molD.CH3OH(l) + O2(g) = CO2(g) + 2H2O(l) ΔH=736 kJ/mol【参考答案】C【质量水平】考点细化内容质量水平燃烧热、热化学方程式的书写A热值煤炭完全燃烧应生成CO2(g)L3B天然气完全燃烧应生成H2O(g)C4 g H2完全燃烧放热143 kJ×4=572 kJDΔH应为“-” 三、非选择题10. (1)相同条件下,2 mol氢原子所具有的能量 1 mol氢分子所具有的能量。(2)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小: ΔH1 ___ ΔH2。 ①P4(白磷,s)+5O2(g) = 2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g) = 2P2O5(s) ΔH2。(3) 1 g甲烷与水蒸气发生反应,生成一氧化碳和氢气时吸收12.89 kJ热量,则该反应的热化学方程式为_________________________________________。(4) 在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为_________________________。 【参考答案】(1)>(2)<(3)CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH=+ 206.24 kJ·mol-1(4)CH3OH(l)+O2(g) = CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 【质量水平】考点细化内容质量水平化学反应能量变化的本质(1)成键放热,即2 mol氢原子形成新化学键生成1 mol氢分子时放热L1反应热大小比较(2)能量越低越稳定,即红磷能量比白磷低,燃烧时放出的热量较少L1热化学方程式的书写(3)1 mol甲烷16 g参与反应吸热12.89 kJ×16=206.24 kJ,因此该反应的热化学方程式为CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH=+ 206.24 kJ·mol-1L3燃烧热的热化学方程式的书写(4)在25 ℃、101 kPa下, 1 mol甲醇32 g燃烧生成CO2和液态水时放热22.68 kJ×32=725.76 kJ,因此甲醇燃烧热的热化学方程式为CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1L3






