

所属成套资源:2019人教版选择性必修第二册高二化学同步课件+练习
高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构精品第1课时当堂达标检测题
展开
这是一份高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构精品第1课时当堂达标检测题,共6页。试卷主要包含了下列说法正确的是等内容,欢迎下载使用。
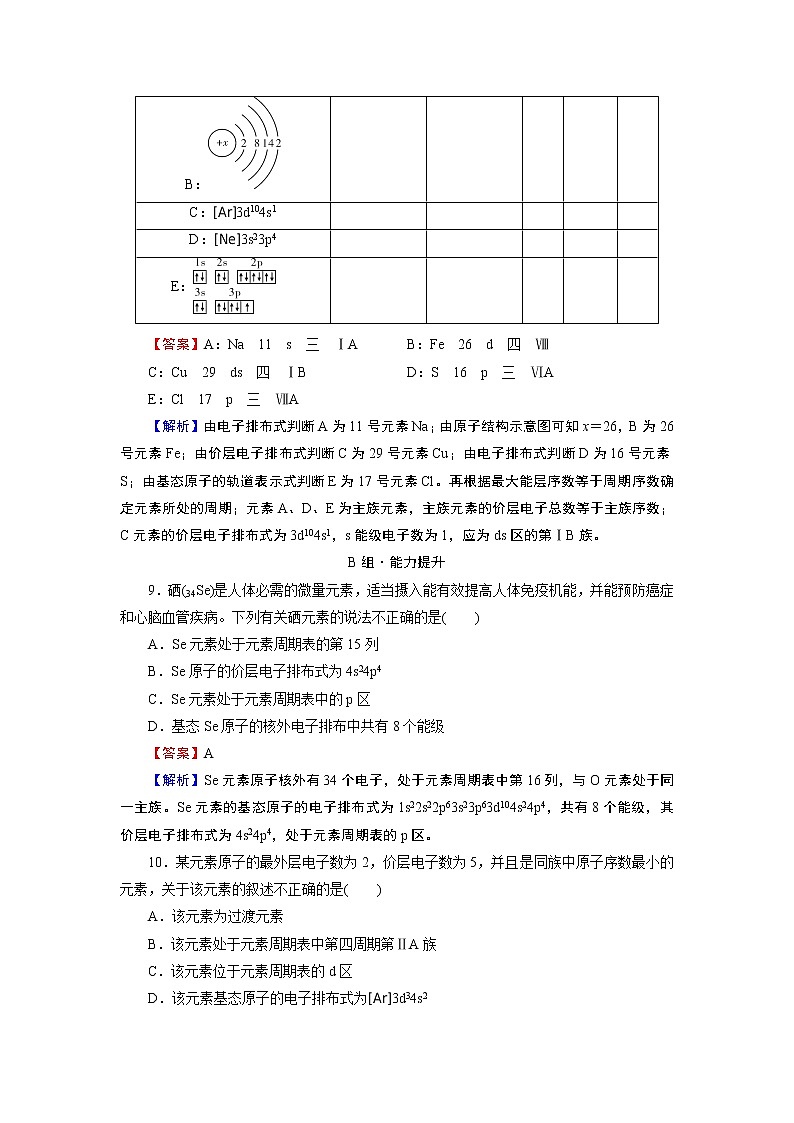
第一章 第二节 第1课时A组·基础达标1.某元素原子的简化电子排布式为[Xe]4f46s2,其应在( )A.s区 B.p区C.d区 D.f区【答案】D【解析】最外层有2个s电子、次外层s电子和p电子已全满、d电子0~2个、倒数第三层排布1~14个f电子(个别例外),即价层电子构型为(n-2)f0~14(n-1)d0~2ns2的元素为f区元素。2.下列说法正确的是( )A.所有金属元素都分布在d区和ds区B.最外层电子数为2的元素都分布在s区C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素D.s区均为金属元素【答案】C【解析】s区除H外均为金属元素,A、D错误;He、Zn等虽然最外层电子数为2但却不是s区元素,B错误;周期表中第ⅢB族~第ⅡB族为过渡元素,全部为金属元素,C正确。3.电子排布式为[Ar]3d54s2的元素是( )A.稀有气体元素 B.过渡元素C.主族元素 D.卤族元素【答案】B【解析】在最外能层p能级上填充有电子且未满时,一定为主族元素;最外能层p能级上未填充电子,而在次外层d(或倒数第三层f)能级上填充有电子的元素,一定是过渡元素。故电子排布式为[Ar]3d54s2的元素为过渡元素。4.下列说法正确的是( )A.最外层电子排布为ns2的基态原子对应的元素一定位于第ⅡA族B.最外层电子排布为ns1的基态原子对应的元素一定属于金属元素C.p区元素的原子p能级中一定都有电子D.基态原子价层电子排布式为nsnnpn的元素一定是非金属元素【答案】D【解析】最外层电子排布为ns2的基态原子可能是氦元素,也可能是过渡元素,不一定是第ⅡA族元素,A错误;最外层电子排布为ns1的基态原子不一定是金属元素,如H元素,除氢元素外,其他最外层电子排布为ns1的基态原子对应的元素都是金属元素,B错误;p区元素中的He原子最外层电子排布为1s2,C错误;最外层电子排布符合nsnnpn的元素只有n=2这一种情况,n=2时,该元素的价层电子排布式为2s22p2,是碳元素,属于非金属元素,D正确。5.下列是某些元素基态原子的电子排布式,其中表示第三周期元素的是( )A.1s22s1 B.1s22s22p5C.1s22s22p63s2 D.1s22s22p63s23p64s1【答案】C【解析】元素所在的周期数与最高能层序数n有关,第三周期元素的最高能层序数为3,故选C。6.价层电子排布式为4f75d16s2的元素在周期表中的位置是( )A.第四周期第ⅦB族 B.第五周期第ⅢB族C.第六周期第ⅦB族 D.第六周期第ⅢB族【答案】D【解析】因6s能级有两个电子,所以该元素在第六周期,5d和6s上电子数之和为3,且倒数第三层f能级上有7个电子,故该元素为第ⅢB族中的镧系元素,属于f区元素。7.闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛地应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等核素,下列关于金属钛的叙述不正确的是( )A.上述钛原子中,中子数不可能为22B.钛元素在周期表中处于第四周期C.钛的不同核素在周期表中处于不同的位置D.钛元素是d区的过渡元素【答案】C【解析】48Ti、49Ti、50Ti等核素的中子数分别为26、27、28,A正确;22Ti的价层电子排布式为3d24s2,因此钛是第四周期d区的过渡元素,B、D正确;元素在周期表中的位置由其质子数决定,各种钛的同位素原子所含的质子数相同,在周期表中占据同一位置,C错误。8.已知下列元素原子的结构或核外电子排布,分别判断其元素符号、原子序数并指出其在周期表中的位置。原子的结构或核外电子排布元素符号原子序数区周期族A:1s22s22p63s1 B: C:[Ar]3d104s1 D:[Ne]3s23p4 E: 【答案】A:Na 11 s 三 ⅠA B:Fe 26 d 四 ⅧC:Cu 29 ds 四 ⅠB D:S 16 p 三 ⅥAE:Cl 17 p 三 ⅦA【解析】由电子排布式判断A为11号元素Na;由原子结构示意图可知x=26,B为26号元素Fe;由价层电子排布式判断C为29号元素Cu;由电子排布式判断D为16号元素S;由基态原子的轨道表示式判断E为17号元素Cl。再根据最大能层序数等于周期序数确定元素所处的周期;元素A、D、E为主族元素,主族元素的价层电子总数等于主族序数;C元素的价层电子排布式为3d104s1,s能级电子数为1,应为ds区的第ⅠB族。B组·能力提升9.硒(34Se)是人体必需的微量元素,适当摄入能有效提高人体免疫机能,并能预防癌症和心脑血管疾病。下列有关硒元素的说法不正确的是( )A.Se元素处于元素周期表的第15列B.Se原子的价层电子排布式为4s24p4C.Se元素处于元素周期表中的p区D.基态Se原子的核外电子排布中共有8个能级【答案】A【解析】Se元素原子核外有34个电子,处于元素周期表中第16列,与O元素处于同一主族。Se元素的基态原子的电子排布式为1s22s22p63s23p63d104s24p4,共有8个能级,其价层电子排布式为4s24p4,处于元素周期表的p区。10.某元素原子的最外层电子数为2,价层电子数为5,并且是同族中原子序数最小的元素,关于该元素的叙述不正确的是( )A.该元素为过渡元素B.该元素处于元素周期表中第四周期第ⅡA族C.该元素位于元素周期表的d区D.该元素基态原子的电子排布式为[Ar]3d34s2【答案】B【解析】根据该元素原子的最外层电子数为2,价层电子数为5,可知其价层电子排布式为(n-1)d3ns2。又知该元素是同族中原子序数最小的元素,则该元素处于第四周期,其价层电子排布式为3d34s2,应为过渡元素,处于第四周期第ⅤB族,位于元素周期表的d区。11.铊是一种剧毒重金属,有关铊的信息如右下图所示。下列有关铊元素的说法中不正确的是( )A.Tl元素属于ds区元素B.Tl元素处于第六周期第ⅢA族C.Tl元素与Al元素处于同一主族D.Tl元素与Cs元素处于同一周期【答案】A【解析】由图示可知,Tl元素的价层电子排布式为6s26p1,则Tl元素处于元素周期表中第六周期第ⅢA族,与Al属于同主族元素,属于p区元素。Tl和Cs元素均处于第六周期。12.下列有关推断中,不符合实际的是( )①第n周期中有2n2种元素②第n周期第nA族元素不一定是金属元素③第n周期有(8-n)种非金属元素(含稀有气体)④最高价是+7价的元素一定是非金属元素A.①③④ B.①②④ C.②③④ D.①②③【答案】A【解析】在元素周期表中,第一~七周期分别有2、8、8、18、18、32、32种元素,①错误;第一周期第ⅠA族的氢元素不是金属元素,②正确;第一周期和第七周期各有2种非金属元素,③错误;KMnO4中的锰元素显+7价,锰是金属元素,④错误。13.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子最外层电子排布式为ns(n-1)np(n+1),则下列说法不正确的是( ) X Y Z A.Y元素原子的价层电子排布式为4s24p4B.Y元素在周期表的第三周期第ⅥA族C.X元素位于元素周期表的p区D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3【答案】A【解析】Y元素原子的价层电子排布式为ns(n-1)np(n+1),由n-1=2可得n=3,Y元素原子的价层电子排布式为3s23p4,则Y元素位于第三周期第ⅥA族,A错误,B正确;Z位于第四周期第ⅤA族,价层电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3,D正确;X、Y、Z最外层电子填充在p能级中,故X、Y、Z均位于p区,C正确。14.在研究原子核外电子排布与元素周期表的关系时,人们发现价层电子排布式相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示:(1)在s区中,族序数最大、原子序数最小的元素,原子的轨道表示式为__________。(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为____________________________________,其中较稳定的是__________。(3)在ds区中,族序数最大、原子序数最小的元素,原子的价层电子排布式为________。(4)在p区中,第二周期第ⅤA族元素原子的价层电子轨道表示式为______________。(5)当今常用于核能开发的元素是铀和钚,它们在____________区中。【答案】(1)(2)Fe2+,1s22s22p63s23p63d6;Fe3+,1s22s22p63s23p63d5 Fe3+(3)3d104s2(4)(5)f【解析】(1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其轨道表示式为。(2)d区为第ⅢB族~第ⅦB族及第Ⅷ族,族序数最大且原子序数最小的为Fe,常见离子为Fe2+、Fe3+,电子排布式依次为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d能级“半充满”,其稳定性强于Fe2+。(3)ds区符合题述条件的为Zn,其电子排布式为1s22s22p63s23p63d104s2,价层电子排布式为3d104s2。(4)该题中符合题意的为N,其价层电子轨道表示式为。(5)铀和钚均为锕系元素,位于f区。15.已知元素周期表共有18个纵列,如下图所示,实线表示元素周期表的边界。按价层电子排布式,可将周期表中的元素划分为s区、p区、d区、ds区等。除ds区外,其他分区的名称来自按构造原理最后填入的电子的能级符号。请回答下列问题:(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。(2)有的同学受这种划分的启发,认为周期表内第6、7纵列的部分元素可以排在另一分区,你认为应排在____________区。(3)请在元素周期表中用元素符号标出4s轨道半充满的元素。(4)随着科学技术的发展,不断有新的元素被发现。第七周期已排满,则现行元素周期表中总共有______种元素。 【答案】(1)如下图(2)ds(3)见上图(4)118【解析】(2)ds区价层电子排布式为(n-1)d10ns1或(n-1)d10ns2,而周期表内第6个纵列价层电子排布式为(n-1)d5ns1,第7个纵列价层电子排布式为(n-1)d5ns2,类比可知第6、7纵列可以放入ds区。(3)4s轨道半充满,即为4s1,根据构造原理、洪特规则可知,该元素基态原子的电子排布可能为[Ar]4s1(K)、[Ar]3d54s1(Cr)或[Ar]3d104s1(Cu),将三种元素分别标在元素周期表中的相应位置即可。(4)根据各周期元素种数可知,第七周期0族元素的原子序数为2+8+8+18+18+32+32=118。
相关试卷
这是一份人教版 (2019)选择性必修2第一节 原子结构优秀第1课时课后练习题,共5页。试卷主要包含了下列说法中正确的是,下列叙述中正确的是,下列说法中错误的是,下列说法正确的是等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构优秀第1课时课时训练,共16页。试卷主要包含了熟悉原子结构与元素周期表的关系,熟悉元素周期表的结构,了解元素周期的应用价值,某元素的原子序数为30,试问等内容,欢迎下载使用。
这是一份高中化学选择性必修二 第1章 第2节 第1课时 原子结构与元素周期表 课件,共52页。










