






还剩47页未读,
继续阅读
所属成套资源:2019人教版选择性必修第二册高二化学同步课件+练习
成套系列资料,整套一键下载
- 第2章 第3节 第1课时 共价键的极性课件PPT 课件 0 次下载
- 第2章 第3节 第2课时 分子间的作用力 分子的手性课件PPT 课件 0 次下载
- 第2章 第1节 共价键 试卷 试卷 0 次下载
- 第2章 第2节 分子的空间结构 试卷 试卷 0 次下载
- 第2章 第3节 第1课时 共价键的极性 试卷 试卷 0 次下载
第二章 分子结构与性质 总结课件PPT
展开
这是一份第二章 分子结构与性质 总结课件PPT,共55页。
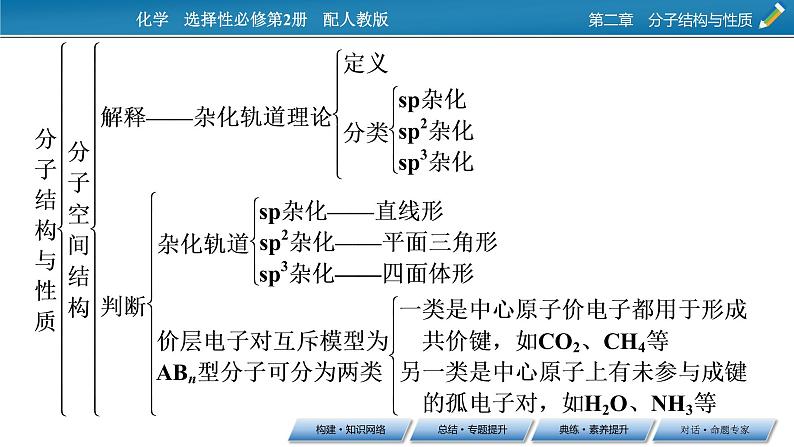
第二章 分子结构与性质本章总结构建·知识网络总结·专题提升判断分子空间结构的方法若B为氧原子、硫原子时,则不提供电子;若有成单电子时,则看成电子对。从价层电子对空间结构中去掉未成键的孤电子对,则为分子的空间结构。 下列分子或离子中,中心原子价层电子对的空间结构为四面体形,且分子或离子的空间结构为V形的是 ( )A.NH B.PH3 C.H3O+ D.OF2【答案】D【解析】中心原子价层电子对的空间结构为四面体形,且分子或离子的空间结构为V形的只能是由3个原子组成的分子,中心原子有2对孤电子对。OF2分子为V形结构;NH是三角锥形的NH3结合一个H+后形成的正四面体形结构;H3O+是V形的H2O结合一个H+后形成的三角锥形结构;PH3中P原子上有一对孤电子对,呈三角锥形。2.根据杂化轨道类型判断由于杂化轨道类型不同,杂化轨道的夹角也不同,其成键时键角也不同,故杂化轨道的类型与分子的空间结构有关系,具体如下表:当杂化轨道都参与成键(杂化轨道数与结合的原子数相同)时,杂化轨道形成的空间结构与分子的空间结构一致。 下列物质的分子中,中心原子的“杂化方式”及“分子空间结构”与CH2O(甲醛)相同的是 ( )A.H2S B.NH3C.CH2Br2 D.BF3【答案】D【解析】CH2O和BF3均为平面形分子,两者的中心原子均采取sp2杂化;H2S和H2O相似;CH2Br2是CH4中的两个H被Br取代得到,H2S、NH3、CH2Br2的中心原子都采取sp3杂化。3.根据共价键的键角判断分子的空间结构与共价键的键角的关系如下表:【答案】A4.根据等电子原理判断原子总数相同、价电子总数相同的分子属于等电子体,等电子体具有相似的化学键特征,它们的许多性质是相近的。通常情况下,等电子体的空间结构相同,例如SO2与O3均为V形结构,CH4与NH均为正四面体形结构。【答案】B【解析】A项,H2O分子中心原子采取sp3杂化,为V形;SO2分子中心原子采取sp2杂化,为V形。B项中BeCl2和CO2分子中心原子都是采取sp杂化,为直线形。C项,NH3分子中心原子采取sp3杂化,为三角锥形;H2O分子中心原子采取sp3杂化,为V形。D项,CH2O分子中心原子采取sp2杂化,为平面三角形;NH3分子中心原子采取sp3杂化,为三角锥形。共价键极性与分子极性的关系1.共价键的极性2.分子的极性非极性分子——空间结构呈中心对称的分子,如:平面正三角形分子、正四面体形分子等。极性分子——空间结构不呈中心对称的分子,如:V形分子、三角锥形分子等。3.键的极性与分子的极性关系 下列物质:①BeCl2,②Ar,③白磷,④BF3,⑤NH3,⑥过氧化氢,其中含极性键的非极性分子是 ( )A.①④⑥ B.②③⑥C.①④ D.①③④⑤【答案】C【解析】BeCl2空间结构是直线形,BeCl2是含极性键的非极性分子;Ar 为稀有气体,分子中不含化学键;白磷分子式为P4,不含极性键,含有的是非极性键;BF3是平面三角形结构,是含极性键的非极性分子;NH3是三角锥形结构,是含极性键的极性分子;过氧化氢是含极性键和非极性键的极性分子,所以选C。1.一般分子形成氢键必须具备两个基本条件(1)与电负性很大的原子X(F、O、N)形成强极性键的氢原子。(2)较小半径、较大电负性、含孤电子对、带有部分负电荷的原子Y(F、O、N)。对氢键的理解2.氢键对物质性质的影响(1)分子间氢键的形成增强了分子间作用力,导致化合物的熔、沸点升高;分子内氢键的形成则削弱了分子间作用力,导致化合物的熔、沸点降低。(2)氢键会使物质在水中的溶解性增强。(3)氢键会使物质的密度增大。3.简单区别氢键与化学键氢键是一种非化学键作用力,比化学键弱得多,但比范德华力强,可以说氢键是一种比较强的分子间作用力。化学键存在于分子内,是将原子结合成分子的作用力;分子间作用力存在于分子间,是保持物质聚集状态的作用力,它们本质上都是静电作用,但大小相差1~2个数量级。化学键强弱主要影响物质的化学性质,氢键主要影响物质的物理性质。 下列说法正确的是 ( )A.H2O的稳定性很强,是因为H2O分子之间能形成氢键B.水结成冰时,H—O键的键长变长,密度减小C.含氢元素的化合物中一定有氢键D.能与水分子形成氢键的物质易溶于水【答案】D【解析】氢键是一种相对较强的分子间作用力,它主要影响物质的物理性质,如熔沸点、密度、溶解度等,而分子的稳定性由分子内共价键的强弱决定,与氢键无关,A错误。在冰中,水分子之间以氢键结合,形成比较疏松的晶体,在晶体结构中有许多空隙,造成冰的密度比水的密度小,B错误。形成氢键必须有电负性很大的非金属元素的原子,如N、O、F,其他元素的原子则不易形成氢键,C错误。典练·素养提升素养解读 好多物质是由分子构成的,分子又是由原子构成的,构成分子的原子数目及各原子在空间的位置不同都会影响物质的性质。原子通过共价键构成分子时,根据共价键的分类可以将纷繁复杂的物质分成不同的类别,从微观角度认识物质性质的规律。通过对分子空间结构的判断,可逐步培养宏观辨识与微观探析、科学探究与创新意识等学科核心素养。1.(证据推理与模型认知)比较下列化合物的沸点,前者低于后者的是 ( )A.乙醇与氯乙烷B.邻羟基苯甲酸与对羟基苯甲酸C.对羟基苯甲醛与邻羟基苯甲醛D.H2O与H2Te【答案】B【解析】邻羟基苯甲酸、邻羟基苯甲醛等容易形成分子内氢键,沸点较低;而对羟基苯甲酸、对羟基苯甲醛容易形成分子间氢键,沸点较高,B正确。2.(宏观辨识与微观探析、科学探究与创新意识)下列物质的酸性强弱比较正确的是 ( )A.CH3COOH>HCOOHB.HCOOH>CH3COOH>CH3CH2COOHC.HClO3<HClOD.CH2FCOOH<CH2ClCOOH<CH3COOH【答案】B【解析】CH3—的推电子作用使CH3COOH酸性弱于HCOOH,A错误;含碳原子数越多的烷基推电子作用越强,使O—H键极性越弱,导致相应羧酸的酸性减弱,所以B正确;同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,C错误;由于吸电子能力:F>Cl>H,D错误。3.(宏观辨识与微观探析)下列各组物质的分子中,都属于含极性键的非极性分子的是 ( )A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2 D.NH3、HCl【答案】B【解析】Cl2分子中无极性键。根据分子的空间结构可以判断,H2S、NH3、HCl分子中正负电荷中心不重合,属于极性分子。4.(宏观辨识与微观探析)下列说法正确的是 ( )A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的B.H2O与H2S的空间结构相似,这是由共价键的饱和性决定的C.并非所有的共价键都有方向性D.两原子轨道发生重叠后,电子在两核间出现的概率减小【答案】C【解析】s轨道是球形对称,所以s-s σ键无方向性,其他的共价键都有方向性。共价键的饱和性决定组成分子的原子间的数量关系,共价键的方向性,决定分子的空间结构。5.(宏观辨识与微观探析)防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为其有效成分的分子中含有π键,这些分子中的π键电子可以在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。下列物质没有防晒效果的是 ( )A.氨基苯甲酸 B.羟基丙酮C.肉桂酸(C6H5CHCHCOOH) D.酒精【答案】D【解析】π键只存在于不饱和键中,A、B、C项物质分子中均含有π键,而酒精分子中无不饱和键,不含有π键,故酒精没有防晒效果。对话·命题专家 按要求完成下列空白。(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是________。 (2)①碳在形成化合物时,其键型以共价键为主,原因是____________________。 ②CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同立体构型和键合形式的分子或离子__________。 (3)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:①C和D反应可生成组成比为1∶3的化合物E,E的立体构型为__________________,中心原子的杂化轨道类型为__________。 ②化合物D2A的立体构型为__________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为__________________________________________。解题策略:(1)解题步骤:解答此类试题,第一步要推断出具体的元素和微粒;第二步要根据中心原子的价电子数或结合的原子个数,用互斥理论或杂化理论判断出空间构型,有的也可以根据熟悉的分子空间构型利用等电子体理论判断分子的空间构型和杂化类型,得出正确答案。高考中常常将互斥理论和杂化理论等知识结合起来进行综合考查。(2)方法技巧:本题运用公式法、类比法进行分析总结而得出答案。答案:(1)正四面体(2)①C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构②σ键和π键 sp CO2、SCN-(或COS等)(3)①三角锥形 sp3 ②V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl) (1) 硫的氢化物的沸点低于与其组成相似的氧的氢化物,其原因是____________________。(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_______ _____________。 (3)氨的沸点______(填“高于”或“低于”)膦(PH3),原因是__________;氨是______(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为______。 解题策略:(1)解题步骤:一般来说,先判断物质性质不同的原因,是共价键极性强弱问题,还是分子间作用力问题,尤其是是否涉及氢键的问题,再针对性比较物质的性质。利用互斥理论、杂化理论判断出空间构型和中心原子的杂化类型。(2)方法技巧:本题运用规律排序法、归纳总结法、类比推断法进行分析总结而得出答案。答案:(1)H2S分子间不能形成氢键,H2O分子间可以形成氢键(2)Ge原子半径大,原子间形成的σ单键较长,p-p轨道“肩并肩”重叠程度很小或几乎不能重叠,难以形成π键(3)高于 NH3分子间可形成氢键 极性 sp3(4)①CD ②BC
第二章 分子结构与性质本章总结构建·知识网络总结·专题提升判断分子空间结构的方法若B为氧原子、硫原子时,则不提供电子;若有成单电子时,则看成电子对。从价层电子对空间结构中去掉未成键的孤电子对,则为分子的空间结构。 下列分子或离子中,中心原子价层电子对的空间结构为四面体形,且分子或离子的空间结构为V形的是 ( )A.NH B.PH3 C.H3O+ D.OF2【答案】D【解析】中心原子价层电子对的空间结构为四面体形,且分子或离子的空间结构为V形的只能是由3个原子组成的分子,中心原子有2对孤电子对。OF2分子为V形结构;NH是三角锥形的NH3结合一个H+后形成的正四面体形结构;H3O+是V形的H2O结合一个H+后形成的三角锥形结构;PH3中P原子上有一对孤电子对,呈三角锥形。2.根据杂化轨道类型判断由于杂化轨道类型不同,杂化轨道的夹角也不同,其成键时键角也不同,故杂化轨道的类型与分子的空间结构有关系,具体如下表:当杂化轨道都参与成键(杂化轨道数与结合的原子数相同)时,杂化轨道形成的空间结构与分子的空间结构一致。 下列物质的分子中,中心原子的“杂化方式”及“分子空间结构”与CH2O(甲醛)相同的是 ( )A.H2S B.NH3C.CH2Br2 D.BF3【答案】D【解析】CH2O和BF3均为平面形分子,两者的中心原子均采取sp2杂化;H2S和H2O相似;CH2Br2是CH4中的两个H被Br取代得到,H2S、NH3、CH2Br2的中心原子都采取sp3杂化。3.根据共价键的键角判断分子的空间结构与共价键的键角的关系如下表:【答案】A4.根据等电子原理判断原子总数相同、价电子总数相同的分子属于等电子体,等电子体具有相似的化学键特征,它们的许多性质是相近的。通常情况下,等电子体的空间结构相同,例如SO2与O3均为V形结构,CH4与NH均为正四面体形结构。【答案】B【解析】A项,H2O分子中心原子采取sp3杂化,为V形;SO2分子中心原子采取sp2杂化,为V形。B项中BeCl2和CO2分子中心原子都是采取sp杂化,为直线形。C项,NH3分子中心原子采取sp3杂化,为三角锥形;H2O分子中心原子采取sp3杂化,为V形。D项,CH2O分子中心原子采取sp2杂化,为平面三角形;NH3分子中心原子采取sp3杂化,为三角锥形。共价键极性与分子极性的关系1.共价键的极性2.分子的极性非极性分子——空间结构呈中心对称的分子,如:平面正三角形分子、正四面体形分子等。极性分子——空间结构不呈中心对称的分子,如:V形分子、三角锥形分子等。3.键的极性与分子的极性关系 下列物质:①BeCl2,②Ar,③白磷,④BF3,⑤NH3,⑥过氧化氢,其中含极性键的非极性分子是 ( )A.①④⑥ B.②③⑥C.①④ D.①③④⑤【答案】C【解析】BeCl2空间结构是直线形,BeCl2是含极性键的非极性分子;Ar 为稀有气体,分子中不含化学键;白磷分子式为P4,不含极性键,含有的是非极性键;BF3是平面三角形结构,是含极性键的非极性分子;NH3是三角锥形结构,是含极性键的极性分子;过氧化氢是含极性键和非极性键的极性分子,所以选C。1.一般分子形成氢键必须具备两个基本条件(1)与电负性很大的原子X(F、O、N)形成强极性键的氢原子。(2)较小半径、较大电负性、含孤电子对、带有部分负电荷的原子Y(F、O、N)。对氢键的理解2.氢键对物质性质的影响(1)分子间氢键的形成增强了分子间作用力,导致化合物的熔、沸点升高;分子内氢键的形成则削弱了分子间作用力,导致化合物的熔、沸点降低。(2)氢键会使物质在水中的溶解性增强。(3)氢键会使物质的密度增大。3.简单区别氢键与化学键氢键是一种非化学键作用力,比化学键弱得多,但比范德华力强,可以说氢键是一种比较强的分子间作用力。化学键存在于分子内,是将原子结合成分子的作用力;分子间作用力存在于分子间,是保持物质聚集状态的作用力,它们本质上都是静电作用,但大小相差1~2个数量级。化学键强弱主要影响物质的化学性质,氢键主要影响物质的物理性质。 下列说法正确的是 ( )A.H2O的稳定性很强,是因为H2O分子之间能形成氢键B.水结成冰时,H—O键的键长变长,密度减小C.含氢元素的化合物中一定有氢键D.能与水分子形成氢键的物质易溶于水【答案】D【解析】氢键是一种相对较强的分子间作用力,它主要影响物质的物理性质,如熔沸点、密度、溶解度等,而分子的稳定性由分子内共价键的强弱决定,与氢键无关,A错误。在冰中,水分子之间以氢键结合,形成比较疏松的晶体,在晶体结构中有许多空隙,造成冰的密度比水的密度小,B错误。形成氢键必须有电负性很大的非金属元素的原子,如N、O、F,其他元素的原子则不易形成氢键,C错误。典练·素养提升素养解读 好多物质是由分子构成的,分子又是由原子构成的,构成分子的原子数目及各原子在空间的位置不同都会影响物质的性质。原子通过共价键构成分子时,根据共价键的分类可以将纷繁复杂的物质分成不同的类别,从微观角度认识物质性质的规律。通过对分子空间结构的判断,可逐步培养宏观辨识与微观探析、科学探究与创新意识等学科核心素养。1.(证据推理与模型认知)比较下列化合物的沸点,前者低于后者的是 ( )A.乙醇与氯乙烷B.邻羟基苯甲酸与对羟基苯甲酸C.对羟基苯甲醛与邻羟基苯甲醛D.H2O与H2Te【答案】B【解析】邻羟基苯甲酸、邻羟基苯甲醛等容易形成分子内氢键,沸点较低;而对羟基苯甲酸、对羟基苯甲醛容易形成分子间氢键,沸点较高,B正确。2.(宏观辨识与微观探析、科学探究与创新意识)下列物质的酸性强弱比较正确的是 ( )A.CH3COOH>HCOOHB.HCOOH>CH3COOH>CH3CH2COOHC.HClO3<HClOD.CH2FCOOH<CH2ClCOOH<CH3COOH【答案】B【解析】CH3—的推电子作用使CH3COOH酸性弱于HCOOH,A错误;含碳原子数越多的烷基推电子作用越强,使O—H键极性越弱,导致相应羧酸的酸性减弱,所以B正确;同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,C错误;由于吸电子能力:F>Cl>H,D错误。3.(宏观辨识与微观探析)下列各组物质的分子中,都属于含极性键的非极性分子的是 ( )A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2 D.NH3、HCl【答案】B【解析】Cl2分子中无极性键。根据分子的空间结构可以判断,H2S、NH3、HCl分子中正负电荷中心不重合,属于极性分子。4.(宏观辨识与微观探析)下列说法正确的是 ( )A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的B.H2O与H2S的空间结构相似,这是由共价键的饱和性决定的C.并非所有的共价键都有方向性D.两原子轨道发生重叠后,电子在两核间出现的概率减小【答案】C【解析】s轨道是球形对称,所以s-s σ键无方向性,其他的共价键都有方向性。共价键的饱和性决定组成分子的原子间的数量关系,共价键的方向性,决定分子的空间结构。5.(宏观辨识与微观探析)防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为其有效成分的分子中含有π键,这些分子中的π键电子可以在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。下列物质没有防晒效果的是 ( )A.氨基苯甲酸 B.羟基丙酮C.肉桂酸(C6H5CHCHCOOH) D.酒精【答案】D【解析】π键只存在于不饱和键中,A、B、C项物质分子中均含有π键,而酒精分子中无不饱和键,不含有π键,故酒精没有防晒效果。对话·命题专家 按要求完成下列空白。(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是________。 (2)①碳在形成化合物时,其键型以共价键为主,原因是____________________。 ②CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同立体构型和键合形式的分子或离子__________。 (3)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:①C和D反应可生成组成比为1∶3的化合物E,E的立体构型为__________________,中心原子的杂化轨道类型为__________。 ②化合物D2A的立体构型为__________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为__________________________________________。解题策略:(1)解题步骤:解答此类试题,第一步要推断出具体的元素和微粒;第二步要根据中心原子的价电子数或结合的原子个数,用互斥理论或杂化理论判断出空间构型,有的也可以根据熟悉的分子空间构型利用等电子体理论判断分子的空间构型和杂化类型,得出正确答案。高考中常常将互斥理论和杂化理论等知识结合起来进行综合考查。(2)方法技巧:本题运用公式法、类比法进行分析总结而得出答案。答案:(1)正四面体(2)①C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构②σ键和π键 sp CO2、SCN-(或COS等)(3)①三角锥形 sp3 ②V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl) (1) 硫的氢化物的沸点低于与其组成相似的氧的氢化物,其原因是____________________。(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_______ _____________。 (3)氨的沸点______(填“高于”或“低于”)膦(PH3),原因是__________;氨是______(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为______。 解题策略:(1)解题步骤:一般来说,先判断物质性质不同的原因,是共价键极性强弱问题,还是分子间作用力问题,尤其是是否涉及氢键的问题,再针对性比较物质的性质。利用互斥理论、杂化理论判断出空间构型和中心原子的杂化类型。(2)方法技巧:本题运用规律排序法、归纳总结法、类比推断法进行分析总结而得出答案。答案:(1)H2S分子间不能形成氢键,H2O分子间可以形成氢键(2)Ge原子半径大,原子间形成的σ单键较长,p-p轨道“肩并肩”重叠程度很小或几乎不能重叠,难以形成π键(3)高于 NH3分子间可形成氢键 极性 sp3(4)①CD ②BC
相关资料
更多









