





所属成套资源:2019人教版选择性必修第二册高二化学同步课件+练习
- 第3章 第2节 分子晶体与共价晶体课件PPT 课件 0 次下载
- 第3章 第3节 金属晶体与离子晶体课件PPT 课件 0 次下载
- 第三章 晶体结构与性质 总结课件PPT 课件 0 次下载
- 第3章 第1节 物质的聚集状态与晶体的常识 试卷 试卷 0 次下载
- 第3章 第2节 分子晶体与共价晶体 试卷 试卷 0 次下载
化学第四节 配合物与超分子优秀ppt课件
展开
这是一份化学第四节 配合物与超分子优秀ppt课件,共56页。PPT课件主要包含了课前·新知导学,四水合铜离子,孤电子对,配位键,分子或离子,配合物,配合物的形成实验,蓝色沉淀,深蓝色晶体,微思考等内容,欢迎下载使用。
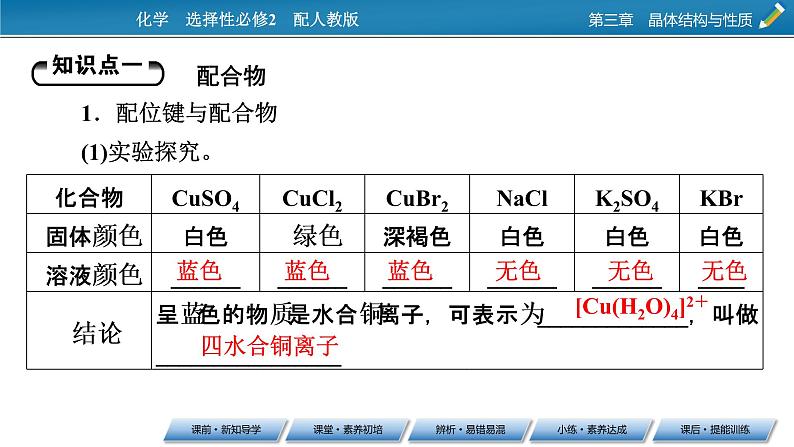
配合物1.配位键与配合物(1)实验探究。
[Cu(H2O)4]2+
(3)配合物。金属离子(或原子)与某些_______________(称为配体或配位体)以________结合形成的化合物,称为配位化合物,简称__________。
[Cu(NH3)4](OH)2
Fe3++3SCN-===Fe(SCN)3
Ag++Cl-=== AgCl↓
AgCl+2NH3=== [Ag(NH3)2]Cl
3.配合物的用途配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是____________的配合物。配合物在生产和科学技术方面的应用也很广泛。【答案】Fe2+
配位键是一类单独的化学键吗?配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?
【答案】配位键不是一类单独的化学键,它是一种特殊的共价键。[Cu(NH3)4]SO4中含有离子键、极性共价键和配位键。
【答案】(1)× (2)× (3)× (4)√
超分子1.定义:超分子是由______________________的分子(包括离子)通过__________________形成的分子聚集体。超分子这种分子的聚集体有的是有限的,有的是无限伸展的。2.超分子实例:DNA、冠醚、环糊精、杯芳烃、杯吡咯、杯咔唑、瓜环葫芦脲、柱芳烃等。
3.用途(1)用超分子________________。
(2)冠醚识别______________(如K+)
超分子与一般的分子相比,在组成上有哪些特点?
【答案】超分子是组成复杂的、有组织的分子聚集体,其具有明确的微观结构和宏观特性。
判断正误。(正确的画“√”,错误的画“×”)(1)超分子实际上属于混合物。( )(2)高分子化合物就是超分子。( )(3)DNA是一种超分子。( )(4)超分子是相对分子质量很大的有机化合物。( )【答案】(1)√ (2)× (3)√ (4)×
任务 配位键及其对物质性质的影响
在血液中氧气的输送是由血红蛋白来完成的。输送氧气时,氧气通过配位键与血红蛋白中的亚铁离子结合。但一氧化碳也能通过配位键与血红蛋白中的亚铁离子结合,并且其结合能力比氧气与亚铁离子结合能力强得多,因而会导致血红蛋白与一氧化碳结合而失去载氧能力。当一氧化碳浓度超过一定量时,就会导致人体因缺氧而中毒。
配位键实质上是一种特殊的共价键。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
(2)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子?【答案】N原子提供孤电子对,B原子提供空轨道。
(3)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?
1.配位键与非极性键、极性键的区别与联系
2.配合物的组成金属离子或原子与某些分子或离子(称为配体)以配位键结合而形成的化合物称为配位化合物。配位化合物的组成如图:一般中心原子(或中心离子)的配位数是2、4、6。
3.形成配合物的条件(1)配体有孤电子对。(2)中心原子(或离子)有空轨道。
4.配合物的形成对性质的影响(1)溶解性的影响。如:AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀,转变为易溶于水的物质。(2)颜色的改变。当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
(3)稳定性增强。配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
5.超分子化学研究范围大致可分为三类(1)环状配体组成的主客体体系。(2)有序的分子聚集体。(3)由两个或两个以上基团用柔性链或刚性链连接而成的超分子化合物。
6.超分子“自组装原则”的应用人们可以根据超分子自组装原则,以分子间的相互作用力作为工具,把具有特定的结构和功能的组分或建筑模块按照一定的方式组装成新的超分子化合物。这些新的化合物不仅仅能表现出单个分子所不具备的特有性质,还能大大增加化合物的种类和数目。如果人们能够很好地控制超分子自组装过程,就可以按照预期目标更简单、更可靠地得到具有特定结构和功能的化合物。
向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
【答案】B【解析】向CuSO4溶液中加入过量氨水发生的反应是CuSO4+2NH3·H2O===Cu(OH)2↓+(NH4)2SO4;Cu(OH)2+2NH3·H2O+(NH4)2SO4 ===[Cu(NH3)4]SO4+4H2O,A错误,B正确;由于[Cu(NH3)4]SO4在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C错误;在[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3给出孤电子对,D错误。
下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )A.配体为水分子,配位原子为O,外界为Br-B.中心离子的配位数为6C.中心离子Cr3+采取sp3杂化D.中心离子的化合价为+2价【答案】B【解析】[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
冠醚能与阳离子,尤其是与碱金属离子作用,并且随环的大小不同而与不同的金属离子作用。12冠4与锂离子作用而不与钠离子、钾离子作用;18冠6与钾离子作用(如图),还可与重氮盐作用,但不与锂离子或钠离子作用。下列说法错误的是( )
A.18冠6中C和O的杂化轨道类型相同B.18冠6与钾离子作用,不与锂离子或钠离子作用,这反映了超分子的“分子识别”的特征C.18冠6与钾离子作用反映了超分子的自组装的特征D.冠醚与碱金属离子作用的原理与其可作相转移催化剂的原理有关【答案】C
【解析】18冠6中C和O都是sp3杂化,A正确;与钾离子作用,不与锂离子或钠离子作用,反映了超分子的“分子识别”的特征并没有反映其自组装特征,B正确,C错误;由于冠醚是皇冠状分子,可有不同大小的空穴适配不同大小的碱金属离子,把无机物带入有机物中,它可以作为相转移催化剂也是基于这个原理,D正确。
下列关于超分子的叙述中正确的是( )A.超分子就是高分子B.超分子都是无限伸展的C.形成超分子的微粒都是分子D.超分子具有分子识别和自组装的特征【答案】D
【解析】有些超分子不是高分子,有些超分子是高分子,A错误;超分子这种分子聚集体有的是有限的,有的是无限伸展的,B错误;形成超分子的微粒也包括离子,C错误;超分子的特征是分子识别和自组装,D正确。
【名师点拨】(1)离子的配位数一般是其化合价的2倍。(2)配位化合物的外界可以电离,但内界中的配位粒子不易电离。(3)配合物的构成。
配位键的判断中易出现的误区例 1 ml C(Ⅲ)的八面体配合物CClm·nNH3与AgNO3溶液作用生成1 ml AgCl沉淀,则m、n的值是( )A.m=1,n=5B.m=3,n=4C.m=5,n=1D.m=4,n=5错解:A或C或D
错因分析:因为直接数除钴原子外的原子数,而错误选A、C、D;实际上C(Ⅲ)的八面体配合物CClm·nNH3呈电中性,因为NH3为分子,所以m的值为3,而1 ml该配合物与AgNO3溶液作用生成1 ml AgCl沉淀,则其内界中含2个氯离子,又因为该配合物为八面体,所以中心原子的配位数为6,n的值为4,即该配合物的化学式是[CCl2(NH3)4]Cl。
满分策略: 落实确定配合物化学式的基本步骤: 正解:B
1.下列关于配位化合物的叙述中,不正确的是( )A.配位化合物中必定存在配位键B.配位化合物中只有配位键C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物【答案】B
【解析】配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物,C、D均正确。
2.下列组合中,两种配合物中心离子的电荷数和配位数均相同的是( )A.K[Ag(CN)2]、[Cu(NH3)4]SO4B.[Cr(NH3)4Cl2]Cl、[Cu(NH3)4]SO4C.[Ag(NH3)2]Cl、K[Ag(CN)2]D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl【答案】C
【解析】A中两种配合物中心离子的电荷数分别是1+和2+,配位数分别是2和4,A不符合题目要求;B中两种配合物中心离子的电荷数前者是3+,配位数均是6,后者是2+,配位数是4,B不符合题目要求;C中两种配合物中心离子的电荷数均是1+,配位数均是2,C符合题目要求;D中两种配合物中心离子的电荷数分别是2+和1+,配位数分别是4和2,D不符合题目要求。
3.下列关于配位化合物的叙述中,不正确的是( )A.配位化合物中不一定存在配位键B.配位化合物中可能存在离子键C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用【答案】A【解析】配位化合物一定含有配位键,还可能含有一般共价键、离子键等,A错误。
4.用过量硝酸银溶液处理含0.01 ml氯化铬的水溶液,产生0.02 ml AgCl 沉淀,则此氯化铬最可能是( )A.[Cr(H2O)6]Cl3B.[Cr(H2O)5Cl]Cl2·H2OC.[Cr(H2O)4Cl2]Cl·2H2OD.[Cr(H2O)3Cl3]·3H2O【答案】B
5.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。(1)[Cu(NH3)4]2+中存在的化学键类型有______(填字母)。 A.配位键B.极性共价键C.非极性共价键D.离子键(2)[Cu(NH3)4]2+具有对称的空间结构,[Cu(NH3)4]2+中的两个NH3分子被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为______________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2―→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。 【答案】(1)AB (2)平面正方形 (3)sp2
【解析】 (1)[Cu(NH3)4]2+由铜离子与氨分子通过配位键形成,氨分子内部的化学键是极性共价键。(2)[Cu(NH3)2Cl2]有两种不同的结构,可知[Cu(NH3)4]2+的空间结构是平面正方形。(3)HOCH2CH=CH2中的C原子,有一个采取sp3杂化,两个采取sp2杂化;CH3CH2CHO中的C原子有两个采取sp3杂化,一个采取sp2杂化。
相关课件
这是一份2024年高考化学一轮复习课件(鲁科版)第5章 第30讲 分子的性质 配合物与超分子,文件包含第5章第30讲分子的性质配合物与超分子pptx、第5章第30练分子的性质配合物与超分子docx、第5章第30讲分子的性质配合物与超分子docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子优秀课件ppt,共32页。PPT课件主要包含了空轨道,孤电子对,sp2等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子完美版ppt课件,共57页。PPT课件主要包含了孤电子对,空轨道,配位键,蓝色沉淀,深蓝色晶体,分子间,分子识别,自组装等内容,欢迎下载使用。











