
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量导学案
展开
这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量导学案,共14页。学案主要包含了物质的量浓度的基本概念,公式的简单计算,物质的量浓度与溶质的质量分数,溶液的稀释公式等内容,欢迎下载使用。
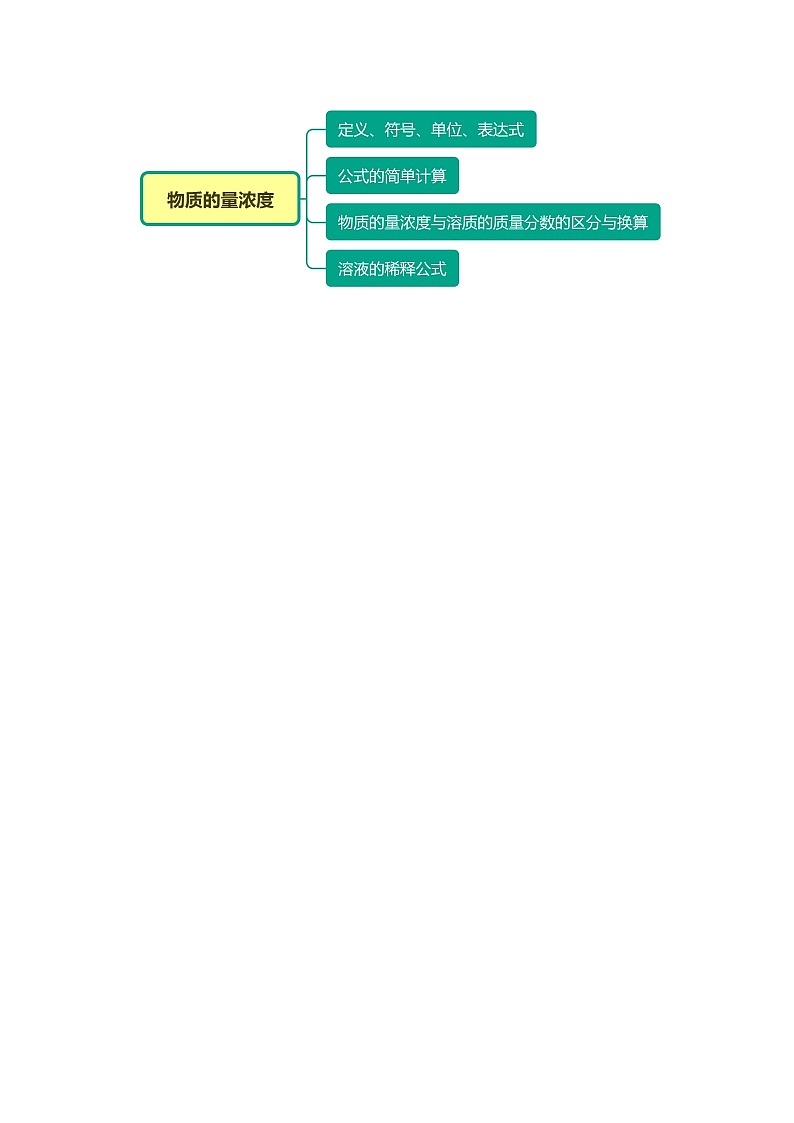
一、物质的量浓度的基本概念1. 定义:单位体积溶液里所含溶质B的物质的量,叫做B的物质的量浓度2. 符号:_______________;3. 单位:_______________;4. 表达式:_____________。 二、公式的简单计算cB = → nB = cB×V → V = cBnV1 mol/L0.5 mol 3 mol/L 0.2 L 1 mol500 mL 三、物质的量浓度与溶质的质量分数物理量物质的量浓度溶质的质量分数定义表示单位体积溶液里所含溶质B的物质的量溶液里溶质质量与溶液质量的比值表达式cB = ω(B)= ×100% 单位mol·L-11转化关系cB = mol·L-1 四、溶液的稀释公式溶液稀释时溶质的物质的量不变,即c1V1 = c2V2。(c1、c2为稀释前后溶液的物质的量浓度,V1、V2为稀释前后溶液的体积)举个例子 题型一:物质的量浓度的概念与基础计算【例1】(2021·沭阳县修远中学高一月考)下列溶液中溶质的物质的量浓度为1 mol·L—1的是A.将40 g NaOH溶解于1 L水中配成NaOH溶液B.常温常压下,将22.4 L HCl气体溶于水配成1 L的盐酸C.将1 L 0.5 mol·L-1的盐酸加热浓缩为0.5 LD.从1 000 mL 1 mol·L-1的NaCl溶液中取出100 mL的溶液 【变2-1】(2021·浙江高一月考)下列溶液中的c(Cl-)与550mL 1mol·L-1FeCl3,溶液中的c(Cl-)相等的是A.150mL 1mol·L-1NaCl溶液 B.50mL 1mol·L-1NH4Cl溶液C.150mL 3mol·L-1KCl溶液 D.100mL 1mol·L-1BaCl2溶液 题型二:溶液呈电中性的计算【例3】(2021·普宁市大长陇中学高三月考)已知某溶液中c(Na+)=0.2mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4mol/L,如果溶液中还有SO,那么c(SO)应为A.0.1 mol/L B.0.15molL C.0.3 mol/L D.0.5mol/L 题型三:溶液的稀释/混合计算【变4-1】(2021·邓州市第一高级中学校高一月考)将5的溶液a mL稀释至b mL,稀释后溶液中的物质的量浓度为A.5a/b B.b/5a C.10a/b D.a/b 题型四:物质的量浓度与质量分数的换算【例5】(2021·黑龙江齐齐哈尔·高二期末)实验室需要的硫酸溶液,现用市售98%浓硫酸(密度为)配制,用量筒取用的浓硫酸体积最适宜的是A. B. C. D. 【例7】(2020·浙江绍兴·高一月考)Na2CO3和NaOH的混合液100mL,先向其中滴加Ba(OH)2溶液至不产生沉淀为止,再向其中滴加稀盐酸至沉淀消失,产生的沉淀的质量与消耗盐酸的体积如图所示:(1)原混合液中Na2CO3的物质的量浓度为______。(2)原混合液中Na2CO3与NaOH的物质的量比为______。 【题1】(2021·全国高一课时练习)下列溶液中的与200mL 1 mol·L-1硝酸钡溶液中的相同的是A.200mL 1 mol·L-1的硝酸钠溶液 B.100mL 1.5 mol·L-1的硝酸镁溶液C.200mL 0.5 mol·L-1的硝酸铝溶液 D.100mL 2 mol·L-1的硝酸钾溶液 【题2】(2021·宁夏沙坡头·中卫一中高一月考)下列叙述正确的是A.1L水中溶解了40gNaOH后,所得溶液浓度为1mol·L-1B.从1L2mol·L-1的NaCl溶液中取出0.5L,该溶液的浓度为1mol·L-1C.配制1L0.1mol·L-1的CuSO4溶液,需用16g胆矾D.将2.24L(标准状况)HCl气体溶于水制成100mL溶液,其物质的量浓度为1mol·L-1 【题3】(2021·临朐县实验中学高一月考)下列说法中正确的是A.将322gNa2SO4·10H2O溶于1L水中,所得溶液的物质的量浓度为1mol·L-1B.将1L2mol·L-1硫酸溶液加水稀释到2L,所得溶液的物质的量浓度为1mol·L-1C.将1L18.4mol·L-1硫酸溶液加入到1L水中,所得溶液物质的量浓度为9.2mol·L-1D.将336mL氯化氢溶于水,配成300mL溶液,所得溶液物质的量浓度为0.05mol·L-1 【题4】(2020·浙江高一期中)已知稀溶液有依数性,即单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高。则下列溶液沸点最高的是A.0.2mol·L-1NaCl溶液 B.0.2mol·L-1NH3·H2O溶液C.0.1mol·L-1BaCl2溶液 D.0.1mol·L-1蔗糖溶液 【题5】(2020·南昌市新建区第二中学高二期末)下列关于物质的量浓度表述正确的是A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO的总物质的量为0.9 molB.50mL 1mol·L-1的KCl溶液和100mL 0.25 mol·L-1MgCl2溶液中,Cl-物质的量浓度相等C.将10 mL 1 mol·L-1的H2SO4稀释成0.1 mol·L-1的H2SO4,可向其中加入100 mL水D.含NA个Na+的Na2O溶于水配成1 L溶液,Na+的物质的量浓度为1 mol·L-1 【题6】(2021·吉林延吉·延边二中高二月考)标准状况下,VL NH3溶解在1L水中(水的密度近似为1g∙mL−1),所得溶液密度为ρg∙mL−1,溶质质量分数为ω,物质的量浓度为c mol∙L−1,则下列关系中不正确的是A.ω= B.ω=C.c= D.ρ= 【题7】(2021·陕西长安一中高一月考)某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是A.饱和溶液中溶质的质量分数为:%B.饱和溶液的物质的量浓度为:mol/LC.饱和溶液的体积为:LD.25℃时,A的溶解度为:g 【题8】(2021·南岗·黑龙江实验中学高三开学考试)如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是硫酸化学纯(CP)(500mL)品名:硫酸化学式:相对分子质量:98密度:质量分数:98%A.该硫酸的物质的量浓度为9.2mol/LB.该硫酸与等体积的水混合所得溶液的质量分数为49%C.配制250mL4.6mol/L的稀硫酸需取该硫酸62.5mLD.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L 【练1】(2021·江苏高一月考)与50 mL1 mol/L MgCl2溶液中的Cl-的物质的量浓度相等的是A.150mL 1 mol/L 的NaCl溶液B.75mL 0.5 mol/L 的CaCl2溶液C.50mL2 mol/L 的KCl溶液D.75mL1 mol/L 的FeCl3溶液 【练2】(2020·福建省漳平第一中学高一期中)下列操作所得溶液的物质的量浓度为1mol/L的是A.100mL水中溶解0.1molHCl气体 B.100g水中溶解4gNaOHC.将5.85gNaCl溶于水中得到100mL溶液 D.从500mL10mol/L稀盐酸中,取出50mL 【练3】(2021·江苏高一月考)下列关于物质的量浓度表述正确的是A.0.2 mol/L Na2SO4溶液中含有Na+和SO总物质的量为0.6 molB.将62g Na2O溶于水中,配成1L溶液,所得溶质的物质的量浓度为1 mol/LC.用1 L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1 mol/LD.10g 98%的硫酸(密度为1.84gcm-3)与10ml 18.4 mol/L的硫酸浓度相等 【练4】(2021·江苏苏州·高一月考)某溶液中仅含有Na+、Mg2+、SO、Cl-四种离子其物质的量浓度之比为c(Na+):c(Mg2+):c(Cl-)=3:5:5,若Na+浓度为3mol·L-1。则SO的浓度为A.2mol·L-1 B.3mol·L-1 C.4mol·L-1 D.8mol·L-1 【练5】(2021·江苏昆山·周市高级中学高一月考)向等体积等浓度的AgNO3溶液中,分别滴加NaCl、MgCl2、AlCl3溶液,均恰好完全生成沉淀。则NaCl、MgCl2、AlCl3的物质的量之比为A.1:2:3 B.3:2:1C.6:3:2 D.9:3:1 【练6】(2019·罗平县第二中学高一期末)500mL的KAl(SO4)2溶液中含有3.9g的K+,则该溶液中c(Al3+)为A.1mol/L B.0.4mol/L C.0.2mol/L D.0.1mol/L 【练7】(2021·全国高一课时练习)浓度均为0.1mol•L-1的KCl、CaCl2溶液等体积混合,下列说法错误的是A.混合前CaCl2溶液中c(Cl-)=0.2mol•L-1B.混合前KCl、CaCl2溶液中c(Cl-)之比为1∶2C.混合前后K+、Ca2+的物质的量不变D.混合溶液中c(Cl-)=0.3mol•L-1 【练8】(2020·浙江高一期末)对1L1mol•L-1氯化镁溶液的理解,不正确的是A.95g无水氯化镁溶于1L水中即可得到上述溶液B.该溶液中含有95g溶质C.该溶液中氯离子的物质的量浓度为2mol•L-1D.从该溶液中取出100mL,其物质的量浓度为1mol•L-1
相关学案
这是一份高中化学人教版 (2019)必修 第一册第三节 化学键学案设计,共12页。学案主要包含了NaCl的形成过程,离子键,离子化合物,电子式等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量导学案,共13页。学案主要包含了化学方程式计算的基础,根据化学方程式计算的一般步骤,实例分析等内容,欢迎下载使用。
这是一份化学第三节 物质的量导学案,共19页。学案主要包含了容量瓶,溶液的配制步骤等内容,欢迎下载使用。










