

所属成套资源:各地区2020-2022三年高一化学下学期期末试题按题型汇编
河南省郑州市2020-2022三年高一化学下学期期末试题汇编3-非选择题
展开
这是一份河南省郑州市2020-2022三年高一化学下学期期末试题汇编3-非选择题,共21页。试卷主要包含了t2,Fe3等内容,欢迎下载使用。
河南省郑州市2020-2022三年高一化学下学期期末试题汇编3-非选择题
1. (2020春·河南郑州·高一统考期末)下表是A、B、C三种有机物的相关信息:
A
①能使溴的四氯化碳溶液褪色;②填充模型为:
B
①可以从煤干馏生成的煤焦油中提取;②填充模型为:
C
工业生产中可通过A与H2O加成获得;②相对分子质量为46
请结合上述信息,回答下列问题:
(1)有机物A的结构式为___________
(2)B与浓硝酸在一定条件下发生反应的化学方程式为__________
(3)有机物C的结构简式为__________。
(4)①C与乙酸反应的化学方程式为____________
②C在铜催化和加热条件下,与O2反应的化学方程式为___________。
2. (2020春·河南郑州·高一统考期末)下表是元素周期表短周期的一部分,请参照元素①~⑨在表中的位置,回答下列问题。
(1)元素②在周期表中的位置是______________。
(2)元素⑤和⑨形成的化合物的电子式为__________________。
(3)元素④、⑤、⑥形成的简单离子的半径依次__________________(填“增大”“减小”或“不变”)。
(4)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是_____________(填化学式)。
(5)元素⑥形成的单质可与⑤的最高价氧化物对应的水化物发生反应,其反应的离子方程式为___________
(6)在一定条件下,①与③可形成一种化合物X,其相对分子质量与O2相同,且X可在纯氧中燃烧,所得产物对环境均无污染,则X燃烧的化学方程式为________________
3. (2020春·河南郑州·高一统考期末)某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。根据图中数据填空:
(1)该反应的化学方程式为__________________
(2)反应开始至2min末,以气体X表示的平均反应速率为___________;反应开始时与反应达平衡状态时的压强之比为______________
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中(X)=9mol·L-1·min-1,乙中(Y)=6mol·L-1·min-1,则反应________更快。
(4)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是________
①混合气体的压强不再变化 ②混合气体的密度不再变化 ③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化 ⑤(X) :(Y)=3:1
A.①②⑤ B.①③④ C.②③④ D.③④⑤
4. (2022春·河南郑州·高一统考期末)人们常常利用化学反应将化学能转化为热能、电能等其他形式的能量,用于生产、生活和科研。请回答下列问题:
(1)下图表示氢气燃烧生成水蒸气的物质及能量变化。已知1mol氢气完全燃烧生成水蒸气时放出热量245kJ。
则图中x为_______。
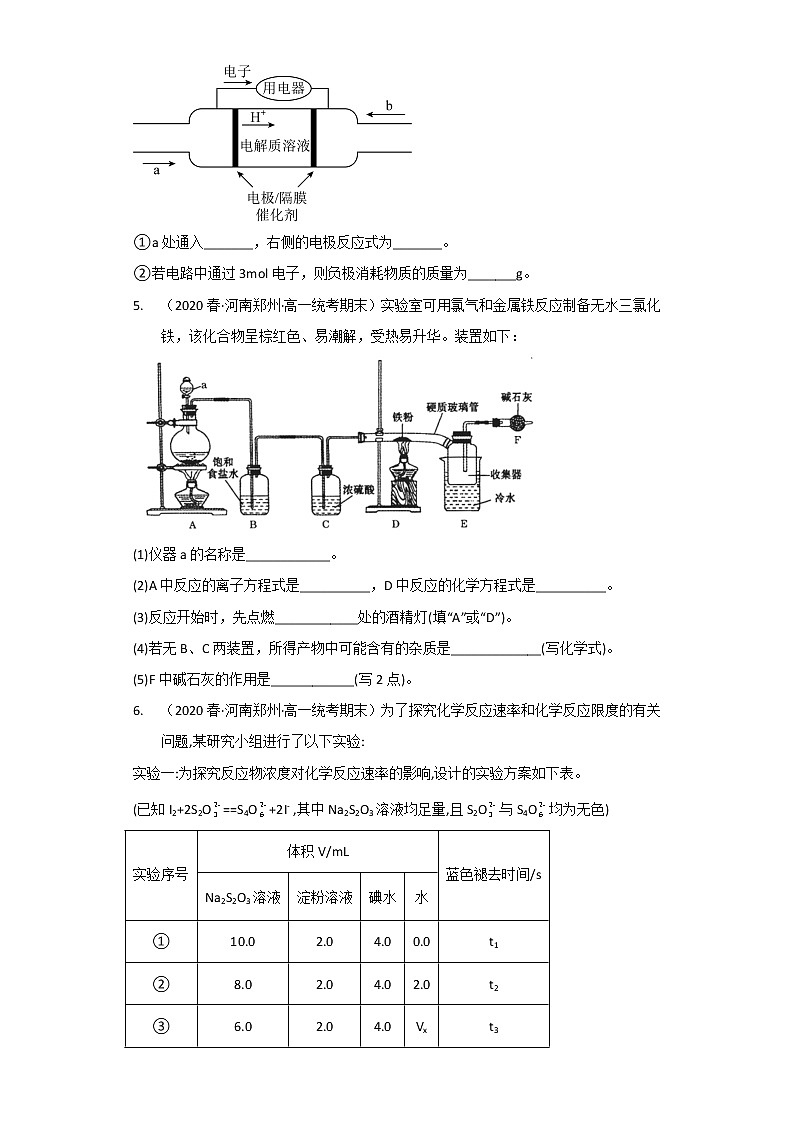
(2)为实现低碳环保的目标,北京冬奥会各赛区推广使用氢氧燃料电池汽车。某种氢氧燃料电池的内部结构示意图如下。
①a处通入_______,右侧的电极反应式为_______。
②若电路中通过3mol电子,则负极消耗物质的质量为_______g。
5. (2020春·河南郑州·高一统考期末)实验室可用氯气和金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,受热易升华。装置如下:
(1)仪器a的名称是____________。
(2)A中反应的离子方程式是__________,D中反应的化学方程式是__________。
(3)反应开始时,先点燃____________处的酒精灯(填“A”或“D”)。
(4)若无B、C两装置,所得产物中可能含有的杂质是_____________(写化学式)。
(5)F中碱石灰的作用是____________(写2点)。
6. (2020春·河南郑州·高一统考期末)为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O==S4O+2I- ,其中Na2S2O3溶液均足量,且S2O与S4O均为无色)
实验序号
体积V/mL
蓝色褪去时间/s
Na2S2O3溶液
淀粉溶液
碘水
水
①
10.0
2.0
4.0
0.0
t1
②
8.0
2.0
4.0
2.0
t2
③
6.0
2.0
4.0
Vx
t3
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。
7. (2021春·河南郑州·高一统考期末)氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和,制备装置如图所示(部分加持仪器略去),并研究的氧化性。已知:氯气与碱反应,温度较高时生成,温度较低时生成。
(1)盛装浓盐酸的仪器名称是_______。
(2)装置A烧瓶中反应的化学方程式为_______。
(3)装置C中与试剂a反应的离子方程式为_______。
(4)如果缺少装置B,对制取NaClO和的影响是_______。
(5)E中可选用试剂有_______(填标号)。
A.饱和溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
(6)该小组在探究氧化性时,发现与的反应速率先增大后减小,反应为。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究对化学反应速率的影响,设计如下实验:
实验序号
温度
盐酸
①
25℃
10mL
10mL
0mL
1mL
②
25℃
10mL
10mL
1mL
0mL
该实验_______(填“能”或“不能”)达到实验目的,理由是_______。
8. (2022春·河南郑州·高一统考期末)某兴趣小组利用下图装置,制备少量的溴苯并探究其反应类型。
请回答下列问题:
(1)先向分液漏斗中加入苯和液溴,再将苯和液溴的混合液缓慢滴入反应器A中(A下端活塞处于关闭状态),则A中反应的化学方程式为_______。
(2)通过以下步骤可获取较纯净的溴苯:
①反应结束后打开A下端的活塞,让反应液流入B中;
②充分反应后,将B中液体转移至分液漏斗中,振荡、静置并分液;
③向有机层中加入蒸馏水洗涤,振荡、静置并分液;
④向有机层中加入无水粉末干燥并过滤;
⑤对滤液进行操作1获取较纯净的溴苯。
B中发生的氧化还原反应的离子方程式为_______,步骤⑤中操作1的名称为_______。
(3)若要证明苯和液溴的反应为取代反应,则C中盛放的作用是_______,请设计后续实验方案证明苯和液溴的反应为取代反应_______。
9. (2022春·河南郑州·高一统考期末)某化学兴趣小组依据反应,探究影响化学反应速率的因素并测定其化学反应速率。请回答下列问题:
I.该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如下表所示。
实验编号
加入溶液的体积/mL
加入溶液的体积/mL
加入水的体积/mL
反应温度
1
10
10
0
25℃
2
10
5
a
25℃
3
10
10
0
60℃
(1)表中a=_______,通过实验1和实验3可探究_______对化学反应速率的影响。
II.该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如下图所示。
(2)该反应在0~4min的化学反应速率为_______。
(3)分析实验数据发现,反应过程中该反应的化学反应速率先增大后减小。
i.探究化学反应速率先增大的原因,具体情况如下表所示。
方案
假设
实验操作
1
该反应放热,使溶液温度升高,化学反应速率加快
向烧杯中加入10mL溶液和10mL溶液,_______
2
_______
取10mL溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL溶液。
①补全方案1中的实验操作_______。
②方案2中的假设为_______。
③除方案1、2中的假设外,还可提出的假设是_______。
ii.反应后期化学反应速率减小的原因是_______。
10. (2021春·河南郑州·高一统考期末)烃A的产量可以衡量一个国家石油化工发展水平。以A为原料,制备乙酸乙酯的路线如图所示(部分无机试剂略去):
(1)A→B的化学方程式为_______,其反应类型为_______。
(2)环氧乙烷()可用于口罩灭菌。A、B、C、D四种有机物中,与环氧乙烷互为同分异构体的是_______(填结构简式)。
(3)实验室由B和D制备乙酸乙酯的装置如图所示。
①向试管中加入B、D、浓硫酸的操作是_______。
②该制备反应的化学方程式为_______。
③饱和溶液的作用除了吸收B和D,还有_______。
11. (2022春·河南郑州·高一统考期末)有机物A~E之间存在如下图所示的转化关系。A的产量是衡量一个国家石油化工产业发展水平的标志。
请回答下列问题:
(1)写出A的一种同系物的结构简式_______。
(2)A→B的化学反应类型为_______,D中官能团的名称为_______。
(3)B→C的化学方程式为_______。
(4)石蜡的分解不仅可获得A,还可以得到一种相对分子质量为86的烷烃。写出该烷烃主链碳原子数为4的所有同分异构体的结构简式_______。
(5)某化学兴趣小组在实验室利用如图所示装置实现B和D制备E的反应。
①写出甲中反应的化学方程式_______。
②试管甲中使用碎瓷片的目的是_______,试管乙中的试剂F为_______。
12. (2021春·河南郑州·高一统考期末)短周期元素A、B、C,D、E的原子序数依次增大,它们的相关信息如表所示:
序号
相关信息
①
A的最高正价与最低负价的绝对值相差2
②
B的一种核素的质量数为18,中子数为10
③
所有短周期主族元素原子中,C的原子半径最大
④
A、C、D的最高价氧化物对应的水化物两两之间均可反应
⑤
E的单质与甲烷在光照条件下可以发生取代反应
(1)简单气态氢化物:沸点A_______B(填“>”或“D,其理由是_______。
13. (2022春·河南郑州·高一统考期末)下图是元素周期表的一部分,请回答下列问题:
(1)j元素在元素周期表中的位置为_______。
(2)f、h的最高价氧化物对应水化物相互反应的离子方程式为_______(用元素符号作答,下同)。
(3)用电子式表示的形成过程_______。
(4)a、b、c、d形成的盐中含有的化学键类型为_______。
(5)d、g的简单氢化物的稳定性较弱的是_______(填化学式)。
14. (2021春·河南郑州·高一统考期末)和是氮的两种重要氧化物。100℃时,在2L密闭容器中发生反应,各气体浓度随时间变化的情况如图所示。
(1)代表气体浓度随时间变化的曲线为_______(填序号)。
(2)当的浓度为时,反应时间为ts,则0~t s时,用气体的浓度变化量表达该反应的平均速率为_______。
(3)反应达到平衡状态时,_______。
(4)已知与发生可逆反应:(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入和充分反应,下列说法正确的是_____
A.只要经过足够长的时间,可使
B.每消耗,同时生成,说明该反应达到平衡状态
C.达到平衡状态时,各物质的物质的量浓度相等
D.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
15. (2021春·河南郑州·高一统考期末)氢气因燃值高、燃烧产物无污染,被公认为清洁能源。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为_______。
(2)金属锂是一种重要的储氢材料,吸氢和放氢原理为:
Ⅰ.
Ⅱ.
一定条件下,金属锂每吸收标准状况下,最多可以释放出_______L(标准状况下)。
(3)已知完全燃烧生成,放出245kJ能量。根据如图信息,计算a=_______。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,图为氢氧燃料电池的示意图。
①在导线中电子流动方向为_______(用a、b表示)。
②电极表面镀一层细小的铂粉,其目的是_______。
③该电池的负极反应式为,请写出正极反应式_______。
④假设该电池每发1度电(1度)能生成450g水蒸气,则该电池的能量转化率为_______
参考答案:
1. +HO-NO2 +H2O C2H5OH CH3COOH +HOCH2CH3CH3COOCH2CH3+ H2O 2CH3CH2OH + O22CH3CHO + 2H2O
【分析】A能使溴的四氯化碳溶液褪色,结合其填充模型可知应含有碳碳双键,A为CH2=CH2;B可以可以从煤干馏生成的煤焦油中提取,结合其填充模型可知为苯;C可通过A与H2O加成获得,相对分子质量为46,所以C为CH3CH2OH。
【详解】(1)A为乙烯,其结构式为;
(2)苯与浓硝酸在浓硫酸、加热(50℃~60℃)的条件下发生取代反应生成硝基苯和水,化学方程式为+HO-NO2 +H2O;
(3)C为乙醇,结构简式为C2H5OH;
(4)①乙醇和乙酸在浓硫酸加热的条件下可以发生酯化反应生成乙酸乙酯,化学方程式为CH3COOH +HOCH2CH3CH3COOCH2CH3+ H2O;
②C在铜催化和加热条件下被氧气氧化成乙醛,化学方程式为2CH3CH2OH + O22CH3CHO + 2H2O。
2. 第二周期IVA族 减小 HNO3>H2CO3>H4SiO4 2Al+ 2OHˉ+ 6H2O==2[Al(OH)4]ˉ+ 3H2↑ N2H4+ O2N2+ 2H2O
【分析】根据各元素在元素周期表中的位置可知①~⑨分别为H、C、N、O、Na、Al、Si、P、S、Cl。
【详解】(1)元素②为C元素,位于元素周期表第二周期IVA族;
(2)⑤为Na,⑨为Cl,二者形成离子化合物NaCl,电子式为;
(3)元素④、⑤、⑥形成的简单离子分别为O2-、Na+、Al3+,三种离子电子层数相同,则核电荷数越小半径越大,所以离子半径O2->Na+>Al3+,即简单离子半径依次减小;
(4)元素②、③、⑦分别为C、N、Si,同周期主族元素非金属性自左至右非金属性减弱,同主族自上而下非金属性减弱,所以非金属性N>C>Si,非金属性越强,最高价氧化物的水化物的酸性越强,所以酸性:HNO3>H2CO3>H4SiO4;
(5)元素⑥为Al,⑤为Na,其最高价氧化物的水化物为NaOH,铝单质可以和NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为2Al+ 2OHˉ+ 6H2O==2[Al(OH)4]ˉ+ 3H2↑;
(6)元素①为H,③为N,二者形成相对分子质量与O2相同的物质,应为N2H4,在纯氧中燃烧产物无污染,应为N2和H2O,根据元素守恒可得化学方程式为N2H4+ O2N2+ 2H2O。
3. 3X+Y2Z 0.075mol·L-1·min-1 10:9 乙 B
【分析】由图可知,Y、X的物质的量减少,则Y、X为反应物,而Z的物质的量增加,可知Z为生成物,结合,速率之比等于化学计量数之比得到化学方程式,达到平衡时,正逆反应速率相等,且各物质的浓度不变。
【详解】(1)由图可知,Y、X的物质的量减少,则Y、X为反应物,而Z的物质的量增加,可知Z为生成物,,且2min后物质的量不再变化,由速率之比等于化学计量数之比可知反应为3X+Y2Z,故答案为:3X+Y2Z;
(2)反应开始至2min,以气体X表示的平均反应速率为,反应开始时与反应达平衡状态时的压强之比为(1.0+1.0)mol:(0.9+0.7+0.2)mol=10:9,故答案为:0.075mol·L-1·min-1;10:9;
(3)速率之比等于化学计量数之比,速率与化学计量数的比值越大,反应速率越快,,则反应乙的更快,故答案为:乙;
(4)①反应前后气体的体积不等,建立平衡的过程中气体的压强变化,混合气体的压强不再改变的状态,可说明达到平衡状态,故①选;
②该体系为恒容条件,且体系内物质总质量不变,则无论反应是否平衡,混合气体的密度都不变,混合气体的密度不再变化不能说明反应达到平衡状态,故②不选;
③X的百分含量不再变化,说明X的浓度不再发生变化,说明反应达到平衡状态,故③选;
④体系内总质量不变,反应前后气体的体积不等,即前后的物质的量不等,混合气体的平均相对分子质量不再变化,说明物质的量不再变化,能说明反应达到平衡状态,故④选;
故能说明反应达到平衡状态的是①③④,答案选B。
4. (1)930
(2) 3
【详解】(1)断键吸热、成键放热,1mol氢气完全燃烧生成水蒸气时放出热量245kJ,则断裂1mol氢气和0.5mol氧气中的化学键吸收的能量比生成1mol水中的化学键放出的能量小245 kJ,则x=436+249+245=930 kJ。
(2)①由图示可知,电子由a经导线向b移动,a是负极,发生氧化反应,a处通入H2,右侧为正极,正极氧气得电子生成水,电极反应式为O2+4e-+4H+=2H2O。
②负极发生反应H2-2e-=H+,若电路中通过3mol电子,则负极消耗1.5mol氢气,质量为3g。
5. 分液漏斗 A FeCl 2、Fe(OH)3、Fe2O3、Fe3O4(写任一种) 吸收多余的氯气,防止污染环境;防止外界空气中的水蒸气进入E,氯化铁潮解
【分析】用氯气和Fe在加热条件下制取无水氯化铁,无水氯化铁易潮解,受热易升华,所以应该用干燥的氯气和Fe制取无水氯化铁,得到的氯化铁应该冷却,A装置是制取氯气,浓盐酸具有挥发性,加热条件下水蒸发导致得到的氯气中含有HCl、水蒸气,用饱和食盐水除去氯气中的HCl,用浓硫酸干燥氯气,所以从C导出的是干燥氯气;D中发生的反应为,E用于收集FeCl3,F装置干燥空气防止水蒸气进入E而使氯化铁发生水解,同时F还能吸收未反应的氯气,防止污染大气,结合题目分析解答。
【详解】(1)从装置图可知,仪器a的名称是分液漏斗,故答案为:分液漏斗;
(2)A中浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式为,D中是铁粉与氯气在加热的条件下反应,其化学方程式为,故答案为:, ;
(3)为防止Fe和装置中氧气反应而减少氯化铁的生成,应该先用氯气将整个装置中的空气排出,所以先点燃A装置酒精灯,故答案为:A;
(4)若无B、C两装置,即体系中含有HCl和H2O(g),则可能发生的副反应有:、、、,故所得产物中可能含有的杂质是FeCl 2、Fe(OH)3、Fe2O3、Fe3O4,故答案为:FeCl 2、Fe(OH)3、Fe2O3、Fe3O4;
(4)碱石灰具有吸水性,能吸收水蒸气防止空气中的水蒸气进入E装置而使氯化铁发生水解,碱石灰具有碱性,能吸收氯气而防止污染大气,所以碱石灰的作用是:吸收氯气,防止污染环境;防止外界空气中的水蒸气进入E,使氯化铁潮解,故答案为:吸收氯气,防止污染环境;防止外界空气中的水蒸气进入E,使氯化铁潮解。
6. 4 t1
相关试卷
这是一份河南省郑州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共42页。试卷主要包含了0g水杨酸、10,6℃等内容,欢迎下载使用。
这是一份云南昆明市2020-2022三年高一化学下学期期末试题汇编3-非选择题,共21页。试卷主要包含了90,00ml/L-0等内容,欢迎下载使用。
这是一份江苏扬州市2020-2022三年高一化学下学期期末试题汇编3-非选择题,共21页。试卷主要包含了五氧化二氮等等内容,欢迎下载使用。









