

所属成套资源:各地区2020-2022三年高一化学下学期期末试题按题型汇编
山东省日照市2020-2022三年高一化学下学期期末试题汇编2-选择题②
展开
这是一份山东省日照市2020-2022三年高一化学下学期期末试题汇编2-选择题②,共14页。试卷主要包含了0062ml·L-1·s-1等内容,欢迎下载使用。
山东省日照市2020-2022三年高一化学下学期期末试题汇编2-选择题②
1. (2022春·山东日照·高一统考期末)氢有氕、氘、氚三种同位素,通过:+→+,+→+反应可以人工合成氘和氚。下列说法正确的是
A.Y的中子数为8
B.X、Y互为同素异形体
C.产生的反应为化学反应
D.氘和氚具有放射性,不能用于示踪研究化学反应历程
2. (2022春·山东日照·高一统考期末)下列关于常见有机物的说法正确的是
A.等质量的甲烷、乙烯、苯完全燃烧时,消耗氧气最多的是苯
B.乙醇分子中含有3种不同类型的氢原子
C.构成塑料的高分子链若发生交联形成网状结构,则塑料的柔韧性会变好
D.某种硅橡胶()常用作医用高分子材料,该种硅橡胶是化合物
3. (2022春·山东日照·高一统考期末)我国航天事业在世界领先,载人飞船中用到的主要是氢氧燃料电池。下列有关氢氧燃料电池的说法正确的是
A.氢氧燃料电池需要点燃引发才能正常工作
B.若电解质为稀硫酸,正极反应式为O2+2H2O+4e-=4OH-
C.若电解质为氢氧化钠溶液,电池工作时OH-向正极移动
D.电解质为高温熔融碳酸盐时,正极反应物为O2和CO2,可实现碳中和
4. (2022春·山东日照·高一统考期末)下列有关实验的说法错误的是
A.向结有水垢的壶中加入适量食醋,可以除掉水垢
B.在制备溴苯实验中,将反应后的气体直接通入硝酸酸化的AgNO3溶液中,若生成淡黄色沉淀,则证明发生了取代反应
C.除去甲烷中混有的乙烯,可以将混合气体通入盛有足量溴水的洗气瓶中
D.制备乙酸乙酯时,向试管中加入试剂顺序可为:无水乙醇、浓硫酸、冰醋酸
5. (2022春·山东日照·高一统考期末)NA为阿伏加德罗常数。下列说法正确的是
A.在密闭容器中充入2molSO2和1molO2,充分反应后生成2NA个SO3分子
B.标准状况下,11.2LCCl4中含有的原子总数为2.5NA
C.1molD2O中含有8NA个电子
D.26g乙炔在空气中完全燃烧,形成O-H键的数目为2NA
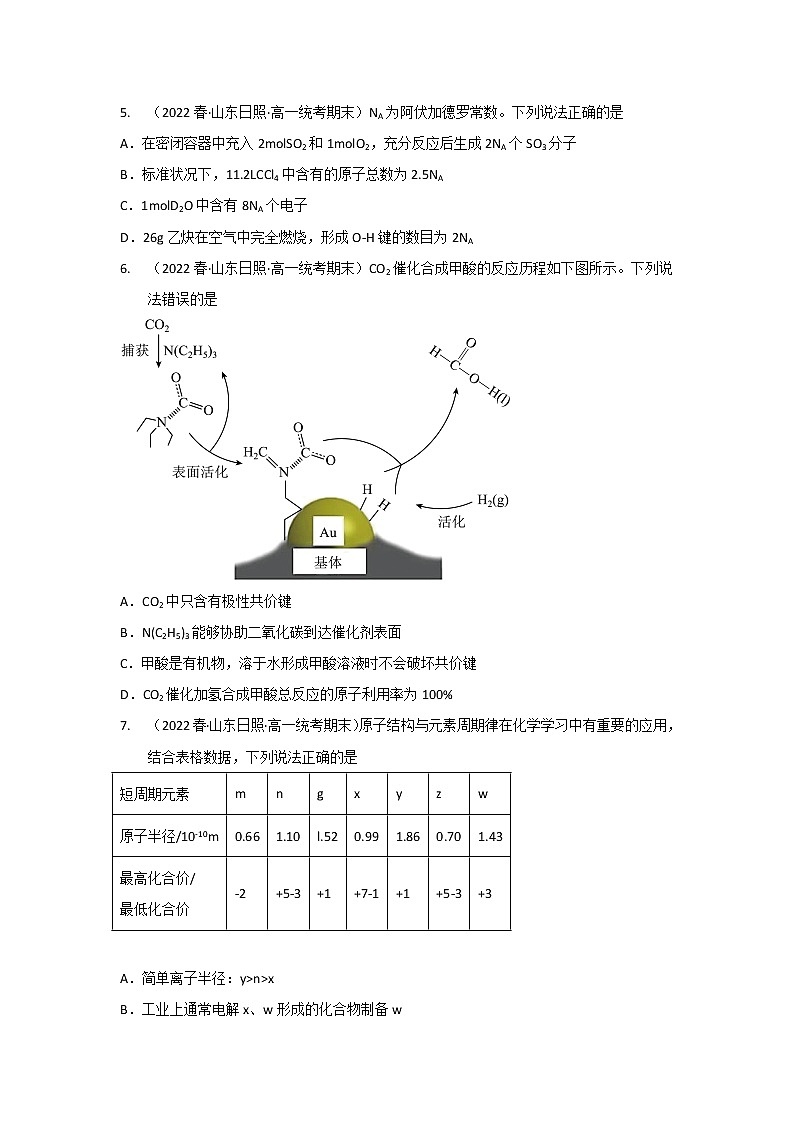
6. (2022春·山东日照·高一统考期末)CO2催化合成甲酸的反应历程如下图所示。下列说法错误的是
A.CO2中只含有极性共价键
B.N(C2H5)3能够协助二氧化碳到达催化剂表面
C.甲酸是有机物,溶于水形成甲酸溶液时不会破坏共价键
D.CO2催化加氢合成甲酸总反应的原子利用率为100%
7. (2022春·山东日照·高一统考期末)原子结构与元素周期律在化学学习中有重要的应用,结合表格数据,下列说法正确的是
短周期元素
m
n
g
x
y
z
w
原子半径/10-10m
0.66
1.10
l.52
0.99
1.86
0.70
1.43
最高化合价/
最低化合价
-2
+5-3
+1
+7-1
+1
+5-3
+3
A.简单离子半径:y>n>x
B.工业上通常电解x、w形成的化合物制备w
C.元素y、z形成的一种化合物是在汽车安全气囊系统中普遍使用的物质之一,受撞击后产生两种氧化物
D.元素x、y、w的最高价氧化物对应水化物能两两发生反应
8. (2022春·山东日照·高一统考期末)CO2催化加氢是化学工业上实现资源再生、改善环境的重要方式之一,其中一种加氢生成低碳烃的过程示意图如下:
下列说法错误的是
A.与b互为同分异构体的物质有4种
B.多功能催化剂可以加快CO2催化加氢速率
C.直馏汽油和裂化汽油都可以用于萃取溴水中的溴
D.反应①的化学方程式为:CO2+H2CO+H2O
9. (2022春·山东日照·高一统考期末)“暖宝宝”具有即时发热、长效保温的优点,深受人们的喜爱。某品牌“暖宝宝”主要成分:铁粉、水、活性炭、食盐等。下列说法正确的是
A.正极反应物为H+
B.负极上的电极反应,每反应1molFe转移3mole-
C.“暖宝宝”能长效保温是因为发生了原电池反应,减缓了反应速率
D.“暖宝宝”使用后变硬,其主要成分为:氯化钠、三氧化二铁、炭粉等固体
10. (2022春·山东日照·高一统考期末)为完成下列各实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)
选项
实验目的
玻璃仪器
试剂
A
配制一定质量分数的CuSO4溶液
烧杯、玻璃棒、容量瓶、胶头滴管
CuSO4·5H2O、蒸馏水
B
检验稀硫酸作用后的淀粉是否水解
试管、胶头滴管、酒精灯
氢氧化钠溶液、硫酸铜溶液
C
利用反萃取原理从碘的四氯化碳溶液中获取碘单质
漏斗、烧杯、玻璃棒、分液漏斗
氢氧化钠溶液
D
除去乙酸乙酯中少量乙醇
分液漏斗、烧杯
氢氧化钠溶液
A.A B.B C.C D.D
11. (2022春·山东日照·高一统考期末)在一定温度下,向容积为1L的密闭容器中通入一定量NO2,发生反应:2NO2(g)⇌N2O4(g) △HW>Y
B.Q的氧化物对应的水化物的酸性比W的强
C.Z的单质是光导纤维的主要成分
D.X的简单氢化物与Q的简单氢化物可以反应生成离子化合物
14. (2020春·山东日照·高一统考期末)已知:①2K2CrO4+H2SO4= K2Cr2O7+ K2SO4+H2O
②Fe2(SO4)3+2HI=2FeSO4+I2+ H2SO4
③K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+ K2SO4+7H2O
下列结论错误的是
A.K2CrO4转化为K2Cr2O7属于氧化还原反应
B.氧化性强弱顺序是: K2Cr2O7>Fe2(SO4)3>I2.
C.反应②中,每有l molI2生成,转移电子数为2NA
D.反应③中氧化产物与还原产物的物质的量之比为1:3
15. (2021春·山东日照·高一校联考期末)为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①;②。下列说法错误的是
A.反应①中Se被氧化
B.反应②中KI是还原剂,HNO3是氧化剂
C.反应②中,SeO2发生氧化反应
D.还原性由强到弱的顺序:
16. (2021春·山东日照·高一校联考期末)K-O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是
A.隔膜允许K+通过,不允许O2通过
B.有机电解质2可用水溶液代替
C.放电时,a极的电极反应式为:
D.放电时,电子由b电极沿导线流向a电极;充电时,b电极为阳极
17. (2021春·山东日照·高一校联考期末)反应经历两步:①;②。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
A.曲线c为c(Y)随t的变化曲线
B.0~t1时间段内,反应速率
C.t2时,Y的消耗速率大于生成速率
D.t3后,
18. (2022春·山东日照·高一统考期末)在有机化学反应中Diels-Alder反应常用于构建六元环,环戊二烯与丙烯酸甲酯发生Diels-Alder反应方程式如下:
下列说法正确的是
A.环戊二烯中所有原子共平面
B.Diels-Alder反应属于加成反应
C.该反应产物的分子式为C9H12O18O
D.产物在一定条件下与H2O发生水解反应可生成CH3OH和
19. (2022春·山东日照·高一统考期末)物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,实验室中常用CS2洗涤残留在试管壁上的N单质。下列说法正确的是
A.X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应
B.实验室中用CS2洗涤残留在试管壁上的N单质,利用了N单质的还原性
C.Z的氢化物的沸点一定大于Y的氢化物的沸点
D.化合物W常用作氧化剂,不宜在高温下使用
20. (2022春·山东日照·高一统考期末)一种电解法处理含有的酸性废水的工作原理如下图所示,阴极和阳极之间用浸有NaCl溶液的多孔无纺布分隔。阳极材料为石墨,阴极材料中含有铁的化合物,H表示氢原子。下列说法正确的是
A.Fe(III)起催化剂的作用
B.阳极的电极反应为:Fe-2e-=Fe2+
C.H原子与转化为的过程中有H+的参与
D.HClO氧化的反应方程式为:2+3HClO+5OH-=N2+3Cl-+8H2O
参考答案:
1. A
【详解】A.依据质子数、中子数守恒的原则,m=8+1-2=7,n=16+3-4=15,Y的中子数为15-7=8,A正确;
B.X中,a=8+1-2=7,b=16+2-4=14,X为、Y为,二者互为同位素,B不正确;
C.产生的反应中,原子核发生了改变,不属于化学反应,C不正确;
D.氘和氚具有放射性,可通过测定物质中的含量,用于示踪研究化学反应历程,D不正确;
故选A。
2. B
【详解】A.等质量的甲烷、乙烯、苯完全燃烧耗氧量取决于H元素的含量,H元素含量越高,耗氧量越多,根据CxHy中y/x值判断,该值越大耗氧量越多:甲烷CH4,乙烯C2H4最简式为为CH2,苯C6H6的最简式为CH,甲烷中H元素质量分数最大,所以甲烷CH4耗氧量最大,A错误;
B.乙醇的结构简式为CH3CH2OH,不存在对称结构,故乙醇分子中含有3种不同类型的氢原子,B正确;
C.构成塑料的高分子链若发生交联形成网状结构,则塑料的柔韧性会变差,C错误;
D.硅橡胶是混合物,不属于化合物,D错误;
故选B。
3. D
【详解】A.氢氧燃料电池是将化学能直接转化为电能的装置,不需要点燃,A项错误;
B.若电解质为稀硫酸,正极发生还原反应,电极反应式为:,B项错误;
C.若电解质为氢氧化钠溶液,电池工作时阴离子向负极发生移动,即电池工作时OH-向负极移动,C项错误;
D.电解质为高温熔融碳酸盐时,负极发生反应:2H2+2-4e-=2H2O+2CO2,正极发生的反应为:O2+2CO2+4e-=2,转移电子数相同的情况下生成和消耗的二氧化碳相等,可以实现碳中和,D项正确;
答案选D。
4. B
【详解】A.水垢的主要成分是碳酸钙和氢氧化镁,醋酸能和碳酸钙、氢氧化镁反应生成可溶性的醋酸盐,A正确;
B.要证明苯与液溴在Fe催化下发生取代反应,必须证明产生了HBr,通入硝酸酸化的AgNO3溶液中,产生淡黄色沉淀的气体可能是挥发出来的溴蒸气,不一定是HBr,所以不能证明苯与液溴在Fe催化下发生取代反应,B错误;
C.乙烯可用溴水发生加成反应,可用于除去乙烯,C正确;
D.制备乙酸乙酯时,向乙醇缓慢加入浓硫酸,再加入乙酸,D正确;
故选B。
5. D
【详解】A.SO2与O2的反应是可逆反应,无法计算反应后生成的SO3分子数,A错误;
B.标准状况下,CCl4是液体,无法计算11.2L CCl4中含有的原子总数,B错误;
C.一个D2O分子中含有10个电子,故1mol D2O中含有10mol电子,即10NA个电子,C错误;
D.乙炔在空气中完全燃烧的反应方程式,一个H2O分子含有2个O-H键,26g乙炔物质的量为1mol,完全燃烧可生成1mol H2O,形成2mol的O-H键,即2NA的O-H键,D正确;
故选D。
6. C
【详解】A.由二氧化碳的结构O=C=O,可知CO2中只含有极性共价键,A正确;
B.由图中信息可知N(C2H5)3能捕获二氧化碳,达到催化剂表面,能够协助二氧化碳到达催化剂表面,B正确;
C.甲酸溶于水时,会电离出甲酸根离子和氢离子,羧基中的O-H断裂,C错误;
D.CO2+H2HCOOH,属于化合反应,反应物全部转化为目标产物,总反应的原子利用率为100%,D正确;
故选C。
7. D
【分析】短周期元素中,m只有-2价,没有正化合价,则m为O元素;g、y都有最高正化合价+1,处于IA族,且y的原子半径较大,g的原子半径不是所有元素中最小,故g为Li、y为Na; x元素有最高价+7,最低价-1,故x为Cl元素;n、z元素都有最高价+5、最低价-3,处于VA族,且n的原子半径较大,则z为N元素、n为P元素;w有+3价,处于ⅢA半径仅小于Li,w为Al,以此来解析;
【详解】由上述分析可知,m为O,n为P,g为Li,x为Cl,y为Na,z为N,w为Al:
A.电子层越多离子半径越大,电子层结构相同时,核电荷数越大离子半径越小,则简单离子半径:n(P3-)>x(Cl-)>y(Na+),A错误;
B.氯化铝是共价化合物,熔融状态下不导电,铝的制取采用电解熔融的氧化铝,B错误;
C.元素Na、N形成的一种化合物为Na3N是在汽车安全气囊系统中普遍使用的物质之一,受撞击后产生Na和N2,C错误;
D.元素Cl、Na、Al的最高价氧化物对应的水化物分别为高氯酸、氢氧化钠、氢氧化铝,氢氧化铝为两性氢氧化物,所以氢氧化钠、氢氧化铝和高氯酸之间能够相互反应,D正确;
故选D。
8. C
【详解】A.由图中信息可知b为C6H14,同分异构体分别为CH3CH2CH2CH (CH3)2,CH3CH2CH(CH3)CH2CH3, (CH3)3CCH (CH3)2,(CH3)2CHCH (CH3)2共4种,A正确;
B.由催化剂的特点可知,催化剂可以改变化学反应的速率,CO2催化加氢是化学工业上实现资源再生、改善环境,多功能催化剂可以加快CO2催化加氢速率,B正确;
C.直馏汽油中含饱和烃,与水不溶,与溴不反应,则能用直馏汽油萃取溴水中的溴,裂化汽油含不饱和烃,与溴发生加成反应,不能用裂化汽油萃取溴水中的溴,C错误;
D.图可知,二氧化碳和氢气反应生成CO,可知化学方程式为CO2+H2CO+H2O,D正确;
故选C。
9. D
【分析】根据“暖宝宝”的成分可知,铁粉和活性炭在氯化钠溶液中形成原电池,铁做负极,活性炭做正极,铁在中性环境中与氧气发生反应,铁电极反应为:2Fe−4e−=2Fe2+,正极的电极反应为:O2+4e−+2H2O=4OH−,总反应为:2Fe+O2+2H2O=2Fe(OH)2,铁粉和氧气发生原电池反应放出热量,据此分析。
【详解】A.由于氯化钠溶液呈中性,正极反应物为氧气,A项错误;
B.铁做负极,铁电极反应为:2Fe−4e−=2Fe2+,所以反应1mol Fe转移2mole-,B项错误;
C.“暖宝宝”能长效保温是因为发生了原电池反应,加快了化学反应速率,C项错误;
D.“暖宝宝”的总反应为:2Fe+O2+2H2O=2Fe(OH)2,但Fe(OH)2不稳定,与氧气、水反应生成Fe(OH)3,最终分解为铁锈,所以使用后变硬,其主要成分为:氯化钠、三氧化二铁、炭粉等固体,D项正确;
答案选D。
10. B
【详解】A.配制一定质量分数的CuSO4溶液,称量后在烧杯中溶解即可,不需要容量瓶,A错误;
B.淀粉在酸性条件下水解,需要中和酸后,在碱性溶液中滴加新制备氢氧化铜检验葡萄糖,需要试管、胶头滴管、酒精灯,可完成实验,B正确;
C.碘与NaOH溶液反应后,萃取分离出四氯化碳,分离出水层加硫酸生成碘,过滤分离出碘,给出的仪器及试剂不能完成实验,C错误;
D.除去乙酸乙酯中少量乙醇,应该用饱和碳酸钠溶液除去乙醇,乙酸乙酯与氢氧化钠反应,会减少乙酸乙酯的量,给出试剂不能完成实验,D错误;
故选B。
11. D
【详解】A.0~20s,NO2的浓度变化量为(0.200-0.124)mol/L=0.076mol/L,则NO2的平均反应速率为0.0038mol·L-1·s-1,A错误;
B.△H是不变的量,60s后向容器中再通入NO2(g),△H不会变大,B错误;
C.升高温度,正反应速率增大、逆反应速率增大,C错误;
D.增大容器体积,混合气体浓度会减小,混合气体的颜色比原平衡时浅,D正确;
故答案为D。
12. CD
【详解】A.容器气体内颜色不再变化,说明碘单质的浓度不再变化,符合平衡状态的特征,故A不符合题意;
B.v正(H2)=v逆(I2),说明正、逆反应速率相等,符合平衡状态的特征,故B不符合题意;
C.该反应反应前后气体分子数相等,压强始终保持恒定,压强不变不能说明反应达到平衡状态,故C符合题意;
D.单位时间内消耗H2(g)和I2(g)均为正向反应,且消耗量之比等于化学计量数之比,不能说明反应达到平衡状态,故D符合题意;
故选:CD。
13. BC
【分析】根据短周期主族元素X、Y、Z、W、Q在元素周期表中的位置,可知X、Y为第二周期,A、W、Q为第三周期,Z元素的原子L层电子数是M层电子数的2倍,Z为Si,则X为N,Y为O,W为S,Q为Cl,据此分析解答。
【详解】A.元素原子的电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,原子半径:Z>W>Y,故A正确;
B.Q的氧化物水化物对应的酸HClO为弱酸,W的氧化物对应的酸硫酸为强酸,硫酸酸性强于HClO,故B错误;
C.Z为Si,其氧化物SiO2是光导纤维的主要成分,故C错误;
D.X的简单氢化物NH3与Q的简单氢化物HCl可以反应生成NH4Cl,NH4Cl为离子化合物,故D正确;
故选:BC。
14. AD
【详解】A.反应①中,K2CrO4转化为K2Cr2O7不存在元素化合价的变化,不属于氧化还原反应,故A错误;
B.反应②中,Fe2(SO4)3是氧化剂,I2是氧化产物,氧化性:Fe2(SO4)3>I2.,反应③中K2Cr2O7是氧化剂,Fe2(SO4)3是氧化产物,氧化性: K2Cr2O7>Fe2(SO4)3,由此可知氧化性:K2Cr2O7>Fe2(SO4)3>I2,故B正确;
C.反应②中,I2由HI氧化得到,每有l molI2生成,转移电子数为2NA,故C正确;
D.反应③中氧化产物为Fe2(SO4)3,还原产物为Cr2(SO4)3,两者的物质的量之比为3:1,故D错误;
故选:AD。
15. BC
【详解】A.反应①中Se的化合价升高,被氧化,故A正确;
B.反应②中KI是还原剂,HNO3不是氧化剂,SeO2是氧化剂,故B错误;
C.反应②中,SeO2作氧化剂,发生还原反应,故C错误;
D.同一氧化还原反应中还原剂的还原性大于还原产物的还原性,①中还原剂是Se、还原产物是SO2,还原性Se>SO2;②中还原剂是I-、还原产物是Se,还原性I->Se,所以还原性由强到弱的顺序:,故D正确;
故选BC。
16. AC
【分析】由图可知,a电极为原电池的负极,单质钾片失去电子发生氧化反应生成钾离子,电极反应式为,b电极为正极,在钾离子作用下,氧气在正极得到电子发生还原反应生成超氧化钾;据以上分析解答。
【详解】A.金属性强的金属钾易与氧气反应,为防止钾与氧气反应,电池所选择隔膜应允许K+通过,不允许О2通过,故A正确;
B.KO2能与水反应,故有机电解质2不可用水溶液代替,故B错误;
C.由分析可知。A极反应式为,故C正确;
D.由分析可知,放电时,a为负极,b为正极,电子由a电极沿导线流向b电极,充电时,b电极应与直流电源的正极相连,做电解池的为阳极,故D错误;
故选AC。
17. BD
【分析】反应X═2Z经历两步:①X→Y;②Y→2Z,根据图中的c0减小,则a曲线为X的浓度曲线,逐渐增大的b曲线为Z的浓度,先增大后减小的c曲线为Y的浓度曲线,据此分析解答。
【详解】A.反应X═2Z经历两步:①X→Y;②Y→2Z,根据图中的c0减小,则a曲线为X的浓度曲线,逐渐增大的b曲线为Z的浓度,先增大后减小的c曲线为Y的浓度曲线,故A正确;
B.曲线的斜率表示反应速率,根据图象,0~t1时间段内,,故B错误;
C.t2时,曲线c表示的Y的浓度逐渐减小,说明Y的消耗速率大于生成速率,故C正确;
D.根据图象,t3后仍存在Y,没有X,假设Y的剩余浓度为c(Y),由①可知X完全转化为Y时,Y的浓度为c0,根据②,生成的Z的浓度c(Z)=2c0-2c(Y),故D错误;
故选BD。
18. BC
【详解】A.环戊二烯中存在甲烷的四面体结构,所有原子不可能平面,A错误;
B.由图中反应可知,Diels-Alder反应属于加成反应,B正确;
C.由生成物的结构简式,可知该生成物分子式为C9H12O18O,C正确;
D.产物在一定条件下与H2O发生水解反应可生成CH318OH和 ,D错误;
故选BC。
19. AD
【分析】实验室中常用CS2洗涤残留在试管壁上的S单质,则N为S元素;M原子半径大于N,且M离子带一个正电荷,则M为Na元素;Z周围有两个共价键,且原子序数小于M,则Z为O元素;X周围有一个共价键,且原子半径最小,则X为H元素;Y周围有四个共价键,图中所示的阴离子带两个负电荷且原子半径大于Z,则Y为C元素;
【详解】A.X、Z形成的化合物H2O2与M、N形成的化合物Na2S可以发生氧化还原反应,A正确;
B.实验室中用CS2洗涤残留在试管壁上的N单质,利用了N单质溶解性,B错误;
C.Z的氢化物的沸点不一定大于Y的氢化物的沸点,它们氢化物有多种,没有绝对关系,C错误;
D.化合物W常用作氧化剂,不宜在高温下使用,因为高温下化合物W不稳定,D正确;
故答案为AD。
20. AC
【分析】根据题目所给的图示可知,首先电解酸性食盐水,阳极生成氯气,阴极生成氢,然后氢将Fe(III)还原成Fe(II),Fe(II)再将硝酸根离子还原为,HClO将氧化为氮气,据此解答。
【详解】A.由图可知,Fe(III)在反应前后没有发生改变,起催化剂的作用,A项正确
B.通过分析,氯化钠溶液中的氯离子在阳极发生氧化反应,阳极的电极反应为:,B项错误;
C.电解质为酸性环境,H原子与反应的方程式为:,所以H原子与转化为的过程中有H+的参与,C项正确;
D.HClO氧化的反应方程式为:,D项错误;
答案选AC。
相关试卷
这是一份山东省枣庄市2020-2022三年高一化学下学期期末试题汇编2-选择题②,共13页。
这是一份山东省烟台市2020-2022三年高一化学下学期期末试题汇编2-选择题②,共15页。试卷主要包含了铁架台等内容,欢迎下载使用。
这是一份山东省泰安市2020-2022三年高一化学下学期期末试题汇编2-选择题②,共17页。试卷主要包含了下列实验操作能达到实验目的的是等内容,欢迎下载使用。









