
所属成套资源:各地区2020-2022三年高二化学下学期期末试题汇编
江苏盐城市2020-2022三年高二化学下学期期末试题汇编3-非选择题
展开
这是一份江苏盐城市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共32页。试卷主要包含了0×10−3、Ksp=3,5~10,5增至9,88时的去除率远低于pH=4等内容,欢迎下载使用。
江苏盐城市2020-2022三年高二化学下学期期末试题汇编3-非选择题
1. (2020春·江苏盐城·高二统考期末)下列表示反应中相关微粒的化学用语错误的是( )
A.中子数为20的钾原子:K
B.K+的结构示意图:
C.CO2的电子式:
D.C2H2的结构式:H—CC—H
2. (2020春·江苏盐城·高二统考期末)铜酸镧是一种反铁磁绝缘体,可由Cu(NO3)2和La(NO3)3为起始原料、水为溶剂、柠檬酸为络合剂,采用溶胶—凝胶法制备。
(1)Cu2+基态核外电子排布式为___。
(2)与NO互为等电子体的阴离子为___。
(3)柠檬酸(结构简式为)分子中碳原子的轨道杂化类型为___;1mol柠檬酸分子含σ键数目为___mol。
(4)铜酸镧的晶胞结构如图所示,写出其化学式:___。
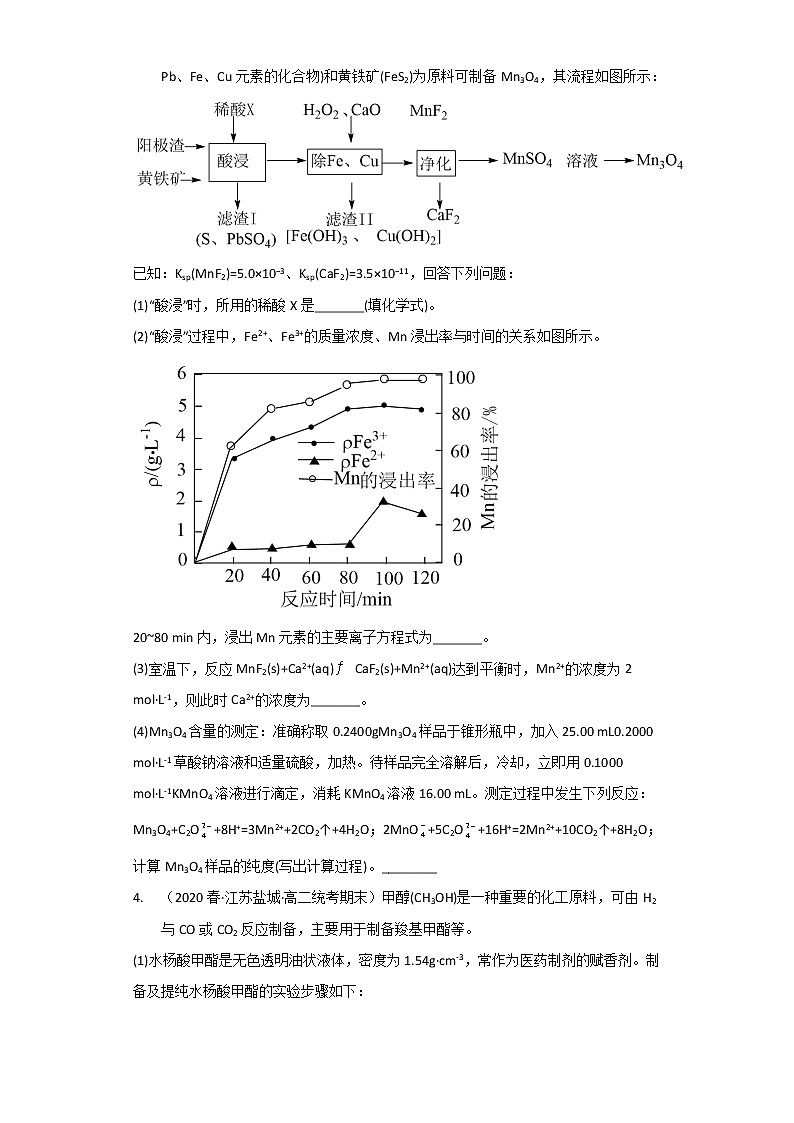
3. (2022春·江苏盐城·高二校联考期末)电解金属锰阳极渣(主要成分MnO2,杂质为Pb、Fe、Cu元素的化合物)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是_______(填化学式)。
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。
20~80 min内,浸出Mn元素的主要离子方程式为_______。
(3)室温下,反应MnF2(s)+Ca2+(aq)CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为_______。
(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O+8H+=3Mn2++2CO2↑+4H2O;2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。________
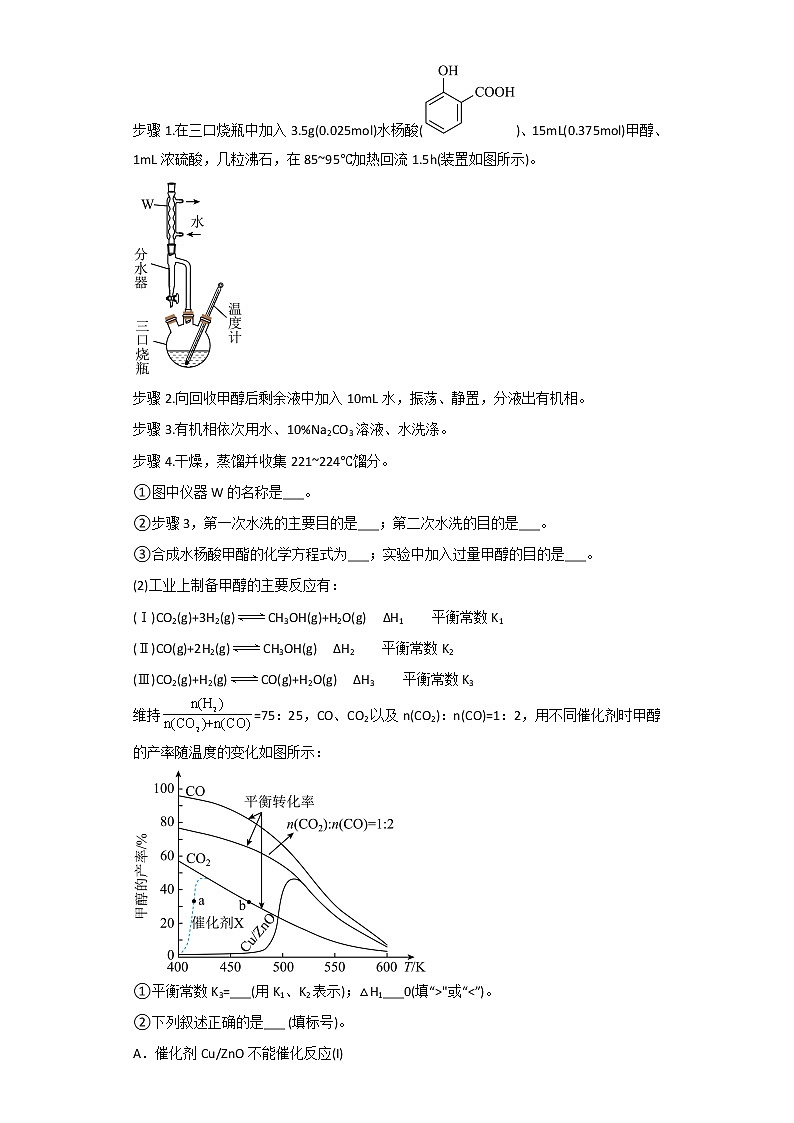
4. (2020春·江苏盐城·高二统考期末)甲醇(CH3OH)是一种重要的化工原料,可由H2与CO或CO2反应制备,主要用于制备羧基甲酯等。
(1)水杨酸甲酯是无色透明油状液体,密度为1.54g·cm-3,常作为医药制剂的赋香剂。制备及提纯水杨酸甲酯的实验步骤如下:
步骤1.在三口烧瓶中加入3.5g(0.025mol)水杨酸()、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。
步骤2.向回收甲醇后剩余液中加入10mL水,振荡、静置,分液出有机相。
步骤3.有机相依次用水、10%Na2CO3溶液、水洗涤。
步骤4.干燥,蒸馏并收集221~224℃馏分。
①图中仪器W的名称是___。
②步骤3,第一次水洗的主要目的是___;第二次水洗的目的是___。
③合成水杨酸甲酯的化学方程式为___;实验中加入过量甲醇的目的是___。
(2)工业上制备甲醇的主要反应有:
(Ⅰ)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1 平衡常数K1
(Ⅱ)CO(g)+2H2(g)CH3OH(g) ΔH2 平衡常数K2
(Ⅲ)CO2(g)+H2(g)CO(g)+H2O(g) ΔH3 平衡常数K3
维持=75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:
①平衡常数K3=___(用K1、K2表示);△H1___0(填“>"或“
相关试卷
这是一份江苏扬州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共40页。试卷主要包含了K2FeO4等内容,欢迎下载使用。
这是一份江苏泰州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共32页。试卷主要包含了00×10-3L×0等内容,欢迎下载使用。
这是一份江苏省徐州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共25页。









