
所属成套资源:各地区2020-2022三年高二化学下学期期末试题汇编
江苏扬州市2020-2022三年高二化学下学期期末试题汇编3-非选择题
展开
这是一份江苏扬州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共40页。试卷主要包含了K2FeO4等内容,欢迎下载使用。
江苏扬州市2020-2022三年高二化学下学期期末试题汇编3-非选择题
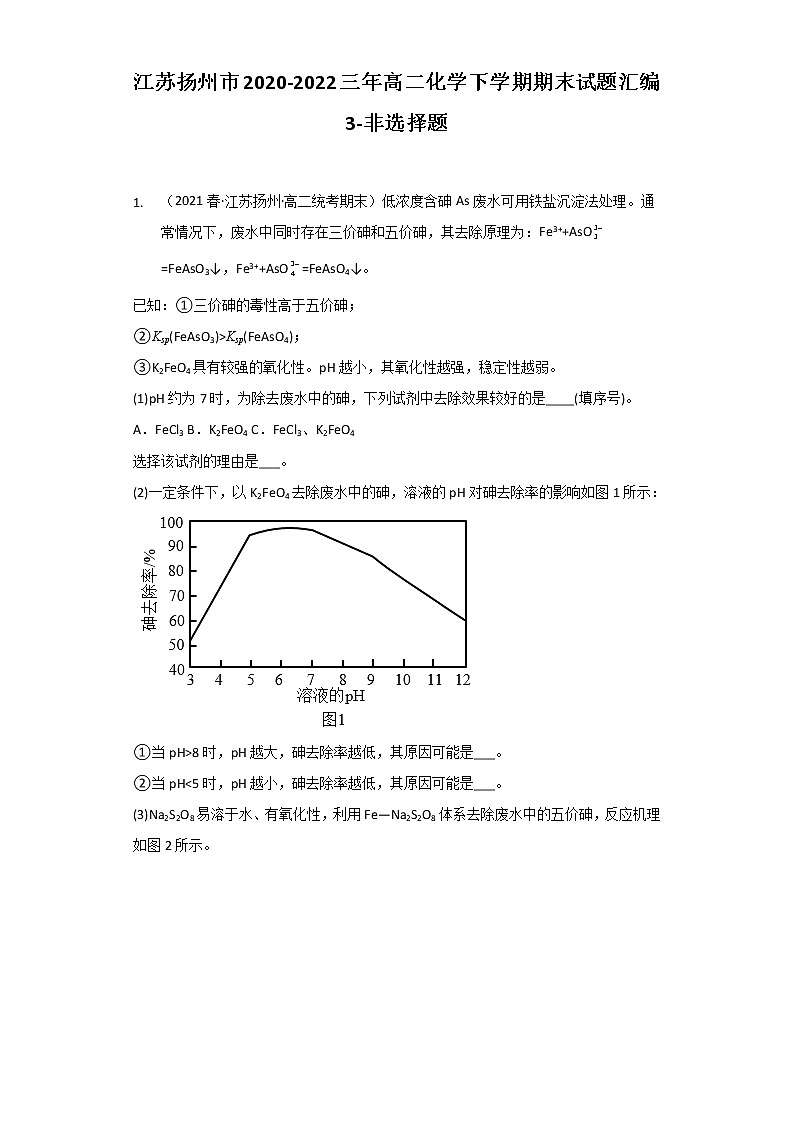
1. (2021春·江苏扬州·高二统考期末)低浓度含砷As废水可用铁盐沉淀法处理。通常情况下,废水中同时存在三价砷和五价砷,其去除原理为:Fe3++AsO=FeAsO3↓,Fe3++AsO=FeAsO4↓。
已知:①三价砷的毒性高于五价砷;
②Ksp(FeAsO3)>Ksp(FeAsO4);
③K2FeO4具有较强的氧化性。pH越小,其氧化性越强,稳定性越弱。
(1)pH约为7时,为除去废水中的砷,下列试剂中去除效果较好的是____(填序号)。
A.FeCl3 B.K2FeO4 C.FeCl3、K2FeO4
选择该试剂的理由是___。
(2)一定条件下,以K2FeO4去除废水中的砷,溶液的pH对砷去除率的影响如图1所示:
①当pH>8时,pH越大,砷去除率越低,其原因可能是___。
②当pH”或“8时,溶液pH越大,K2FeO4氧化性减弱,AsO转化为FeAsO4沉淀的量减小,导致砷去除率降低,故答案为:pH升高,高铁酸钾氧化性减弱,AsO转化为FeAsO4沉淀的量减小,砷去除率降低;
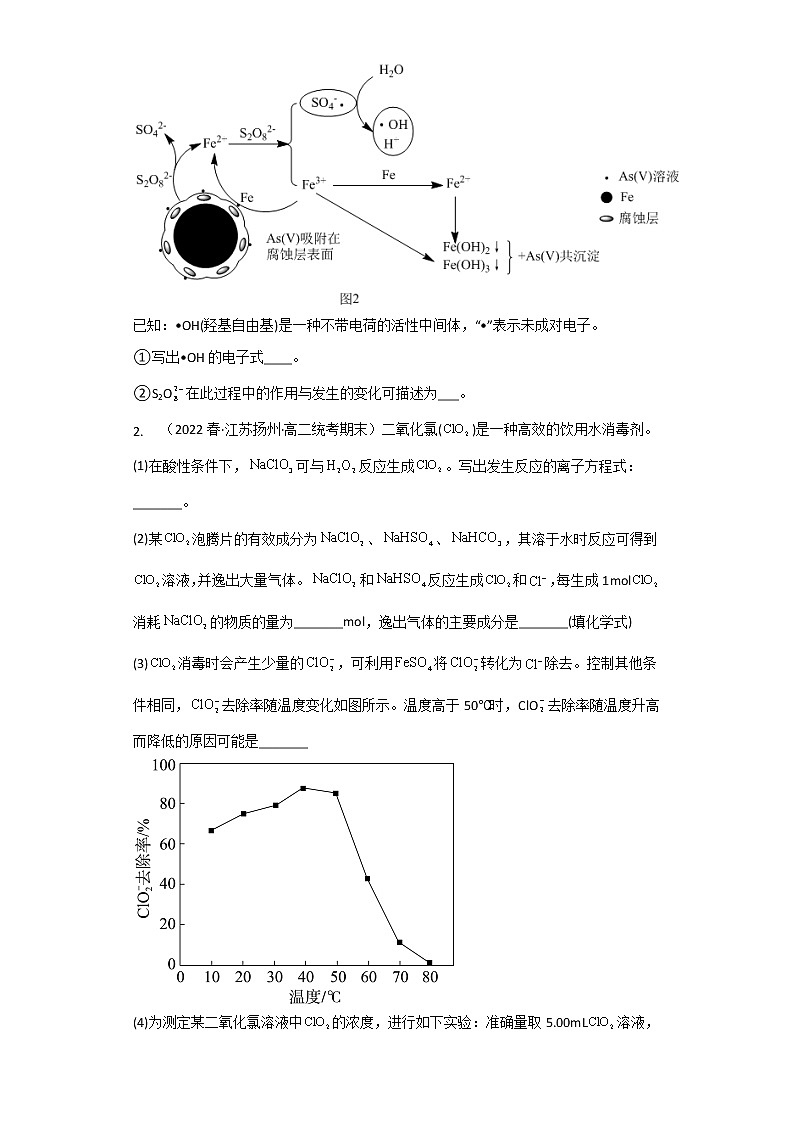
②由题给信息可知,溶液pH越小,K2FeO4稳定性越弱,则当溶液pHC>H,则形成CH3O·的H显负电性,形成H-O的H显正电性,即过程ⅰ中参与反应的显正电性与显负电性氢原子的数目比=2:2=1:1;
②结合图可知过程ⅱ为被吸附的与被吸附的·作用,中H−O断裂,形成了中H−O,生成被吸附的与HO·。
12. 四面体 sp3 4.15×10-7mol•L-1 防止倒吸或堵塞;便于观察气泡,以调整气体流速 2NaS+Na2CO3+4SO2=3Na2S2O3+CO2 Na2S2O3在酸性溶液中不能稳定存在
【分析】A装置制备二氧化硫,C装置中合成Na2S2O3, 会导致装置内气压减小,B装置为安全瓶作用,二氧化硫有毒,会污染空气,用氢氧化钠溶液吸收剩余的二氧化硫。
【详解】(1) SO中中心原子S的价层电子对数为4,S为sp3杂化SO为正四面体构型,SO中一个非羟基O原子被S原子取代后的产物,由于S = S的键长不在等于S=O(S-O),所以其空间构型为四面体形,中心S*原子同样还是sp3杂化。
(2)提纯Na2S时使用试剂为Ba(OH)2,当溶液中CO浓度达到1×10-5mol•L-1时,Ksp(BaCO3)=c(CO)×c(Ba2+)=2.58×10-9,c(Ba2+)=2.58×10-6,Ksp(BaSO4)= c(Ba2+)×c(SO)=1.07×10-10,c(SO)=4.15×10-7mol•L-1。
(3) ①B装置为安全瓶,防止倒吸或堵塞;便于观察气泡,以调整气体流速。
②三颈烧瓶中生成Na2S2O3的总反应的化学方程式为:2NaS+Na2CO3+4SO2=3Na2S2O3+CO2。
③三颈烧瓶中必须控制pH不能小于7,原因是Na2S2O3在酸性溶液中不能稳定存在。
13. BD 329.3 c>b>a 一定温度下,越大,反应II消耗的H2越多,生成的CO越多,值越小 反应I、II均为吸热反应,温度升高,反应I、II均向正反应方向移动;升温对反应II的促进作用大于反应I(或温度升高,反应II的催化效果比反应I大。) CH4-2e-+O2-=CO+2H2 流速过快,CH4在电极表面停留时间短,反应不完全;流速过慢,CH4可能转化为H2O与CO2
【详解】(1)由盖斯定律反应Ⅰ+Ⅱ可得CH4(g)+2CO2(g) =3CO(g)+H2O(g) △H=288.3 kJ•mol-1,
A.恒温恒容条件下,由于质量守恒,气体的密度不变。不可以判断达到平衡,故A错误;
B.温恒容条件下,由于反应前后化学计量数之和不同,气体的压强不变,可以判断达到平衡,故B正确;
C.恒温恒容条件下,由反应判断,H2被约去了,不能以H2的浓度来判断是否达到平衡,故C错误;
D.由反应可知此反应为吸热反应,绝热恒容条件下,反应体系的温度不变,可以判断达到平衡,故D正确;
(2) 由盖斯定律可知:Ⅰ+2×Ⅱ=III,CH4(g)+CO2(g)=4CO(g)+2H2O(g),该反应的△H=329.3kJ•mol-1,平衡常数表达式为K=。
(3) ①850℃时,图1中曲线a、b、c所示由大到小的关系是c>b>a,理由是一定温度下,越大,反应II消耗的H2越多,生成的CO越多,值越小。
②当温度大于850℃时,曲线c出现如图变化的原因可能是:反应I、II均为吸热反应,温度升高,反应I、II均向正反应方向移动;升温对反应II的促进作用大于反应I(或温度升高,反应II的催化效果比反应I大。)
(4)固体氧化物燃料电池利用CH4为原料,直接在电极上氧化合成CO、H2。其反应原理如图2所示,此电池为原电池,失电子为负极,则m为负极,电极m上发生反应的电极方程式:CH4-2e-+O2-=CO+2H2;若电极m上通入CH4的速率过快或过慢均会使CO、H2产率降低。其原因是:流速过快,CH4在电极表面停留时间短,反应不完全;流速过慢,CH4可能转化为H2O与CO2。
14. -955 NO+NO2+2NaOH=2NaNO2+H2O 67.2 NH3 随着温度升高催化剂活性降低,所以脱氮率随温度的升高而下降。 正 2NH3-6e-+6OH-=N2+6H2O
【分析】(1)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(2)根据元素守恒、电子守恒书写反应方程式;根据NaOH的物质的量与反应消耗气体物质的量关系计算气体的物质的量,然后根据n=计算气体在标准状况下的体积;
(3)①根据还原剂失去电子,元素化合价升高分析判断;
②利用催化剂在一定温度下催化效率最高分析判断;
(4)根据在原电池反应中负极失去电子,发生氧化反应,正极上得到电子,发生还原反应分析解答。
【详解】(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-662 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1248 kJ/mol
根据盖斯定律,将(①+②)×,整理可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol;
(2)NO和NO2混合气体按一定比例被NaOH溶液完全吸收生成NaNO2和H2O,则根据元素原子守恒、电子守恒,可得该反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;由方程式可知:NaOH的物质的量与反应消耗气体的物质的量相等,若反应过程中消耗NaOH的物质的量为3 mol,则理论上被吸收的NO和NO2混合气体的物质的量也是3 mol,其在标准状况下的总体积V(NO+NO2)=3 mol×22.4 L/mol=67.2 L;
(3)①根据图示可知NH3与NO、NO2发生反应产生N2、H2O,在反应中NH3中N元素化合价为-3价,反应后变为N2中的0价,化合价升高,失去电子,被氧化,所以NH3为还原剂;
②一定时间内,用Fe作催化剂,氨气按一定的比例催化还原氮氧化物时,温度不同,反应脱氮率不同,催化剂只有在一定温度范围内催化效率最高,当温度高于300℃时,脱氮率随温度的升高而下降的原因可能是由于随着温度升高催化剂活性降低,导致脱氮率随温度的升高而下降;
(4)①根据图示可知:电极A上通入NH3,失去电子,发生氧化反应变为N2,所以A电极为负极;电极B上通入NO2,得到电子,发生还原反应变为N2,所以B电极为正极;
②电极A上通入NH3,失去电子,发生氧化反应变为N2,其中的+1价的H与溶液中OH-结合形成H2O,则A电极为负极,负极A的电极反应式为:2NH3-6e-+6OH-=N2+6H2O。
【点睛】本题以氮氧化物的处理为线索,考查了反应热的计算、氧化还原反应方程式的书写、概念与计算及原电池反应原理。掌握盖斯定律、氧化还原反应规律和电化学基础知识是本题解答的关键。题目侧重考查学生的知识掌握与应用能力及分析、解决问题的能力。
15. 4a+2b-2c-2d 1.5 250℃ 增大CO2的浓度 电解池 2O2--4e-=O2↑
【分析】(1)①根据反应热等于反应物总键能与生成物总键能的差计算;
②根据物质反应转化关系计算各种物质的平衡时的物质的量,结合反应达平衡时测得CO的体积分数为20%,计算出CO2的平衡时的物质的量及浓度;
(2)①催化剂的催化效率越高,反应消耗能量越低,越有利于制取乙酸;
②根据平衡移动原理分析判断;
(3)根据原电池、电解池的区别判断;与电源正极连接的电极为阳极,与治理电源负极连接的电极为阴极,阳极发生氧化反应,阴极发生还原反应,据此解答。
【详解】(1)①由于反应热等于反应物总键能与生成物总键能的差,所以反应CH4(g)+CO2(g)2CO(g)+2H2(g)的反应热△H=(4×a+2×b-2×c-2×d) kJ/mol=(4a+2b-2c-2d) kJ/mol;
②反应开始时CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),假设反应消耗CO2的物质的量为x,则平衡时n(CH4)=n(CO2)=(4-x) mol,n(CO)=n(H2)=2x mol,当反应达平衡时测得CO的体积分数为20%,则×100%=20%,解得x=1 mol,所以平衡时n(CO2)=(4-x) mol=(4-1) mol=3 mol,容器的容积是2 L,则平衡时CO2的浓度c(CO2)=3 mol÷2 L=1.5 mol/L;
(2)①根据图示可知温度为250℃时,催化剂的催化效率最高,低于或高于该温度时催化剂的催化效率都未达到最高值,故在制备乙酸时,可选择的适宜温度为250℃;
②要提高反应CH4+CO2CH3COOH中CH4的平衡转化率,可通过增大CO2的浓度,使平衡正向移动,或减少CH3COOH的浓度,使平衡正向移动实现;
(3)由图示可知该装置中有直流电源,因此该装置属于电解池,其中b电极连接电源的正极,为阳极,阳极上O2-失去电子,发生氧化反应产生O2,故b电极的电极反应式为:2O2--4e-=O2↑。
【点睛】本题考查了反应热与键能的关系、化学平衡影响的有关计算、反应条件的判断及电解池知识。掌握化学反应有关原理,理解有关概念的含义是本题解答关键,题目考查了学生识图与数据处理能力及应用知识分析解决问题的能力。
16. < 溶液由蓝色恰好变为无色,且30秒内不变色 AC
【分析】根据KHCO3溶液中存在电离平衡和水解平衡,由电离常数和水解常数判断相对大小,进而判断溶液的酸碱性;根据滴定原理,结合I2使淀粉变蓝,判断滴定终点现象;根据氧化还原滴定,由反应,分析消耗的标准溶液的体积偏大的原因;根据题中所给数据,结合氧化还原反应,由得失电子守恒计算该晶体的化学式。
【详解】(1)溶液中存在HC2O4-H++C2O42-电离平衡,Ka2==5.4×10-5,KHC2O4水解反应为:HC2O4-+H2O⇌H2C2O4+OH-,其水解平衡常数为Kh2=====1.9×10-13,在KHC2O4溶液中,HC2O4-电离呈酸性,HC2O4-水解呈碱性,由Ka2=5.4×10-5>Kh2=1.9×10-13可知,电离程度大于水解程度,故KHC2O4溶液呈酸性,pH<7,答案为<。
(2)步骤II化学反应是;,用标准溶液滴定I2,淀粉作指示剂,开始呈现蓝色,滴定到终点,现象为加入最后一滴Na2S2O3的标准液于锥形瓶中,溶液由蓝色恰好变为无色,且30s不恢复;答案为加入最后一滴Na2S2O3的标准液于锥形瓶中,溶液由蓝色恰好变为无色,且30s不恢复。
(3)A.滴定前未将待测溶液充分加热,待测溶液中可能含有MnO4-,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,消耗更多的Na2S2O3,消耗的标准溶液的体积偏大,故A符合题意;
B.锥形瓶水洗后未干燥,不影响滴定,对滴定结果无影响,故B不符合题意;
C.装标准溶液的滴定管水洗后未润洗,标准液被稀释,滴定时消耗的体积增大,故C符合题意;
D.滴定时锥形瓶中有液体溅出,待测液损失,标准液消耗量减小,消耗标准溶液的体积变小,故D不符合题意;
答案AC。
(4)由反应可知,C2O4-与MnO4-完全反应,消耗MnO4-的物质的量为n(MnO4-)=0.1000mol·L-1×0.032L=3.2×10-3mol,样品中C2O4-的物质的量为n(C2O4-)=×3.2×10-3mol=8.0×10-3mol,由,可知,关系式为2S2O32-~I2~2Cu2+,得出n(Cu2+)=n(S2O32-)=0.2500mol·L-1×0.016L=4.0×10-3mol,根据电荷守恒原理:n(K+)=2n(S2O32-)-2n(Cu2+)=2×8.0×10-3mol-2×4.0×10-3mol=8.0×10-3mol,根据质量守恒原理:m(H2O)=1.4160g-8.0×10-3mol×39g/mol-4.0×10-3mol×64g/mol-8.0×10-3mol×88g/mol=1.4160g-0.312g-0.256g-0.704g=0.144g,n(H2O)==8×10-3mol,则n(K+):n(Cu2+):n(C2O42-):n(H2O)= 8.0×10-3:4.0×10-3:8.0×10-3:8×10-3=2:1:2:2,该晶体的化学式为K2Cu(C2O4)2·2H2O;答案为K2Cu(C2O4)2·2H2O。
17. 175 增加,氧化性减弱,脱硝效率下降 0.1
【分析】(1)根据盖斯定律计算反应热;
(2)根据的浓度、吸收液对脱硫脱硝效率的影响图象分析解答;
③根据电子转移计算;根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式;
(3)根据电解原理分析解答。
【详解】(1)已知热化学方程式:① ;
② ;
③ ;
根据盖斯定律可知,由①+②+③可得目标方程式,则反应的;
(2)①由图可知,的浓度为175时,脱硫效率最高,而高于175时,脱硝效率增大不明显,故最适宜的浓度为175;
②时,随着的增大,的脱除率下降,其可能的原因是增加,氧化性减弱,脱硝效率下降;
③时,会发生歧化反应:,该反应中,+4价的Cl,既有化合价升高到+5价,又有化合价降低到+3价,故有2mol参加反应时,转移1mol电子,则当有完全反应时,转移电子数目为0.1;在碱性条件下可以将氧化为,根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式为;
(3)电解池中阳极发生氧化反应,电解溶液制备时,Cl元素由-1价升高为+4价,则该过程应在阳极发生,则阳极产生的电极反应式为;阳极也可能发生反应,故此方法的缺点是所得产品纯度不高,气体中所含的杂质可能有。
【点睛】第(3)问根据已知信息可知,要用该电解池装置电解溶液制备,根据电解原理可知阳极产物应为,而不是我们平常认为的,当题目中有已知信息时,我们要按信息去解答题目,不能想当然作答。
18. 或 HF O 、 6 4
【分析】(1)根据核外电子排布规律书写;
(2)根据等电子体的概念解答;
(3)根据配位键的概念分析;
(4)根据轨道杂化理论分析;
(5)根据晶胞的结构分析计算。
【详解】(1)Cu为29号元素,基态Cu原子的核外电子排布式为或,Cu原子失去4s轨道的1个电子和3d轨道的1个电子后变成,故基态的核外电子排布式为或;
(2)原子总数相同、价电子总数相同的分子或离子互为等电子体,与互为等电子体的一种分子可以为HF;
(3)与反应能生成,中Cu2+提供空轨道,O原子提供孤电子对形成配位键,所以中的配位原子为O;
(4)乙醛()中甲基上的C原子形成4个σ键,无孤电子对,价层电子对数为4,故甲基上的C原子采取sp3杂化;醛基中的C原子形成3个σ键,无孤电子对,价层电子对数为3,故醛基上的C原子采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6mol σ键;
(5)一个晶胞中,白球的个数为,黑球的个数为4,又Cu2O中Cu和O的个数比为2:1,故白球为O原子,黑球为Cu原子,故一个晶胞中,原子的数目为4。
【点睛】有机物中C原子的杂化方式:若C原子形成4个σ键,采取sp3杂化,如甲烷的碳原子、乙醛中甲基上的碳原子等;若C原子形成3个σ键,即C原子形成双键,如碳碳双键或碳氧双键等,采取sp2杂化,如乙烯,醛基上的碳原子等;若C原子形成2个σ键,即C原子形成三键,如碳碳三键,采取sp杂化,如乙炔等。
19. 1s22s22p63s23p63d24s2(或为[Ar] 3d24s2) 1 O>N>C sp3 O TiN
【分析】(1)Ti是22号元素,根据构造原理,可得基态钛原子的核外电子排布式;N2分子中2个N原子形成3个共价键,共价三键中含有1个σ键,2个π键;
(2)元素的非金属性越强,其电负性就越大;
(3)根据原子形成的化学键数目判断其杂化类型;Ti原子具有空轨道,OC4H9中的O原子提供孤电子对;
(4)利用均摊方法计算晶体的化学式。
【详解】(1)Ti是22号元素,根据构造原理,可得基态钛原子的核外电子排布式为:1s22s22p63s23p63d24s2或简写为[Ar] 3d24s2;N2分子中2个N原子形成3个共价键,结构式是N≡N,2个N原子通过共价三键结合,其中含有1个σ键,2个π键,则1 mol N2中含有1 mol σ键;
(2)元素的非金属性越强,其电负性就越大。C、N、O是同一周期的元素,由于元素的非金属性:O>N>C,所以三种元素的电负性由大到小的顺序是:O>N>C;
(3)在络合物钛酸四丁酯[Ti(OC4H9)4]中,配位体OC4H9的C原子形成4个共价键,因此C原子杂化类型为sp3杂化;中心离子Ti4+提供空轨道,配位体OC4H9中的O原子提供孤对电子对,所以该配合物中的配位原子是O原子;
(4)根据晶胞结构可知:N原子数目为:8×+6×=4;含有的Ti原子数目为:12×+1=4,所以该晶体的化学式为TiN。
【点睛】本题考查了原子核外电子排布、原子的杂化、元素电负性比较、化学键类型的判断及数目计算和晶胞知识。掌握原子核外电子排布规律、杂化轨道理论等知识是本题解答关键,要学会使用均摊方法分析晶体结构。
相关试卷
这是一份江苏盐城市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共32页。试卷主要包含了0×10−3、Ksp=3,5~10,5增至9,88时的去除率远低于pH=4等内容,欢迎下载使用。
这是一份江苏泰州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共32页。试卷主要包含了00×10-3L×0等内容,欢迎下载使用。
这是一份江苏省徐州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共25页。









