辽宁省锦州市2020-2022三年高二化学下学期期末试题汇编3-非选择题
展开辽宁省锦州市2020-2022三年高二化学下学期期末试题汇编3-非选择题
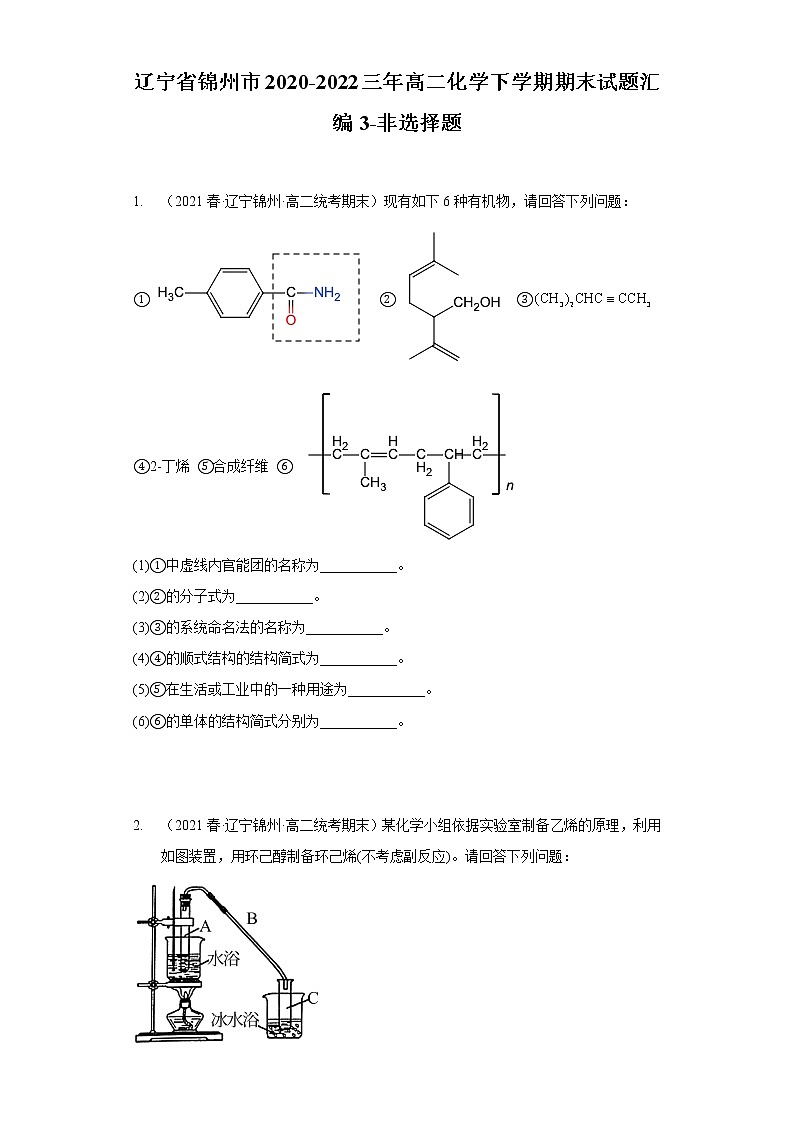
1. (2021春·辽宁锦州·高二统考期末)现有如下6种有机物,请回答下列问题:
① ② ③ ④2-丁烯 ⑤合成纤维 ⑥
(1)①中虚线内官能团的名称为___________。
(2)②的分子式为___________。
(3)③的系统命名法的名称为___________。
(4)④的顺式结构的结构简式为___________。
(5)⑤在生活或工业中的一种用途为___________。
(6)⑥的单体的结构简式分别为___________。
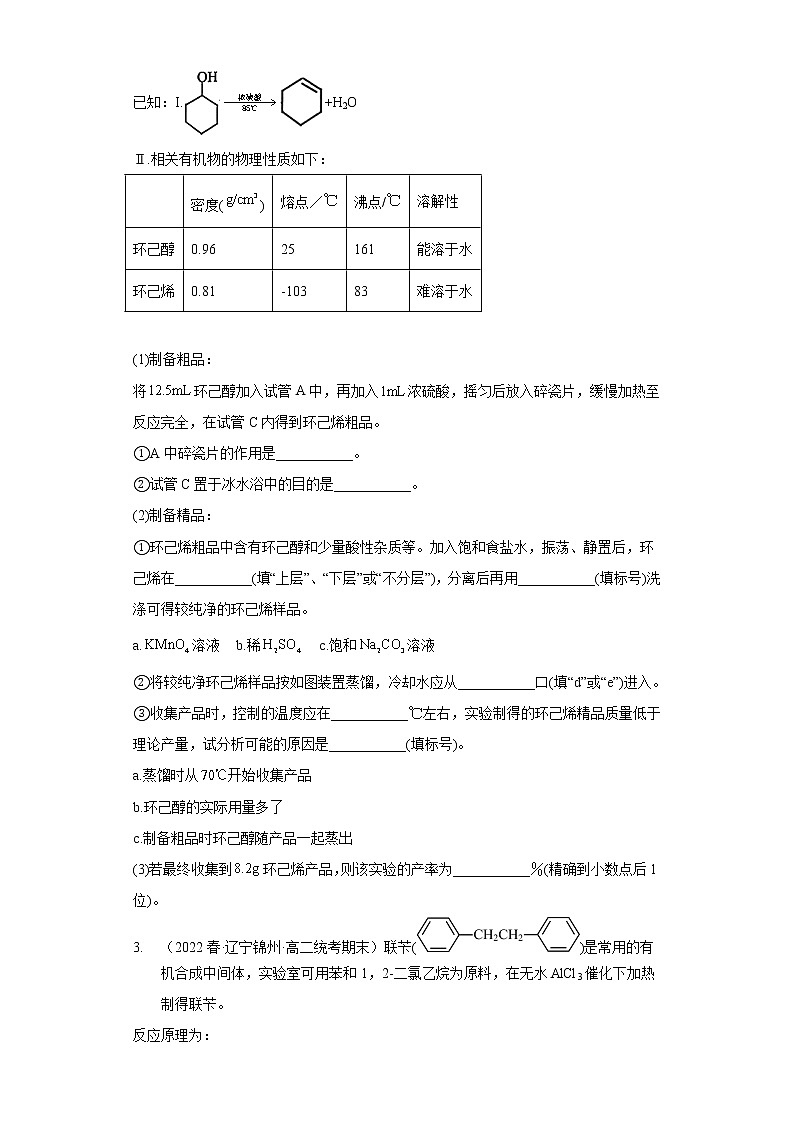
2. (2021春·辽宁锦州·高二统考期末)某化学小组依据实验室制备乙烯的原理,利用如图装置,用环己醇制备环己烯(不考虑副反应)。请回答下列问题:
已知:I.+H2O
Ⅱ.相关有机物的物理性质如下:
密度()
熔点/
沸点/
溶解性
环己醇
0.96
25
161
能溶于水
环己烯
0.81
-103
83
难溶于水
(1)制备粗品:
将环己醇加入试管A中,再加入浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________。
②试管C置于冰水浴中的目的是___________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置后,环己烯在___________(填“上层”、“下层”或“不分层”),分离后再用___________(填标号)洗涤可得较纯净的环己烯样品。
a.溶液 b.稀 c.饱和溶液
②将较纯净环己烯样品按如图装置蒸馏,冷却水应从___________口(填“d”或“e”)进入。
③收集产品时,控制的温度应在___________左右,实验制得的环己烯精品质量低于理论产量,试分析可能的原因是___________(填标号)。
a.蒸馏时从开始收集产品
b.环己醇的实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)若最终收集到环己烯产品,则该实验的产率为___________%(精确到小数点后1位)。
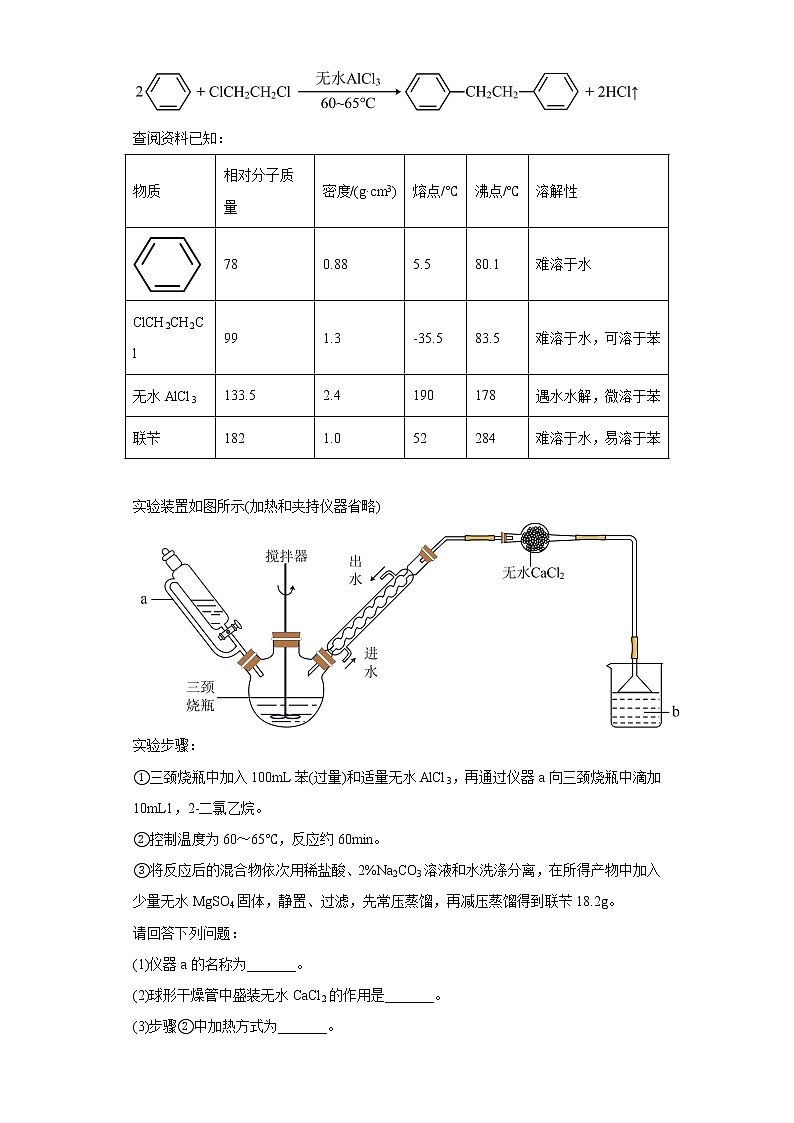
3. (2022春·辽宁锦州·高二统考期末)联苄()是常用的有机合成中间体,实验室可用苯和1,2-二氯乙烷为原料,在无水AlCl3催化下加热制得联苄。
反应原理为:
查阅资料已知:
物质
相对分子质量
密度/(g·cm3)
熔点/℃
沸点/℃
溶解性
78
0.88
5.5
80.1
难溶于水
ClCH2CH2Cl
99
1.3
-35.5
83.5
难溶于水,可溶于苯
无水AlCl3
133.5
2.4
190
178
遇水水解,微溶于苯
联苄
182
1.0
52
284
难溶于水,易溶于苯
实验装置如图所示(加热和夹持仪器省略)
实验步骤:
①三颈烧瓶中加入100mL苯(过量)和适量无水AlCl3,再通过仪器a向三颈烧瓶中滴加10mL1,2-二氯乙烷。
②控制温度为60~65℃,反应约60min。
③将反应后的混合物依次用稀盐酸、2%Na2CO3溶液和水洗涤分离,在所得产物中加入少量无水MgSO4固体,静置、过滤,先常压蒸馏,再减压蒸馏得到联苄18.2g。
请回答下列问题:
(1)仪器a的名称为_______。
(2)球形干燥管中盛装无水CaCl2的作用是_______。
(3)步骤②中加热方式为_______。
(4)通过观察反应过程中溶液b中的现象变化,可以验证该反应的反应类型,则溶液b可以选用的试剂为_______。(填序号)A.水 B.石蕊溶液 C.硝酸银溶液 D.氢氧化钠溶液
(5)步骤③中加入无水MgSO4固体的作用是_______。
(6)常压蒸馏除杂时,最低温度应控制在_______℃。
(7)该实验的产率约为_______%(保留到小数点后一位)。
4. (2020春·辽宁锦州·高二期末)氮、磷、氟是组成化合物的重要元素。请回答下列问题:
(1)基态磷原子的核外价电子排布图为_______。
(2)N、P、F三种元素的电负性由大到小的顺序为______。
(3)PF3分子的空间构型为______。
(4)N与F可形成化合物N2F2,下列有关N2F2的说法正确的是______(填字母)。
a. 分子中氮原子的杂化轨道类型为sp2杂化
b. 其结构式为F-N=N-F
c. 其分子有两种不同的空间构型
d. 1 mol N2F2含有的σ键的数目为4NA(NA表示阿伏加德罗常数的值)
(5)含氮元素的重要配离子[Cu(NH3)4]2+的结构示意图可表示为_______。
(6)农药中通常含有磷元素,AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。
①磷化铝的晶体类型为_______。
②A、B点的原子坐标如图所示,则C点的原子坐标为______。
③磷化铝的晶胞参数a=546.35 pm(1 pm=10-12m),其密度为_____g/cm3。(列出计算式即可,用NA表示阿伏加德罗常数的值)
5. (2020春·辽宁锦州·高二期末)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)基态镍原子的核外电子排布式为______。
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应,如:①CH2=CH2②HC≡CH③④HCHO,其中碳原子的杂化轨道类型为sp2杂化的分子有______(填物质序号)。
(3)[Ni(NH3)6]SO4中阴离子的立体构型是____。氨气(NH3)的沸点_____(填“高于”或“低于”)膦(PH3),原因是____。
(4)金属镍(Ni)与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。该合金的化学式为____。
(5)某镍白铜合金的立方晶胞结构如图所示,请回答:
①晶胞中镍原子的堆积模型名称是_____。
②元素铜与镍的第二电离能分别为:I2(Cu)=1959 kJ/mol,I2(Ni)=1753 kJ/mol,I2(Cu)>I2(Ni)的原因是____。
③若合金的密度为d g/cm3,晶胞参数(即边长)a=_____nm。(用NA表示阿伏加德罗常数的值)
6. (2021春·辽宁锦州·高二统考期末)晶体和配合物等物质在生活生产中具有广泛应用。请回答下列问题:
(1)按构成晶体的粒子与粒子间作用力的不同,将以下晶体进行分类:
①氧化钙 ②金刚砂 ③锌 ④高锰酸钾 ⑤白磷 ⑥硼 ⑦尿素 ⑧干冰 ⑨石墨 ⑩碳钢
属于分子晶体的是___________(填序号);属于共价晶体的是___________(填序号)。
(2)中,配位数为___________;以原子与形成配位键,请在结构示意图的相应位置填补缺少的配体___________。
(3)铁和氮形成一种晶体,晶胞结构如图所示。则该晶体中每个周围与它最接近且距离相等的共有___________个;若该晶体的密度为,用表示阿伏加德罗常数的值,则该晶胞的体积是___________。
7. (2022春·辽宁锦州·高二统考期末)材料是人类赖以生存和发展的重要物质基础。请回答下列问题;
(1)下列金属材料的性质能用电子气理论解释的是_______(填序号)
A.易腐蚀 B.易导电 C.易导热 D.有延展性
(2)工业上采用氰化法提炼金的同时生成[Zn(CN)4]2-,[Zn(CN)4]2-中配位原子是C,[Zn(CN)4]2-的结构式为_______;其中含有的σ键与π键的数目之比为_______。
(3)立方氮化硼是一种超硬、耐磨、耐高温的新型材料,在机械加工行业有着广泛的应用,结构与金刚石相似,晶胞如图所示。
①立方氮化硼熔点比金刚石低,原因是_______。
②一个N原子周围紧邻的N原子有_______个。
③晶体中含有配位键,提供空轨道的原子是_______原子。
④若晶胞参数为α nm,设阿伏加德罗常数的值为NA,则晶体的密度为_______g/cm3(用含α、NA的表达式表示)。
8. (2020春·辽宁锦州·高二期末)乙酸是有机合成的重要原料,由它合成苏合香醇(香料)和扁桃酸(医药中间体)的途径如图:
已知:RCH2COOH
(1)A 的结构简式为_____,B 中官能团的名称是_____。反应④的反应类型是_____。
(2)反应③的化学方程式为_____。
(3)芳香族化合物 M(C10H10O4)可以水解生成扁桃酸和两种只含一个碳原子的含氧衍生物,M 的结构简式为_____。
(4)聚丙烯酸( )在工业上可以抑制水垢的生成。根据已有知识并结合本题相关信息,设计由丙酸(CH3CH2COOH)为原料合成聚丙烯酸的路线_____。(合成路线常用的表示方式为:甲乙…目标产物)
9. (2020春·辽宁锦州·高二期末)环丁基甲酸是重要的有机合成中间体,其一种合成路线如图:
请回答下列问题:
(1)A属于烯烃,则A的名称为_____。
(2)B→C的反应,还可能生成与C互为同分异构体的副产物,此副产物的结构简式为______。
(3)A→B的反应类型为_______。
(4)写出D生成E的化学反应方程式_______。
(5)写出同时满足下列条件的G的所有同分异构体______(写结构简式,不考虑立体异构)。
①核磁共振氢谱为3组峰;
②能使溴的四氯化碳溶液褪色;
③1 mol该同分异构体与足量饱和NaHCO3溶液反应产生88 g气体。
(6)H的一种同分异构体为丙烯酸乙酯(CH2=CH-COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学反应方程式_______。
(7)以和化合物E为原料,设计制备的合成路线_______。(无机试剂任选)
10. (2021春·辽宁锦州·高二统考期末)醇酸树脂的附着力强,并具有良好的耐磨性、绝缘性等。下图是一种醇酸树脂G的合成路线,请回答下列问题:
已知:RCH2CH=CH2
(1)反应①的反应条件为___________。
(2)反应②的反应类型为___________。
(3)D中含有官能团的名称为___________。
(4)合成G过程中会生成另一种醇酸树脂,其结构简式为___________。
(5)反应④的化学方程式为___________。
(6)任意写出一种符合下列条件的F的同分异构体的结构简式___________(不考虑立体异构)。
a.该物质与新制悬浊液反应
b.遇溶液显紫色
c.核磁共振氢谱有3组峰,比值为
(7)设计以1-溴丙烷()为原料制备聚丙烯醇( )的合成路线___________(用流程图表示,无机试剂任选,反应条件合理)。
11. (2022春·辽宁锦州·高二统考期末)有机物为解决人类面临的资源、能源、环境和健康等问题起到了重要的作用。请回答下列问题:
(1)线型结构酚醛树脂的结构简式为_______。
(2)的系统命名法的名称为_______。
(3)写出丙醛与银氨溶液发生银镜反应的化学方程式_______。
(4)0.1mol某链状经与0.2molHCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,则该经的结构简式为_______。
(5)某有机化合物X经李比希法测得其中碳的质量分数为72.0%,氢的质量分数为6.67%,其余为氧元素,用质谱法分析得知X的相对分子质量为150.根据下列信息确定X的分子结构:图甲为X的核磁共振氢谱,5组峰的面积之比为1:2:2:2:3;图乙为X的红外光谱:X分子苯环上只有一个取代基,且含有两种官能团。
①X的分子式为_______。
②X中含有官能团的名称为_______。
③1molX与足量氢气完全反应消耗氢气的物质的量为_______mol。
12. (2022春·辽宁锦州·高二统考期末)苯是重要的化工原料,可用来合成A和有机高分子材料N,一种制取A和N的流程如下图所示。
已知:
请回答下列问题
(1)反应I的催化剂为_______(写化学式)。
(2)试剂C可以选用_______(填序号)。
a.CH3COONa溶液b.NaOH溶液c.NaHCO3溶液d.Na2CO3溶液
(3)写出B的结构简式,并用星号(*)标出其中的手性碳原子_______。
(4)反应II的反应类型为_______。
(5)反应Ⅲ的化学方程式为_______。
(6)符合下列条件的B的同分异构体有_______种(填序号,不考虑立体异构)。
a.遇FeCl3溶液显紫色b.属于酯类c.苯环上有两个取代基
其中核磁共振氢谱有6组峰,且峰面积之比为1:1:2:2:2:2的同分异构体的结构简式为_______。
参考答案:
1. 酰胺基 4-甲基-2-戊炔 (或) 服装、床上用品、绝缘材料、渔网、缆绳、降落伞、航天服等 、
【详解】(1)根据①中虚线内的结构特点可知其官能团名称为:酰胺基,答案为:酰胺基;
(2)根据②结构可推知其分子式为:,答案为:;
(3)③为单炔烃,近官能团编号,其系统命名法的名称为:4-甲基-2-戊炔,答案为:4-甲基-2-戊炔;
(4) 2-丁烯有顺式和反式两种结构,其顺式结构的结构简式为(或),答案为:(或);
(5) 合成纤维在生活或工业中可以用作服装、床上用品、绝缘材料、渔网、缆绳、降落伞、航天服等;答案为:服装、床上用品、绝缘材料、渔网、缆绳、降落伞、航天服等;
(6)共聚物单体的结构简式分别为、,答案为:、。
2. 防止液体暴沸 降低温度,使环己烯液化便于收集 上层 c e 83 c 83.3
【分析】水浴装置中环己醇发生消去反应生成环己烯,环己烯在冰水浴中冷凝收集,据此分析答题。
【详解】(1)①液体中加入碎瓷片可防止液体在加热时剧烈沸腾,防止液体暴沸,答案为:防止液体暴沸;
②试管C为收集环己烯的装置,环己烯的熔点为-103℃,冰水浴时,可有利于收集环己烯,答案为:降低温度,使环己烯液化便于收集;
(2)①环己烯的密度小于水,且不溶于水,与饱和食盐水混合时,环己烯在溶液上层;其含有少量的酸性杂质,可用饱和的碳酸钠溶液吸收,答案为:上层;c;
②冷凝管的冷凝水的流向为下进上出,所以应从e口入,答案为:e;
③环己烯蒸馏实验时,其沸点为83℃,则控制温度为83℃左右;制得的环己烯精品质量低于理论产量,则混有环己醇,答案为:c。
(3)环己醇的物质的量为:,若最终收集到环己烯产品,则该实验的产率为,答案为:83.3%。
3. (1)恒压滴液漏斗
(2)防止水蒸气进入发生装置(三颈烧瓶),使AlCl3水解
(3)水浴加热
(4)BC
(5)吸水剂(或干燥剂)
(6)83.5
(7)76.2
【解析】(1)根据装置图,仪器a的名称为恒压滴液漏斗;
(2)AlCl3易水解,球形干燥管中盛装无水CaCl2的作用是防止水蒸气进入发生装置(三颈烧瓶),使AlCl3水解;
(3)步骤②控制温度为60~65℃,为便于控制温度,加热方式为水浴加热;
(4)该反应为取代反应,有HCl生成,HCl能使石蕊溶液变红、HCl能与硝酸银溶液反应生成氯化银沉淀,通过观察反应过程中溶液b中的现象变化,可以验证该反应的反应类型,则溶液b可以选用的试剂为石蕊溶液或硝酸银溶液,选BC;
(5)MgSO4吸水,步骤③中加入无水MgSO4固体的作用是干燥剂。
(6)常压蒸馏除杂,除去苯和1,2-二氯乙烷,根据苯和1,2-二氯乙烷的沸点,最低温度应控制在83.5℃
(7)10mL1,2-二氯乙烷的物质的量为,根据反应方程式,理论上生成联苄得失电子守恒物质的量是0.1313mol,该实验的产率约为。
4. F>N>P 三角锥形 abc 原子晶体 (,,)
【详解】(1)磷元素为15号元素,其核外电子排布式为1s22s22p63s23p3,则其核外价电子排布图为;
(2)同周期元素从左至右电负性逐渐增大,同主族元素从上至下电负性逐渐减小,故N、P、F三种元素的电负性由大到小的顺序为F>N>P;
(3)PF3的σ键电子对数为3,孤电子对数为,则价层电子对数为3+1=4,故PF3的空间构型为三角锥形;
(4)由8电子稳定结构可知,N2F2分子中N原子形成3个共价键、F原子形成1个共价键,故N原子之间形成氮氮双键,每个N原子分别与F原子形成N-F键,其结构式为F-N=N-F,N原子还有1对孤对电子,会存在顺反结构,
a. N2F2分子中氮原子的价层电子对数=2+1=3,则其杂化轨道数目为3,杂化类型为sp2,故a正确;
b. 由以上分析知,其结构式为F-N=N-F,故b正确;
c. N原子还有1对孤对电子,会存在顺反结构:(或),故c正确;
d. 1mol N2F2含有3mol σ键,含有的σ键的数目为3NA,故d错误;故选abc;
(5)配离子[Cu(NH3)4]2+中,铜离子提供空轨道,氨气分子中氮原子有孤对电子,铜离子与氨分子中的氮原子形成配位键,所以配离子[Cu(NH3)4]2+的结构示意图可表示为:;
(6)①磷化铝晶体的熔点为2000℃,且其晶胞中形成的是立体网状结构,故应为原子晶体;
②A、B点的原子坐标分别为(0,0,0)、(1,,),可知晶胞边长为1,由此可推知C点的原子坐标为(,,);
③晶胞中含有P原子数为,Al原子数也为4,则该晶胞的质量为,晶胞的体积为,则晶胞密度为。
【点睛】第(6)问在计算晶胞密度时单位的换算是学生们的易错点,首先单位要统一,要将pm 换算为cm,其次1pm=10-10cm,另外经常用到的还有纳米与厘米的换算,1nm=10-7cm。
5. [Ar]3d84s2 ①③④ 正四面体形 高于 NH3分子间可形成氢键 LaNi5 简单立方堆积 铜失去的是全满的3d10电子,镍失去的是4s1电子,所以I2(Cu)>I2(Ni)
【详解】(1)Ni元素为28号元素,基态镍原子的核外电子排布式为[Ar]3d84s2;
(2)①CH2=CH2③④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH中C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,故碳原子的杂化轨道类型为sp2杂化的分子有①③④;
(3)[Ni(NH3)6]SO4中阴离子为,中心原子S的价层电子对数=,且不含孤电子对,根据价层电子对互斥理论,的立体构型为正四面体形;含有分子间氢键的氢化物熔沸点较高,氨气(NH3)分子间可以形成氢键、膦(PH3)分子间没有氢键,则氨(NH3)的熔沸点高于膦(PH3);
(4)由“均摊法”知,每个晶胞中,La原子的个数为,Ni原子的个数为,故该合金的化学式为LaNi5;
(5)①该晶胞中的镍原子位于晶胞的顶点,故晶胞中镍原子的堆积模型名称是简单立方堆积;
②元素铜与镍的第二电离能分别为:I2(Cu)=1959 kJ/mol,I2(Ni)=1753 kJ/mol,I2(Cu)>I2(Ni)的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以I2(Cu)>I2(Ni);
③该晶胞中Ni原子个数=,Cu原子个数=,晶胞的质量为,则晶胞参数(即边长)a=nm。
6. ⑤⑦⑧ ②⑥ 6 12
【详解】(1)①氧化钙为活泼金属氧化物,属于离子晶体;
②金刚砂为SiC,熔点高硬度大,属于共价晶体;
③锌为金属单质,属于金属晶体;
④高锰酸钾为离子化合物,属于离子晶体;
⑤白磷为分子晶体;
⑥晶体硼硬度极高,与金刚石的硬度接近,为共价晶体;
⑦尿素为分子晶体;
⑧干冰为固态二氧化碳,属于分子晶体;
⑨石墨属于混合型晶体;
⑩碳钢也叫碳素钢,属于合金,是金属晶体;所以属于分子晶体的⑤⑦⑧;属于共价晶体的是②⑥,答案为:⑤⑦⑧;②⑥;
(2)中,NO和H2O均是配体,所以的配位数为6;以原子与形成配位键,所以结构示意图为:,答案为:6;;
(3)分析该晶体的晶胞可知,铁原子位于晶胞的八个顶点和六个面心,所以该晶体中每个周围与它最接近且距离相等的共有12个;一个晶胞中含有一个氮原子和四个铁原子,设该晶胞的体积为V,列出如下等式:,解得V=,答案为:12;。
7. (1)BCD
(2) 或 1∶1
(3) 都是共价晶体,B—N键的键长大于C—C键,键能小于C—C键,故立方氮化硼熔点比金刚石低 12 硼或(B) 或或
【解析】(1)
A.金属易锈蚀与金属晶体结构无关、与化学性质有关,金属的化学性质比较活泼,容易被空气中的氧气所氧化,故金属易腐蚀不能用金属晶体结构加以解释,A错误;
B.组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电,因此能用电子气理论解释,B正确;
C.金属晶体的导热是由于晶体内部自由电子与金属阳离子的碰撞,热量在电子与金属阳离子发生碰撞时得到传递,从而使整块金属很快都温度可以升高,能用电子气理论解释,C正确;
D.金属发生形变时,金属阳离子的层间发生相对滑动,但自由电子仍然可以在金属子离子之间流动,使金属不会断裂,能用电子气理论解释,D正确;
故合理选项是BCD;
(2)
在[Zn(CN)4]2-中Zn2+与4个C原子通过配位键结合,在配位体CN-中C原子与N原子通过共价三键结合,故其结构式为或;
配位键属于σ共价键,共价三键中一个是σ键,2个是π键,因此在[Zn(CN)4]2-中含有的σ键数目是4+4=8个,含有的π键数目是2×4=8,则其中含有的σ键与π键的数目之比为1:1;
(3)
①立方氮化硼与金刚石都属于共价晶体,但由于B—N键的键长大于C—C键,键能小于C—C键,导致化学键的键能:B—N键<C—C键,化学键的键能越大,断裂化学键需消耗的能量就越高,物质的熔沸点就越高,故立方氮化硼熔点比金刚石低;
②根据图示可知在晶胞中,一个N原子周围紧邻的N原子有个;
③晶体中含有配位键,提供空轨道的原子是B原子,提供孤电子对是原子是N原子;
④在一个BN晶胞中含有N原子为,含有B原子数目是4个,则若晶胞参数为α nm,则该晶胞的密度ρ=。
8. 氯原子、羧基 加成反应 2HOCH2COOH+O22OHCCOOH+2H2O CH3CH2COOHCH3CHClCOOHCH2=CHCOONaCH2=CHCOOH
【分析】乙酸与SOCl2发生取代反应生成 , 与苯在一定条件下发生取代反应A,A与氢气催化剂作用下发生加成反应生成苏合香醇,根据A物质前后反应类型和物质结构变化,A的结构简式为: ;乙酸与Cl2在一定条件下发生取代反应生成B(ClCH2COOH),B在一定条件下转化为HOCH2COOH,HOCH2COOH发生催化氧化生成C,C为OHCCOOH,C与苯发生加成反应生成 ,据此分析解答。
【详解】(1)根据分析A 的结构简式为 ,B 的结构式为ClCH2COOH,其中官能团的名称是氯原子、羧基;反应④C与苯发生加成反应生成 ,反应类型是加成反应;
(2)反应③是HOCH2COOH发生催化氧化生成C,C为OHCCOOH,的化学方程式为2HOCH2COOH+O22OHCCOOH+2H2O;
(3) 芳香族化合物 M(C10H10O4),则分子结构中含有苯环,该有机物能水解生成两种只含一个碳原子的含氧衍生物,说明分子结构中含有两个酯基,水解生成的两种只含一个碳原子的含氧衍生物应该为甲酸(HCOOH)和甲醇(CH3OH),根据扁桃酸( )的结构简式,M 的结构简式为 ;
(4) CH3CH2COOH在P作催化剂条件下与氯气发生取代反应生成CH3CHClCOOH,CH3CHClCOOH在氢氧化钠的醇溶液中发生消去反应生成CH2=CHCOONa,加足量的酸进行酸化转化为CH2=CHCOOH,CH2=CHCOOH在催化剂作用下发生聚合反应生成 ,合成路线:CH3CH2COOHCH3CHClCOOHCH2=CHCOONaCH2=CHCOOH。
9. 丙烯 取代反应 +2C2H5OH +2H2O HOOC-CH2-CH=CH-CH2-COOH、 +nNaOH+nCH3CH2OH
【分析】由A、B的分子式以及C的结构简式可知,A为丙烯CH2=CH-CH3,B为CH2=CH-CH2Br,A与Br2在光照条件下发生取代反应生成B,B与HBr发生加成反应生成C;D与乙醇发生酯化反应生成E,由E的结构简式可知,D为丙二酸,据此分析解答。
【详解】(1)A属于烯烃,A为CH2=CH-CH3,名称为丙烯;
(2)B(CH2=CH-CH2Br)与HBr发生加成反应生成C(CH2Br-CH2-CH2Br),则B与HBr发生加成反应生成C,还可能生成与C互为同分异构体的副产物:CH3-CHBr-CH2Br;
(3)A→B的反应类型为取代反应;
(4)D为丙二酸,与乙醇发生酯化反应生成E,则反应的化学反应方程式为+2C2H5OH +2H2O;
(5)G为,其同分异构体:①核磁共振氢谱为3组峰;则有3种氢原子;②能使溴的四氯化碳溶液褪色,则有碳碳双键;③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体,则分子中有2个羧基;综上,符合的结构简式为:HOOC-CH2-CH=CH-CH2-COOH、两种;
(6)丙烯酸乙酯(CH2=CH-COOC2H5)发生加聚反应生成聚丙烯酸乙酯(),聚丙烯酸乙酯在NaOH溶液中水解的化学方程式为:+nNaOH+nCH3CH2OH;
(7)以和化合物E(丙二酸二乙酯)为原料,制备,根据逆合成分析法,制备,需要;和(丙二酸二乙酯)反应生成;可由与HBr发生取代反应生成,故合成路线为:。
10. 醇溶液(或醇溶液、强碱的乙醇溶液等)、加热 加成反应 羟基 (或 +O2+2H2O (或或或任意一种)
【分析】2-溴丙烷发生消去反应生成丙烯,丙烯和NBS试剂发生取代反应生成B:,B和溴发生加成反应生成C,C发生水解反应生成D:;被催化氧化生成,继续被氧化生成邻苯二甲酸,邻苯二甲酸和发生缩聚反应生成G:,据此分析答题。
【详解】(1)2-溴丙烷发生消去反应生成丙烯,所以反应①的反应条件为:醇溶液(或醇溶液、强碱的乙醇溶液等)、加热,答案为:醇溶液(或醇溶液、强碱的乙醇溶液等)、加热;
(2) B为:,B和溴发生加成反应生成C,所以反应②的反应类型为:加成反应,答案为:加成反应;
(3) C发生水解反应生成D:,所以D中含有官能团的名称为:羟基,答案为:羟基;
(4) 邻苯二甲酸和发生缩聚反应合成G过程中会生成另一种醇酸树脂,其结构简式为:(或,答案为:(或;
(5) 被催化氧化生成反应④,其化学方程式为+O2+2H2O,答案为:+O2+2H2O;
(6)F为:邻苯二甲酸,其同分异构体:a.该物质与新制悬浊液反应,推知需要含有2mol醛基;b.遇溶液显紫色,推知含有酚羟基;c.核磁共振氢谱有3组峰,比值为,根据上述条件可知同分异构体有:(或或或任意一种),答案为:(或或或任意一种);
(7) 1-溴丙烷()先发生消去反应生成丙烯,丙烯和NBS试剂生成为,再发生水解反应生成,发生加聚反应得到目标产物,所以制备聚丙烯醇()的合成路线为:,答案为:。
11. (1)
(2)4-甲基-2-戊醇
(3)
(4)CH≡C-CH3
(5) C9H10O2 酮羰基(或羰基)、醚键 4
【解析】(1)线型结构酚醛树脂的结构简式为;
(2)属于醇,含羟基的最长碳链为5个碳,从离羟基最近的一端开始编号即从右往左编号,故命名为4-甲基-2-戊醇;
(3);
(4)0.1mol某链状经与0.2molHCl完全加成,说明其含有一个碳碳叁键或两个碳碳双键,生成的氯代烷最多还可以与0.6mol氯气反应,说明生成的氯代烷只有6个氢原子,同时符合以上条件的该经的结构简式为CH≡C-CH3;
(5)有机化合物X经李比希法测得其中碳的质量分数为72.0%,氢的质量分数为6.67%,其余为氧元素,则氧的质量分数为21.33%,n(C):n(H):n(O)==9:10:2,X的相对分子质量为150,其X的分子式为C9H10O2;图甲为X的核磁共振氢谱,5组峰的面积之比为1:2:2:2:3;图乙为X的红外光谱:X分子苯环上只有一个取代基,且含有两种官能团,则X的结构简式为,其含有官能团的名称为酮羰基(或羰基)、醚键;X有一个苯环和一个酮羰基,1molX与足量氢气完全反应消耗氢气的物质的量为4mol。
12. (1)FeBr3
(2)bd
(3)
(4)消去反应
(5)
(6) 18
【分析】苯和溴发生反应I生成溴苯,溴苯在一定条件下发生水解反应生成苯酚(A),苯酚和氢氧化钠或碳酸钠反应生成苯酚钠;根据题目信息,和HCN反应生成 (B),和CH3OH发生酯化反应生成(D);在浓硫酸作用下发生消去反应生成(E),发生加聚反应生成(N),据此分析解答。
(1)
反应I是苯生成溴苯,反应条件是用FeBr3做催化剂。
(2)
a.苯酚的酸性小于醋酸,苯酚和CH3COONa溶液不反应,故不选a;
b.苯酚和NaOH溶液反应生成苯酚钠和水,故选b;
c.苯酚的酸性小于碳酸,NaHCO3溶液和苯酚不反应,故不选c;
d.酸性:碳酸>苯酚>,苯酚和Na2CO3溶液反应生成苯酚钠和碳酸氢钠,故选d;
选bd。
(3)
根据题目信息,和HCN反应生成,B是,手性碳原子如图。
(4)
由分析可知,D生成E是在浓硫酸作用下发生消去反应生成和水。
(5)
反应III是发生加聚反应生成,化学方程式为;
(6)
a.遇FeCl3溶液显紫色,说明含有酚羟基;b.属于酯类;c.苯环上只有两个取代基,2个取代基为-OH、-OOCCH2CH3或-OH、-COOCH2CH3或-OH、-CH2OOCCH3或-OH、-CH2COOCH3或-OH、-CH2CH2OOCH或-OH、-CH(CH3)OOCH,每种组合在苯环上的位置都有邻、间、对三种,符合条件的的同分异构体有18种,其中核磁共振氢谱有5组峰且峰面积之比为1:2:2:2:2的同分异构体的结构简式为。
辽宁省葫芦岛市2020-2022三年高二化学下学期期末试题汇编3-非选择题: 这是一份辽宁省葫芦岛市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共26页。试卷主要包含了79,23,7%等内容,欢迎下载使用。
江苏扬州市2020-2022三年高二化学下学期期末试题汇编3-非选择题: 这是一份江苏扬州市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共40页。试卷主要包含了K2FeO4等内容,欢迎下载使用。
江苏盐城市2020-2022三年高二化学下学期期末试题汇编3-非选择题: 这是一份江苏盐城市2020-2022三年高二化学下学期期末试题汇编3-非选择题,共32页。试卷主要包含了0×10−3、Ksp=3,5~10,5增至9,88时的去除率远低于pH=4等内容,欢迎下载使用。












