






化学必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物课文内容课件ppt
展开一天,小钠、小镁、小铜一起去河边玩。小镁和小铜跳进了河里玩的很开心,小钠童鞋也兴奋地跳了下去,然后TA冒了几个泡,就不见了!
19世纪初,英国科学家戴维首次在实验室中用电解熔融氯化钠方法制得了金属钠。
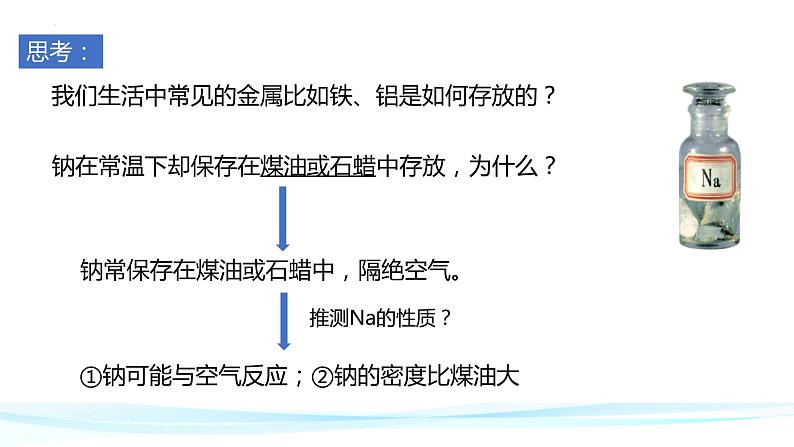
我们生活中常见的金属比如铁、铝是如何存放的?
钠常保存在煤油或石蜡中,隔绝空气。
钠在常温下却保存在煤油或石蜡中存放,为什么?
①钠可能与空气反应;②钠的密度比煤油大
①钠的取用——镊子(不能用手接触)
取一小块金属钠,用刀切去一端的外皮,观察钠表面的光泽和颜色。
以上实验,体现了金属钠哪些物理和化学性质?
4Na + O2 = 2Na2O
切口处可观察到银白色的金属光泽,在空气中很快变暗
银白色有金属光泽的固体,质软(硬度小),密度比煤油大
很活泼 ,常温下能与氧气反应
把一小块金属钠放在坩埚上,加热,有何现象发生?
2Na + O2 = Na2O2 (淡黄色)
反应条件不同,现象不同,产物也不同。
可观察到钠受热后,先熔成小球,后燃烧发出黄色火焰,生成淡黄色的固体过氧化钠(Na2O2)
2Na + O2 = Na2O2
4Na + O2 = 2Na2O
钠的化学性质很活泼,在常温或加热的条件下都能跟氧气反应生成不同的产物,但加热时与氧气的反应更加剧烈。反应条件不同,现象不同,产物也不同。
银白色有金属光泽的固体,质软(硬度小),熔点为97.87℃,密度为0.97g/cm3(比煤油大,但比水小),是电和热的良导体
在钠的切口处可以观察到银白色的金属光泽,切口处在空气中很快变暗。
加热后化学性质更加活泼,能和氧气剧烈反应生成淡黄色固体。
向一只盛有水的烧杯中滴加几滴酚酞试液,然后将绿豆般大小的金属钠投入到小烧杯中,观察实验现象。
2Na+2H2O=2NaOH+H2↑
钠与酸反应比与水反应剧烈。
实质:2Na+2H+=2Na++H2↑
钠能否与盐酸反应生成氢气, 试分析反应的剧烈程度;
将金属钠放入适量稀盐酸中,观察现象。
2Na+2HCl=2NaCl+H2↑
(4)钠与盐溶液的反应
①与NaCl溶液反应:实际是与水反应。
②与CuSO4溶液反应:2Na+2H2O=2NaOH+H2 ↑和2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 类似的反应还有钠与FeCl3溶液、MgSO4溶液的反应。
③与NaHSO4溶液反应:因NaHSO4完全电离而使溶液显酸性,因此钠与盐直接反应。反应的方程式:2Na+2NaHSO4=2Na2SO4+H2 ↑ 离子方程式是:2Na+2H+=2Na++H2 ↑
钠与酸碱盐溶液的反应规律
钠与稀硫酸、盐酸等反应,反应现象和水反应的现象相似,但更剧烈。其本质都是与H+反应。如果钠过量,酸反应完后,钠会继续与水反应,可以概括为“先酸后水”。
2、钠与碱溶液的反应
实际上是钠与水先反应。
a.钠钾合金做原子反应堆导热剂
b.钠是一种很好的强还原剂。金属钠有相当一部分用于制造一种抗爆剂—四乙基铅。 c.金属钠大量用来制造过氧化钠,氰化钠(NaCN)及某些钠的重要化合物。 d.制造高压钠灯。e.冶炼稀有金属,如:钛 锆 铌。
1.某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的( )
A.①④B.①②④C.①③④D.①②③④
①钠比水轻 ②钠的熔点较低 ③钠与水反应时放出热量 ④钠与水反应后溶液呈碱性
2.将一小块钠投入如图所示的烧杯中,有关说法正确的是( )
A.钠块在煤油中游动,并放出气体 B.钠块熔化,只在水层游动,溶液变红色,一段时间后煤油燃烧 C.在CCl4和水层交界处上下跳动,钠块熔化,溶液变红 D.在水层和煤油层交界处上下跳动,钠块熔化,溶液变红
氧化钠是一种白色固体,可以与水和二氧化碳发生化合反应,是一种典型的碱性氧化物。
Na2O+CO2=Na2CO3
Na2O+H2O=2NaOH
能与酸反应生成盐和水的氧化物是碱性氧化物能与碱反应生成盐和水的氧化物是酸性氧化物
2Na2O+O2=2Na2O2
实验探究: ②用脱脂棉包少量Na2O2,再滴加水。
实验探究:① 用脱脂棉包少量Na2O2,吹入CO2
思考:为什么Na2O2与CO2反应后,棉花会剧烈燃烧?
因为反应产生了氧气和放出热量
化学反应方程式:2Na2O2+2CO2=2Na2CO3+O2
化学反应方程式:2Na2O2+2H2O=4NaOH+O2↑
【氧化钠和过氧化钠对比】
(1)Na2O2属于碱性氧化物吗?为什么?
阴阳离子个数比为:N(O22-)∶N(Na+)=1∶2。
不属于,碱性氧化物指能与酸反应生成盐和水的氧化物,Na2O2与盐酸反应时不仅生成NaCl和水,还会有氧气生成,所以不属于碱性氧化物。
(2)Na2O2中阴阳离子的个数比是多少?
1.下列各组物质相互反应后,没有碱生成的是( )
A.Na2O2溶于水B.红热的铁和水蒸气C.金属钠投入水中D.Na2O投入水中
2.下列关于Na2O2的叙述正确的是( )
A.Na2O2中阴阳离子的个数比为1:1B.Na2O2的漂白原理与活性炭的漂白原理相同C.Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物D.Na2O2与CO2反应,每消耗1份Na2O2,转移电子的量为1份
碳酸钠(Na2CO3)俗称纯碱,也叫苏打,是一种白色粉末;碳酸氢钠(NaHCO3)俗称小苏打,是一种白色细小晶体。碳酸钠和碳酸氢钠都易溶于水,水溶液均显碱性,且碳酸钠比碳酸氢钠的溶解度大。
1. 碳酸钠和碳酸氢钠
碳酸钠受热不分解,碳酸氢钠受热易分解
2NaHCO3 = Na2CO3+CO2↑+H2O
在2支试管中,分别加入等浓度等体积的碳酸钠溶液和碳酸氢钠溶液,再分别滴加足量相同浓度的稀盐酸,观察现象。
观察发现两试管均产生气泡,且装有NaHCO3溶液的试管中产生的气泡速率快、试管上气球膨胀的快。
Na2CO3和NaHCO3遇酸均发生反应并生成二氧化碳,且碳酸氢钠与酸反应要比碳酸钠与酸反应剧烈。
Na2CO3+2HCl = 2NaCl+H2O+CO2↑NaHCO3+HCl = NaCl+H2O+CO2↑
3. 碳酸钠和碳酸氢钠的相互转化关系
(1)碳酸钠转化为碳酸氢钠a.向碳酸钠溶液中通入二氧化碳可使其转化为碳酸氢钠 Na2CO3+H2O+CO2 = 2NaHCO3b.向碳酸钠溶液中逐滴滴入稀盐酸,刚开始时并不能观察到有气泡产生,一段时间后有气泡产生 Na2CO3+HCl = NaCl +NaHCO3
(2)碳酸氢钠转化为碳酸钠a.碳酸氢钠不仅能和酸反应,还能和碱反应 NaHCO3+NaOH = Na2CO3+H2Ob.碳酸氢钠受热易分解,并放出二氧化碳 2NaHCO3 = Na2CO3+H2O+CO2↑
酸:H2CO3 、H+
加热或碱:NaOH、OH-
1.关于Na2CO3与NaHCO3的性质判断不正确的是( )A.热稳定性:Na2CO3>NaHCO3B.常温下溶解度:Na2CO3<NaHCO3C.等质量的Na2CO3和NaHCO3分别与等量同浓度的盐酸混合,反应速率Na2CO3<NaHCO3D.等物质的量Na2CO3和NaHCO3与足量盐酸反应,产生的CO2相同
2.甲试管中盛有0.5ml/L Na2CO3溶液10mL,慢慢往试管中加入1ml/L的盐酸7.0mL;乙试管中盛有1ml/L的盐酸7.0mL,慢慢往试管中滴加0.5ml/L Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为( )A.甲=乙B.甲>乙C.甲<乙D.无法确定
碳酸钠、碳酸氢钠与氢氧化钙的反应:
在2支试管中,分别加入等浓度等体积的碳酸钠溶液和碳酸氢钠溶液,再分别加入Ca(OH)2 溶液,观察现象。
4、碳酸钠、碳酸氢钠与氢氧化钙的反应
现象:观察发现2支试管中均产生白色沉淀。Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓当碳酸氢钠与少量的氢氧化钙反应时:2NaHCO3+Ca(OH)2 = CaCO3↓+Na2CO3+2H2O当碳酸氢钠与过量的氢氧化钙反应时:NaHCO3+Ca(OH)2 = CaCO3↓+NaOH+H2O
Na2CO3不反应HCO3-+OH-= CO32- +H2O
CO32-+Ca2+= CaCO3↓Ca2++OH- +HCO3-= CaCO3 ↓ +H2O
Na2CO3产生白色沉淀NaHCO3无现象
CO32-+Ca2+= Ca CO3↓NaHCO3不反应
Na2CO3无现象NaHCO3分解产生气体
2NaHCO3=Na2CO3+CO2↑+H2O
1.将下列物质的量浓度相等的溶液等体积混合有白色沉淀生成,加入过量稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是( )A.碳酸钠与氢氧化钙B.碳酸钠与氯化钡C.碳酸氢钙与氢氧化钠D.硫酸钠与氯化钡
2.为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是( )A.观察加热时是否放出气体B.观察滴加盐酸时能否放出气体C.溶于水中,再滴加石灰水,观察有无沉淀产生D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生
人教版 (2019)必修 第一册第一节 钠及其化合物完美版复习ppt课件: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物完美版复习ppt课件,共48页。PPT课件主要包含了金属的通性,钠的制备与用途,氯气的用途,二氧化锰和浓盐酸,成套装置,课堂小结等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物精品ppt课件: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物精品ppt课件,共30页。PPT课件主要包含了Na2CO3,碳酸钠与碳酸氢钠,少量定一,焰色试验,课堂总结等内容,欢迎下载使用。
化学必修 第一册第一节 钠及其化合物优秀ppt课件: 这是一份化学必修 第一册第一节 钠及其化合物优秀ppt课件,共27页。PPT课件主要包含了过氧化钠稳定性更好,Na2O2的特殊性质,课堂总结等内容,欢迎下载使用。













