
初中化学中考复习 2021届中考化学一轮微专题复习学案: 实验方案的设计和评价
展开2021届中考化学一轮微专题复习学案: 实验方案的设计和评价
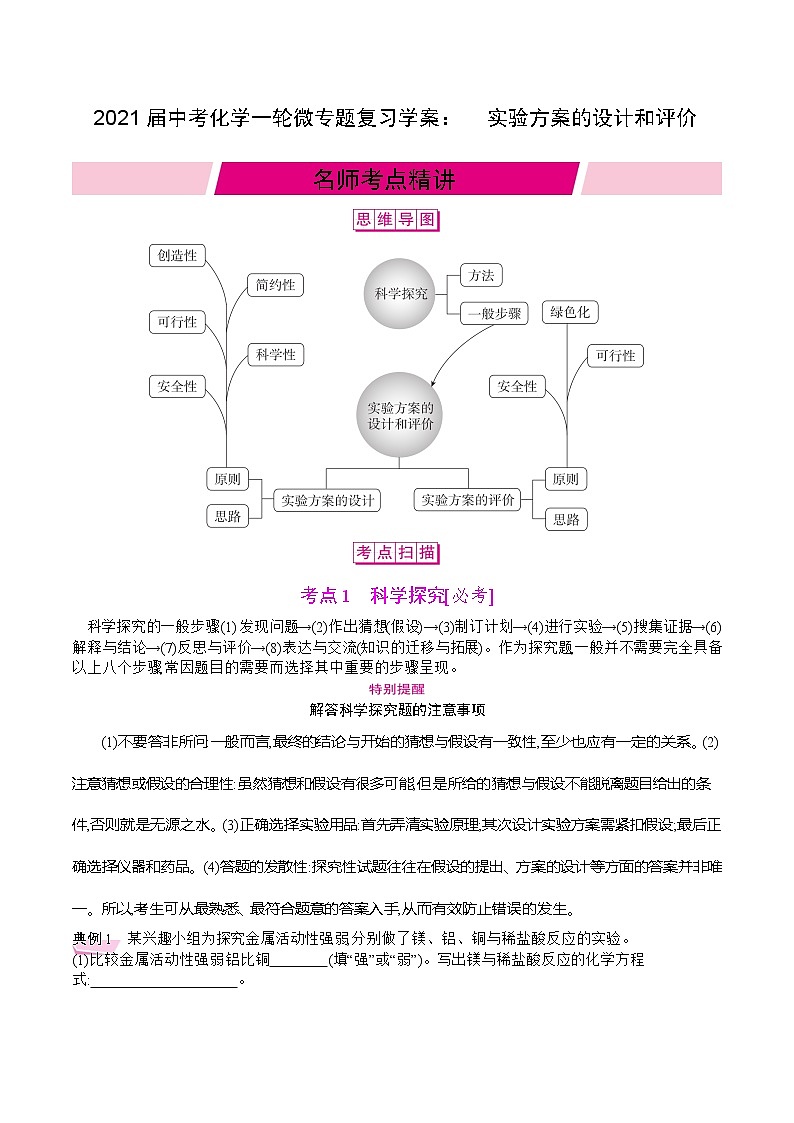
名师考点精讲
考点1 科学探究[必考]
科学探究的一般步骤:(1)发现问题→(2)作出猜想(假设)→(3)制订计划→(4)进行实验→(5)搜集证据→(6)解释与结论→(7)反思与评价→(8)表达与交流(知识的迁移与拓展)。作为探究题,一般并不需要完全具备以上八个步骤,常因题目的需要而选择其中重要的步骤呈现。
解答科学探究题的注意事项
(1)不要答非所问:一般而言,最终的结论与开始的猜想与假设有一致性,至少也应有一定的关系。(2)注意猜想或假设的合理性:虽然猜想和假设有很多可能,但是所给的猜想与假设不能脱离题目给出的条件,否则就是无源之水。(3)正确选择实验用品:首先弄清实验原理;其次设计实验方案需紧扣假设;最后正确选择仪器和药品。(4)答题的发散性:探究性试题往往在假设的提出、方案的设计等方面的答案并非唯一。所以,考生可从最熟悉、最符合题意的答案入手,从而有效防止错误的发生。
典例1 某兴趣小组为探究金属活动性强弱,分别做了镁、铝、铜与稀盐酸反应的实验。
(1)比较金属活动性强弱:铝比铜 (填“强”或“弱”)。写出镁与稀盐酸反应的化学方程式: 。
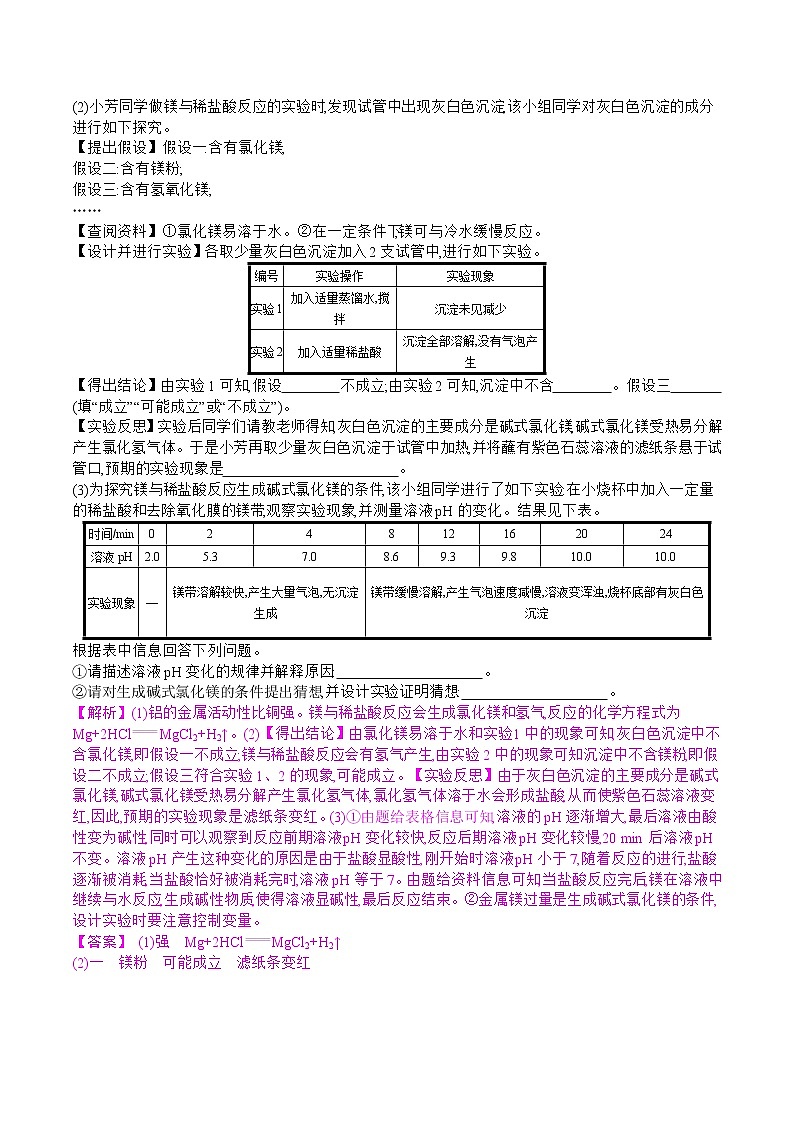
(2)小芳同学做镁与稀盐酸反应的实验时,发现试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究。
【提出假设】假设一:含有氯化镁;
假设二:含有镁粉;
假设三:含有氢氧化镁;
……
【查阅资料】①氯化镁易溶于水。②在一定条件下,镁可与冷水缓慢反应。
【设计并进行实验】各取少量灰白色沉淀加入2支试管中,进行如下实验。
编号 | 实验操作 | 实验现象 |
实验1 | 加入适量蒸馏水,搅拌 | 沉淀未见减少 |
实验2 | 加入适量稀盐酸 | 沉淀全部溶解,没有气泡产生 |
【得出结论】由实验1可知,假设 不成立;由实验2可知,沉淀中不含 。假设三 (填“成立”“可能成立”或“不成立”)。
【实验反思】实验后同学们请教老师得知,灰白色沉淀的主要成分是碱式氯化镁,碱式氯化镁受热易分解产生氯化氢气体。于是小芳再取少量灰白色沉淀于试管中加热,并将蘸有紫色石蕊溶液的滤纸条悬于试管口,预期的实验现象是 。
(3)为探究镁与稀盐酸反应生成碱式氯化镁的条件,该小组同学进行了如下实验:在小烧杯中加入一定量的稀盐酸和去除氧化膜的镁带,观察实验现象,并测量溶液pH的变化。结果见下表。
时间/min | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
溶液pH | 2.0 | 5.3 | 7.0 | 8.6 | 9.3 | 9.8 | 10.0 | 10.0 |
实验现象 | — | 镁带溶解较快,产生大量气泡,无沉淀生成 | 镁带缓慢溶解,产生气泡速度减慢,溶液变浑浊,烧杯底部有灰白色沉淀 | |||||
根据表中信息回答下列问题。
①请描述溶液pH变化的规律并解释原因: 。
②请对生成碱式氯化镁的条件提出猜想,并设计实验证明猜想: 。
【解析】(1)铝的金属活动性比铜强。镁与稀盐酸反应会生成氯化镁和氢气,反应的化学方程式为Mg+2HClMgCl2+H2↑。(2)【得出结论】由氯化镁易溶于水和实验1中的现象可知,灰白色沉淀中不含氯化镁,即假设一不成立;镁与稀盐酸反应会有氢气产生,由实验2中的现象可知沉淀中不含镁粉,即假设二不成立;假设三符合实验1、2的现象,可能成立。【实验反思】由于灰白色沉淀的主要成分是碱式氯化镁,碱式氯化镁受热易分解产生氯化氢气体,氯化氢气体溶于水会形成盐酸,从而使紫色石蕊溶液变红,因此,预期的实验现象是滤纸条变红。(3)①由题给表格信息可知,溶液的pH逐渐增大,最后溶液由酸性变为碱性,同时可以观察到反应前期溶液pH变化较快,反应后期溶液pH变化较慢,20 min后溶液pH不变。溶液pH产生这种变化的原因是由于盐酸显酸性,刚开始时溶液pH小于7,随着反应的进行,盐酸逐渐被消耗,当盐酸恰好被消耗完时,溶液pH等于7。由题给资料信息可知,当盐酸反应完后,镁在溶液中继续与水反应,生成碱性物质,使得溶液显碱性,最后反应结束。②金属镁过量是生成碱式氯化镁的条件,设计实验时要注意控制变量。
【答案】 (1)强 Mg+2HClMgCl2+H2↑
(2)一 镁粉 可能成立 滤纸条变红
(3)①溶液pH逐渐增大,最后呈碱性;反应前期pH变化较快,反应后期pH变化较慢,最后pH不变。因为前期盐酸浓度较大,反应较快;随着反应的进行,盐酸逐渐被消耗,但镁在溶液中继续与水缓慢反应,生成碱性物质,最后反应完成
②猜想:金属镁过量。设计实验:取两只烧杯,各加入等量的稀盐酸,分别加入少量和过量去除氧化膜的镁带,观察现象,如果前者无沉淀而后者有沉淀,证明猜想成立(合理即可)
针对训练
1.黄铜(铜和锌的合金)外观与黄金十分相似,但黄铜在潮湿的空气中长时间放置会产生铜绿,而黄金就不会。某化学兴趣小组的同学,对一件生满了铜绿的制品展开了探究活动。
【实验探究】①用小刀刮下铜绿,放入隔绝空气的容器内加热,生成了黑色固体氧化铜、水和能使澄清石灰水变浑浊的无气味气体。
②取一小块表面有铜绿的黄铜片放入稀硫酸中(如图A),观察到有气泡产生,溶液变蓝。
通过实验探究①可知铜绿的成分中由 4 种元素组成。
【提出问题1】实验探究②中生成的气体是什么?
【猜想与假设】假设一:生成的气体是CO2;
假设二:生成的气体是H2;
假设三:生成的气体是 CO2和H2 。
【实验验证1】同学们又连接了如图所示的装置进行验证:
A中反应较长时间后,再点燃D处的酒精灯。观察到 B中澄清石灰水变浑浊,D处气体燃烧产生淡蓝色火焰 现象,则证明假设三成立。若在A的样品中加入稀硫酸后,立即点燃D处的酒精灯,可能造成的结果是 发生爆炸 。
【提出问题2】A中反应后溶液呈蓝色,其中溶质有哪些?
某同学认为蓝色溶液中可能含有CuSO4和H2SO4。
【实验验证2】为证明蓝色溶液中可能存在CuSO4和H2SO4,同学们进行了如下实验。
实验操作 | 实验现象 | 实验结论 |
取少量蓝色溶液于试管中,加入过量打磨过的锌片 | 有气泡产生 | 溶质中一定含有H2SO4 |
有红色物质析出, 蓝色溶液逐渐变成无色 | 溶质中一定含有CuSO4 |
你认为上述反应后溶液中还存在的金属离子是 Zn2+ (写离子符号)。
考点2 实验方案的设计[必考]
1.实验方案的设计原则
(1)科学性:实验原理、实验操作程序和方法正确。
(2)可行性:切实可行,所选用的药品、仪器、设备和方法等在中学现有的实验条件下能够得到满足。
(3)安全性:设计实验时,应尽量避免使用有毒的药品和进行有一定危险性的实验操作。
(4)简约性:要尽可能简单易行,应选用简单的实验装置、用较少的实验步骤和实验用品,在短时间内完成实验。
(5)创造性:有创新意识。
2.实验方案的内容
(1)一个比较完整的化学实验方案,一般包括以下几个内容:①实验目的;②实验原理;③实验用品(包括仪器和药品等)及规格;④实验装置、实验步骤、操作方法及注意事项;⑤实验现象及结论;⑥反思与交流。
(2)对于给出实验目的,要求设计实验方案的试题一般可以按以下思维程序进行:①根据实验目的,确定实验原理(或假设);②根据实验原理(或假设),选择需要的仪器和药品(或实验装置图);③写出实验操作步骤及注意事项;④记录实验现象,分析实验结果,得出正确结论。
(3)实验设计要科学合理、安全可靠、操作简便、现象明显、结论可信、绿色环保。
3.实验方案的设计思路
(1)设计实验方案时要有完整的步骤和清晰的思路。(2)设计实验时要考虑对照性原则和控制变量原则。
典例2 对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 探究温度对分子运动快慢的影响 | |
B | 探究水对铁钉锈蚀的影响 | |
C | 探究空气是燃烧的必要条件 | |
D | 探究CO2与水发生反应 |
【解析】设计对比实验时要注意控制变量。A项,通过观察热水和冷水变红的快慢,可以探究温度对分子运动快慢的影响,正确;B项,探究水对铁钉锈蚀的影响需要控制两试管中的铁钉与等量氧气接触,而题给实验中两根铁钉没有同时与氧气接触,错误;C项,探究空气是燃烧的必要条件,需要控制空气为唯一变量,而题给实验有两个变量(可燃物和空气),错误;D项,二氧化碳与水反应生成碳酸,碳酸不能使酚酞溶液变红,两集气瓶中均无明显现象,错误。
【答案】 A
针对训练
2.下列实验方案设计错误的是( C )
【解析】C项,电解水生成氢气和氧气,氢气和氧气的体积比为2∶1,质量比是1∶8,错误。
考点3 实验方案的评价
1.实验方案的评价原则
(1)可行性:原理是否正确、可行;操作是否安全、合理;步骤是否简单、方便;现象是否明显等。
(2)绿色化:原料是否易得、安全、无毒;反应速率是否较快;原料利用率、产物产率是否较高;反应过程中是否有环境污染物产生。
(3)安全性:防倒吸、防爆炸、防氧化、防吸水、防挥发等。
2.实验方案的设计和评价思路
(1)根据实验目的,阐明实验原理,选择合适的仪器和药品。
(2)根据实验特点,设计实验装置。
(3)根据实验要求,设计可行的操作步骤,分析实验中的注意事项。
(4)通过对比和归纳,选出最佳方案。
(5)实验结束后写出完整的实验报告。
3.复习时可依据以下思路,在理解的前提下加以掌握
(1)实验方案的评价不是简单的“对、错”,而是分析实验方案是否合理、是否符合化学原理等。(2)绿色化学是化学学科发展的目标之一,一些实验的可行性不是只要能够出现实验现象即可,还要注意环保方面的问题。
典例3 氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得。
(1)工业上利用氮气和氢气反应制氨气,反应的化学方程式为 (不要求注明条件)。
(2)小华为探究氨气溶于水是否发生化学反应,设计并完成如下实验(填写表中空白)。
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后放入盛有干燥氨气的集气瓶中 | 无明显现象 |
①
| ②
|
(3)小明将滴有酚酞的稀氨水加热,观察到溶液红色变浅,原因可能是 。
(4)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化。为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度 (填“增大”“减小”或“不变”)。
(5)为除去氯化钠溶液中的碳酸钠,小林设计了如下方案。
你认为上述方案 (填“合理”或“不合理”),请分析: (若合理,说明原因;若不合理,说明原因并设计改进方案)。
【解析】(1)氢气和氮气在一定条件下反应生成氨气,反应的化学方程式为N2+3H22NH3。(2)氨水呈碱性,能使酚酞溶液变红,而氨水由氨气溶于水制得,由此可说明氨气溶于水发生了化学反应。(3)溶液红色变浅的原因可能是氨水不稳定,受热易分解,随温度升高,氨气溶解度减小,部分氨气逸出,导致氨水浓度降低。(4)根据题意“中和等量的氢氧化钠,消耗盐酸的质量:①>②”可知,①的盐酸浓度小于②,由此可知稀盐酸经加热煮沸后浓度增大。
【答案】(1)N2+3H22NH3
(2)①向上述集气瓶中的滤纸上滴入少量水 ②滤纸变红,说明二者发生了反应
(3)氨水受热分解,随温度升高,氨气溶解度减小,导致氨水浓度降低(合理即可)
(4)增大
(5)不合理 根据上述实验,加热煮沸无法除去溶液A中混有的过量HCl。改进方案:向含碳酸钠的氯化钠溶液中边逐滴滴加盐酸,边测定溶液的pH,至溶液呈中性即可(合理即可)
针对训练
3.皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料,拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
【提出问题】(1)白色沉淀A是什么?
(2)无色滤液B中的溶质有哪些?
【查阅资料】腌制皮蛋的原料配方是少量NaCl、CaO和过量Na2CO3的固体混合物。
【理论推理】(1)白色沉淀A是CaCO3,请写出生成该沉淀的化学方程式: Ca(OH)2+Na2CO3CaCO3↓+2NaOH 。
(2)滤液B中含有Na2CO3、NaOH、NaCl三种溶质。
【实验验证】为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 取少量滤液B于试管中,加入过量的Ba(NO3)2溶液,过滤 | 产生白色沉淀 | 溶质中一定含有Na2CO3 |
Ⅱ | 取少量步骤Ⅰ中所得滤液于试管中,加入酚酞溶液 | 溶液变红色 | 溶质中一定含有NaOH |
Ⅲ | 另取少量步骤Ⅰ中所得滤液于试管中,先加入足量的稀硝酸,再加入 硝酸银 溶液 | 产生白色沉淀 | 溶质中一定含有NaCl |
【拓展提升】(1)向步骤Ⅰ中加入过量Ba(NO3)2溶液的目的是 验证并除去溶液中的碳酸钠 。写出该反应的化学方程式: Na2CO3+Ba(NO3)2BaCO3↓+2NaNO3 。
(2)小妮同学认为若将步骤Ⅰ中的Ba(NO3)2溶液换为BaCl2溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理: 不合理 (填“合理”或“不合理”),理由是 换为BaCl2溶液,会引入氯离子,无法证明原溶液中是否有氯化钠 。
初中化学中考复习 2021届中考化学一轮微专题复习学案: 元素和物质的分类: 这是一份初中化学中考复习 2021届中考化学一轮微专题复习学案: 元素和物质的分类,共7页。
初中化学中考复习 2021届中考化学一轮微专题复习学案: 水和常见的溶液: 这是一份初中化学中考复习 2021届中考化学一轮微专题复习学案: 水和常见的溶液,共10页。
初中化学中考复习 2021届中考化学一轮微专题复习学案: 化学与能源和资源的利用: 这是一份初中化学中考复习 2021届中考化学一轮微专题复习学案: 化学与能源和资源的利用,共9页。学案主要包含了实验探究等内容,欢迎下载使用。