

所属成套资源:浙江省各地区2020届-2022届高考化学三年模拟试题汇编
河北省保定市2020届-2022届高考化学三年模拟(一模)试题汇编-综合、推断、流程题
展开
这是一份河北省保定市2020届-2022届高考化学三年模拟(一模)试题汇编-综合、推断、流程题,共25页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
河北省保定市2020届-2022届高考化学三年模拟(一模)试题汇编-综合、推断、流程题
一、工业流程题
1.(2020·河北保定·统考一模)随着电动自行车市场保有量的不断增加,废弃的铅酸蓄电池已变成不容忽视的一种环境污染源,处理不当会加大对大气、水和土壤的污染。用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理废旧铅酸蓄电池的流程如下:
已知:Ksp(PbSO4)=1.6×10-8和Ksp(PbCO3)=7.4×10-14
回答下列问题:
(1)废旧电池预处理时需要将电池放电完全,这样做的目的是____。
(2)写出铅膏脱硫时的离子方程式____。
(3)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是____。
(4)某同学查阅资料发现:儿童从空气中吸入的铅量是成人吸入量的1.6~1.7倍。为了探讨这个现象,展开了相关探究,他通过取样分析,得到了以下实验数据:
离地面高度
0.8
1.0
1.2
1.4
1.6
1.8
2.0
铅的浓度(μg/cm3)
1.10
0.98
0.91
0.72
0.66
0.54
0.50
①该同学探究的课题名称为____。
②分析以上实验数据,可以得出的结论是___。
③造成此结果的原因可能是____。
(5)在走访调查中,小明同学收集了某铅酸蓄电池处理厂排出的废水样品,为了判断废水中含铅的浓度是否符合排放标准,他设计了如下方案并进行了实验:
上述实验中如果缺少操作M,所测得结果会 ___(填“偏大”、“偏小”、或“无影响”)。
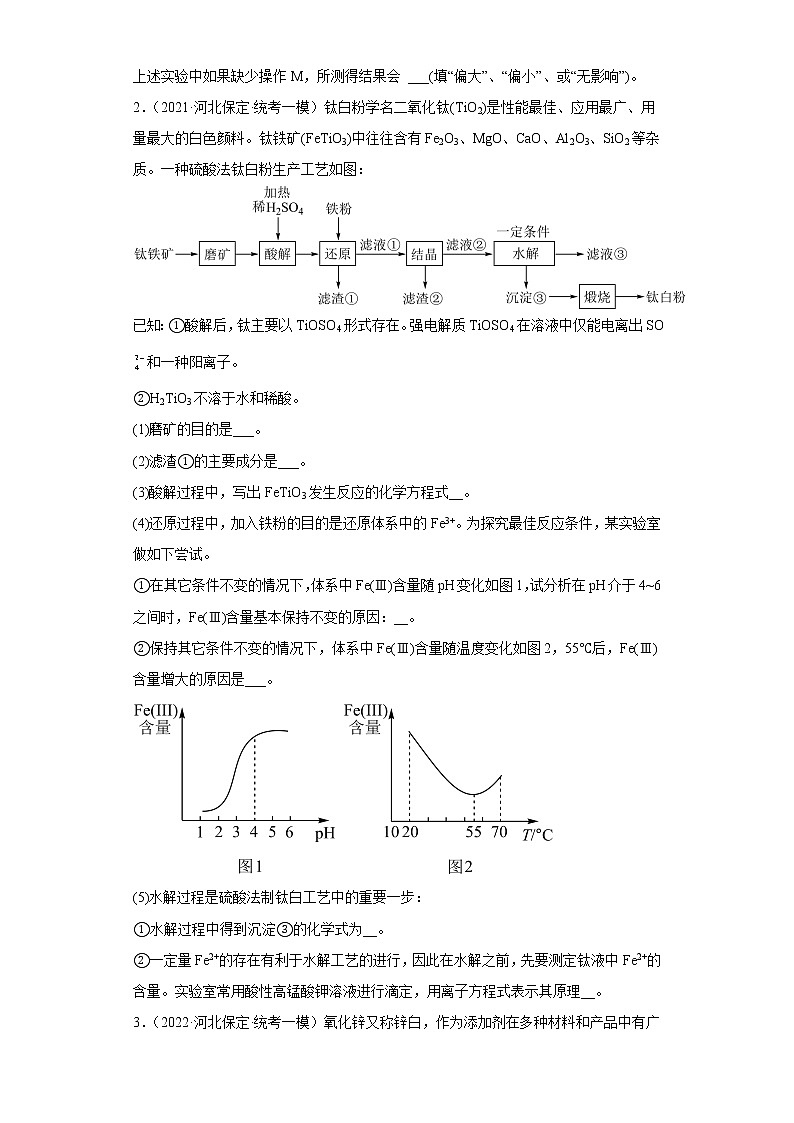
2.(2021·河北保定·统考一模)钛白粉学名二氧化钛(TiO2)是性能最佳、应用最广、用量最大的白色颜料。钛铁矿(FeTiO3)中往往含有Fe2O3、MgO、CaO、Al2O3、SiO2等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以TiOSO4形式存在。强电解质TiOSO4在溶液中仅能电离出SO和一种阳离子。
②H2TiO3不溶于水和稀酸。
(1)磨矿的目的是___。
(2)滤渣①的主要成分是___。
(3)酸解过程中,写出FeTiO3发生反应的化学方程式__。
(4)还原过程中,加入铁粉的目的是还原体系中的Fe3+。为探究最佳反应条件,某实验室做如下尝试。
①在其它条件不变的情况下,体系中Fe(Ⅲ)含量随pH变化如图1,试分析在pH介于4~6之间时,Fe(Ⅲ)含量基本保持不变的原因:__。
②保持其它条件不变的情况下,体系中Fe(Ⅲ)含量随温度变化如图2,55℃后,Fe(Ⅲ)含量增大的原因是___。
(5)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的化学式为__。
②一定量Fe2+的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中Fe2+的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理__。
3.(2022·河北保定·统考一模)氧化锌又称锌白,作为添加剂在多种材料和产品中有广泛应用。一种以锌精矿(主要成分是,还有、,等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的如下表:
物质
回答下列问题:
(1)滤渣I的主要成分除过量外,还有S和_______(填化学式)。“浸出”时,氧化的离子方程式为_______。
(2)“沉铁”时,滴加氨水需要调节最低为_______(通常认为残留在溶液中离子浓度时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是(有机萃取剂),有机萃取剂能分离和,能分离出的原因是_______。为了提高反萃取效率,反萃取剂应该呈_______(填“酸”“碱”或“中”)性。
(4)“深度净化”中加的目的是_______。
(5)①“沉锌”时,充分反应,过滤,洗涤得到碱式碳酸锌[],其反应的离子方程式为_______,检验沉淀洗涤干净的方法是_______。
②为测定碱式碳酸锌[]的组成,称取一定量的碱式碳酸锌,充分加热分解,产生的气体依次通过足量浓硫酸和碱石灰,分别增重0.72g和0.88g,则该碱式碳酸锌的化学式为_______。
二、原理综合题
4.(2020·河北保定·统考一模)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
5.(2021·河北保定·统考一模)SO2具有抗氧化、保鲜、防腐、脱色等功用,合理利用二氧化硫可服务于人们更好的生活。但空气中过量的二氧化硫会形成酸雨、易引起呼吸道疾病等问题,因此,二氧化硫的污染治理是化学研究的重要课题。
(1)“钙基固硫”的原理是燃煤时加入CaCO3或CaO以减少二氧化硫的排放,涉及的反应有:
①CaCO3(s)=CaO(s)+CO2(g)△H1=+178.2kJ·mol-1
②CaO(s)+SO2(g)=CaSO3(s)△H2=-402.0kJ·mol-1
③2CaSO3(s)+O2(g)=2CaSO4(s)△H3=-2314.8kJ·mol-1
则2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=___。
(2)石灰石—石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。根据双模理论,可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.本征反应,即在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RA;
ii.CaCO3由固相溶解进入液相,溶解速率为RB;
iii.SO2由气相扩散进入液相,扩散速率为RC。
温度变化对总反应速率的影响如图,温度在25~45℃时,总反应速率受____(填“RA”、“RB”或“RC”)控制。45~55℃曲线呈下降趋势的原因:一是CaCO3溶解度随温度的升高而降低;二是___。
(3)硝化法既能生产硫酸,也能处理二氧化硫,主要反应为:NO2(g)+SO2(g)SO3(g)+NO(g)△H”或“ 温度升高,反应速率增大 1.5 0.75
【详解】(1) ①CaCO3(s)=CaO(s)+CO2(g)△H1=+178.2kJ·mol-1②CaO(s)+SO2(g)=CaSO3(s)△H2=-402.0kJ·mol-1③2CaSO3(s)+O2(g)=2CaSO4(s)△H3=-2314.8kJ·mol-1,根据盖斯定律,△H=2×①+2×②+③=2×178.2-2×402-2314.8=-2762.4 kJ·mol-1;
(2)在较低温度中升高温度对反应速率影响较大,故温度在25~45℃时,总反应速率受RA控制;温度继续升高,会影响溶解度,则45~55℃曲线呈下降趋势的原因:一是CaCO3溶解度随温度的升高而降低;二是二氧化硫溶解度随温度升高而降低;
(3)①根据已知条件列出三段式,设加入二氧化氮和二氧化硫为1,反应消耗为x,,达到平衡时NO和NO2的浓度之比为3:1,即,解得x=0.75,平衡常数;
②,故平衡正向移动,v正>v逆;
(4)①,,故,由此得出结论,温度升高,反应速率增大;
②平衡常数受温度影响,2、3组温度一样,反应后C仍为0.4,为等效平衡,极值转化后与第二组起始量相同,第二组起始量为2,1,0,第三组为a,b,0.5,故a+0.5=2,b+0.25=1,即a=1.5,b=0.75;
6.(1)
(2) Ⅱ 温度一定,越大,的转化率越小 > 1 20% 4
(3)
【解析】(1)
由盖斯定律可知,==,故答案为:。
(2)
①由图可知,下,越大,的转化率越小,故曲线Ⅱ表示的转化率随的变化,故答案为:Ⅱ;温度一定,越大,的转化率越小。
②由于,则越大,的转化率越大,则曲线Ⅰ表示的转化率随的变化,故;曲线Ⅰ中,下的平衡转化率与曲线Ⅱ中时的平衡转化率相同,故,故答案为:>;1。
③下,时,总压为100kPa,的转化率为80%,设起始时NO和CH4的物质的量均为1mol,列出三段式,
平衡时气体总物质的量为:(0.8+0.2+0.4+0.2+0.4)mol=2mol,平衡时、、、和分别为40kPa、10kPa、10kPa、20kPa和20kPa,故的体积分数为;
时该反应的标准平衡常数,故答案为:20%;4。
(3)
电解池中阳极发生氧化反应,由题给信息可知,在碱性条件下转变为硝态氮,氮元素化合价升高,发生氧化反应,则阳极的电极反应式为,故答案为:。
7. 氨基乙酸 取代反应 硝基和羟基 + +H2O 8 2
【分析】根据流程图,A()和发生取代反应生成B(),B和磷酸在加热条件下发生取代生成C,C在一定条件下转化为,中的一个氯原子被取代转化为D;X与HCN发生加成反应生成Y,Y和氨气在一定条件下发生取代反应生成Z,Z在酸性条件下水解得到W,D和R在一定条件下反应生成E,根据E和D的结构简式,可推出R的结构简式为,由此可知W和在浓硫酸加热条件下发生酯化反应生成R,据此分析解答。
【详解】(1)W的结构简式为,结构中有羧基和氨基,化学名称为氨基乙酸;根据分析,反应①为A()和发生取代反应生成B(),反应类型为取代反应;
(2)A的结构简式为,含氧官能团的名称为硝基和羟基;
(3)根据分析,反应⑦为W和在浓硫酸加热条件下发生酯化反应生成R,R的结构简式为,化学方程式+ +H2O;
(4)B的结构简式为,①苯的二取代物且苯环上含有硝基;②可以发生水解反应,说明另一个取代基为酯基,该酯基的结构可为-OOCCH3或-COOCH3或-CH2OOCH,在苯环上与硝基分别有邻间对三种位置,分别为:、、、、、、、、,除去自身外结构外,共有8种; 上述同分异构体中核磁共振氢谱为3:2:2,说明分子中含有三种不同环境的氢原子且个数比为3:2:2,则符合要求的结构简式为 ;
(5)已知与4个不同的原子或原子团相连的碳原子称为手性碳,有机物中手性碳的位置为,有2个;的水解产物为,的结构中的-COOH可由-CN酸性条件下水解得到,而与HCN发生加成反应可生成,再结合苯甲醇催化氧化可得到苯甲醛,则合成路线为:。
8. 甲醛 加成反应 + 7 4
【分析】根据题中所给信息和A的分子式为CH2O,可推知A的结构简式为HCHO,HCHO和 发生加成反应生成B,B的结构简式为 ,B在酸性条件下脱水,生成C,C的结构简式为 ,C和发生已知所给的反应生成N,N的结构简式为 ,N水解生成D,D的结构简式为 ,D在H2SO4条件下发生重排,生成 ,由 和 逆推醇G的结构简式为 ,逆推醛F的结构简式为 ,据此解答。
【详解】(1)由上分析可知,A的结构简式为HCHO,名称为甲醛;答案为甲醛。
(2)由上分析可知,A的结构简式为HCHO,B的结构简式为 ,HCHO和 发生加成反应生成B;答案为加成反应。
(3)C的结构简式为 ,N的结构简式为 ,由C和M生成N的方程式为+;答案为+。
(4)由上分析可知,D的结构简式为 ;答案为 。
(5)由上分析可知,醛F的结构简式为 ;答案为 。
(6)B中具有 、—OH且不与NaHCO3反应,即不含羧基的同分异构体(不考虑B)有 、 、 、 、 、、 共7种,其中核磁共振氢谱有三组峰,且峰面积比为6:1:1的同分异构体的结构简式为 ,在所有的同分异构体(不考虑立体异构)中,含有手性碳原子的异构体有(标有“*”为手性C原子) 、 、 、 共4种;答案为7; ;4。
9.(1) 对硝基苯酚或4-硝基苯酚 还原反应
(2) 酯基和羰基(或酮基) 5
(3)
(4)+2Br2+2HBr
(5) 11
(6)
【解析】(1)
有机物为,苯酚为母体,硝基为取代基,的名称是:对硝基苯酚或 硝基苯酚,反应是硝基转化为氨基,组成上去氧加氢,属于还原反应,故答案为:对硝基苯酚或 硝基苯酚;还原反应
(2)
D中含氧官能团的名称为酯基和羰基(或酮基),D与足量加成后的产物为,其中标“*”的为手性碳原子;故答案为:酯基和羰基(或酮基),5
(3)
E的结构简式为。
(4)
G→H反应为 与溴发生取代反应生成,反应的化学方程式为 +。
(5)
满足条件的C的同分异构体中苯环上的基团为、、、,邻、间、对三种位置异构,共有11种;其中,核磁共振氢谱有4种吸收峰,且峰面积之比为3∶2∶2∶2的同分异构体的结构简式为。
(6)
仿照上述合成路线,以硝基苯和为原料,制备的合成路线:。
【点睛】本题以医药“阿比多尔”中间体的合成为载体,体现对有机化合物的制备、物质结构、反应类型、官能团名称、结构简式和合成路线等有机化学知识的基础性、综合性、应用性和创新性的考查。考查学生的理解与辨析、分析与推测、归纳与论证能力。
相关试卷
这是一份河北省唐山市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共22页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
这是一份河北省邯郸市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共25页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
这是一份河北省保定市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共25页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。









