

山东省聊城市2020届-2022届高考化学三年模拟(一模)试题汇编-实验、填空、结构与性质题
展开山东省聊城市2020届-2022届高考化学三年模拟(一模)试题汇编-实验、填空、结构与性质题
一、填空题
1.(2020·山东聊城·一模)钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
二、实验题
2.(2020·山东聊城·一模)乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
(1)仪器B的名称是___。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___,然后打开活塞2,关闭活塞___。
Ⅱ.制备乳酸亚铁:向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为___。为防止乳酸亚铁变质,在上述体系中还应加入___,反应结束后,从所得溶液中获得乳酸亚铁晶体的步骤如下,请将前四步正确排序(写字母序号):___,干燥。
a.过滤 b.隔绝空气,加热 c.冷却结晶 d.用适量乙醇洗涤
Ⅲ.乳酸亚铁晶体纯度的测量;
(4)用K2Cr2O7滴定法测定样晶中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0100mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
3.(2021·山东聊城·统考一模)亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂,可由ClO2为原料制取。实验室利用下图装置制备亚氯酸钠(夹持装置略),并利用滴定法测定所制亚氯酸钠的纯度。
已知:①ClO2沸点11℃,极易溶于水,浓度过高时易分解爆炸
②2NaOH+H2O2+2C1O2=2NaClO2+O2+2H2O
(1)装置A中仪器a的名称为___________,产生ClO2的化学方程式为___________。
(2)实验过程中需要持续通入稀有气体,目的是___________。
(3)装置B的作用是___________。
(4)装置C中用冰水浴冷却的目的是___________。
(5)测定亚氯酸钠的含量实验步骤:①称取亚氯酸钠样品5.0g于小烧杯中,加入适量蒸馏水和过量的KI晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成500 mL待测溶液。②移取10.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用0.10mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积为40.00mL。 (已知:ClO+4I-+4H+=2H2O+2I2+C1-、I2+2S2O=2I-+S4O)。
①达到滴定终点时的现象为___________,正确判断滴定终点后,仰视读数,会导致测定结果___________(填“偏高”或“偏低”)。
②该样品中NaClO2的纯度为___________。
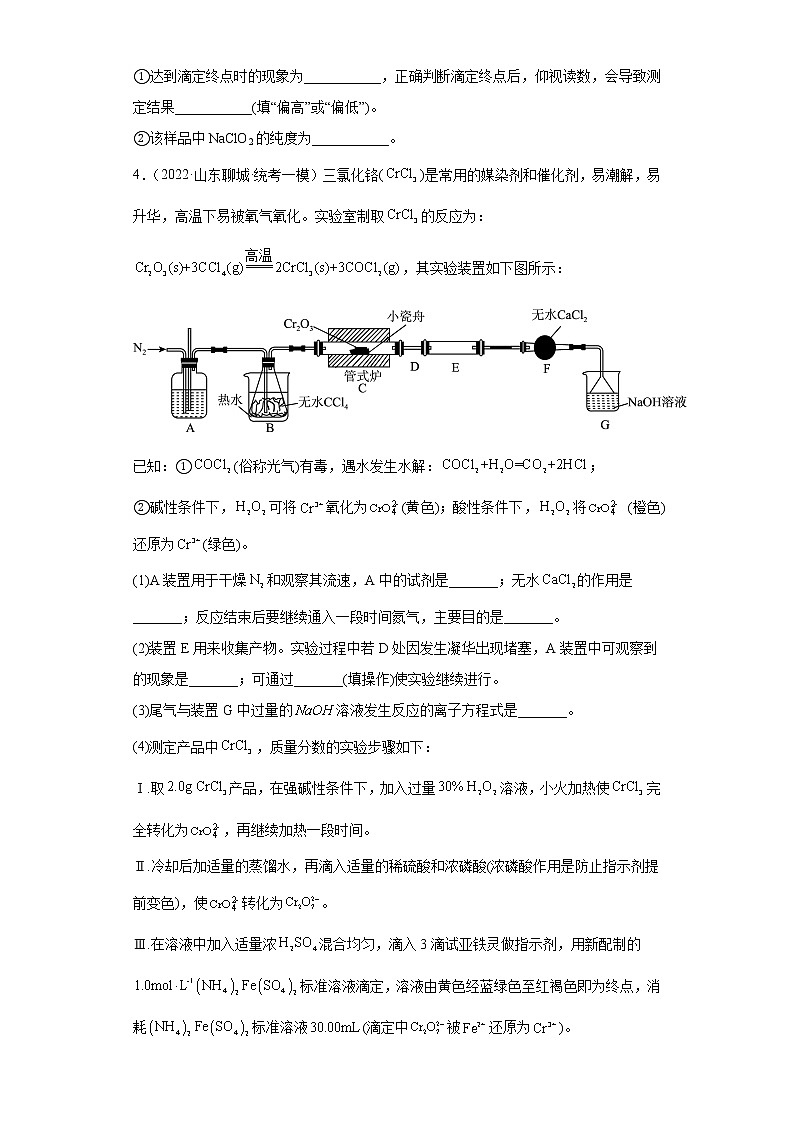
4.(2022·山东聊城·统考一模)三氯化铬()是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取的反应为:,其实验装置如下图所示:
已知:①(俗称光气)有毒,遇水发生水解:;
②碱性条件下,可将氧化为(黄色);酸性条件下,将 (橙色)还原为(绿色)。
(1)A装置用于干燥和观察其流速,A中的试剂是_______;无水的作用是_______;反应结束后要继续通入一段时间氮气,主要目的是_______。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是_______;可通过_______(填操作)使实验继续进行。
(3)尾气与装置G中过量的溶液发生反应的离子方程式是_______。
(4)测定产品中,质量分数的实验步骤如下:
Ⅰ.取产品,在强碱性条件下,加入过量溶液,小火加热使完全转化为,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使转化为。
Ⅲ.在溶液中加入适量浓混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗标准溶液(滴定中被还原为)。
①计算产品中质量分数为_______。
②下列操作将导致产品中质量分数测定值偏低的是_______(填字母标号)。
A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中溶液部分变质
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
三、结构与性质
5.(2021·山东聊城·统考一模)2020年我国“奋斗者”号载人潜水器成功进行万米海试,国产新型材料“钛”牛了!该合金中含钛、铁、镍、铂等十几种元素,具有高强度、高韧性。回答下列问题:
(1)基态Ti原子的核外电子的空间运动状态有___________种。TiF4的熔点377℃远高于TiC14(-24.12℃)的原因是___________。
(2)邻二氮菲()中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因___________。
(3)Ni与Cu的第二电离能:Ni___________Cu(填“>”或“<”)。含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有___________个,其中提供孤对电子的原子为___________(写元素符号)。
(4)①Pt与NH3能够形成顺铂与反铂两种结构,如图所示,由此可判断中心原子Pt杂化方式肯定不是sp3杂化,理由是___________。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。氯铂酸钾(K2PtC16,式量为486)的立方晶胞结构如图所示,该晶胞中部分PtC1、K+的分数坐标为PtC1 (0,0,0)、K (0.25,0.75,0.25)、K (0.75,0.25,0.25),其中A、B分别代表K+的位置。找出距离PtC1 (0,0,0)最近的K+___________(用分数坐标表示)。用NA表示阿伏加德罗常数的值,若实验测得氯铂酸钾的密度是d g·cm-3,则A、B两个K+的距离为___________pm(列出计算式即可)。
6.(2022·山东聊城·统考一模)石墨烯、高温氯化钠、砷化镉等超导材料应用广泛。回答下列问题:
(1)石墨烯结构如图1所示,则碳原子的杂化方式为_______,12 g石墨烯中含有六元环个数与σ键个数之比为_______。
(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径_______(填图中序号)迁移到空位处。
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由_______。
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为_______;与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,原因是_______。
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3,占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(,,),则③号位原子坐标参数为_______。晶胞的密度为,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为_______pm(列计算式即可)。
参考答案:
1. 相反 O>Cl>Ti 平面三角形 > 3 分子晶体 6 2 3
【分析】(1)钛为22号元素,根据价电子排布式分析;
(2)①元素原子的得电子能力越强,则电负性越大;
②根据1个单键是1个σ键,1个双键中含有1个σ键,1个π键以及COCl2分子的结构式来解答;
③通常低熔点、易溶于有机溶剂的晶体属于分子晶体;
(3)配合物[TiCl(H2O)3]Cl2·H2O中,配位体是内界的1个Cl-和5个H2O;
(4)根据均摊法结合晶胞数据分析解答。
【详解】(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,原子核外最外层电子数为2,自旋状态相反;
(2)①元素原子的得电子能力越强,则电负性越大,所以O>Cl>Ti;
②COCl2的结构为,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形;
在COCl2分子中, C原子为sp2杂化,虽然等性sp2杂化的键角是120°。但由于C原子与O原子间以双键C=O结合,该双键对C-Cl键的斥力要更大些。所以,∠O-C-Cl键角要大于∠Cl-C-Cl键角;答案为>;
COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键数目为1,个数之比为3:1;
③通常低熔点、易溶于有机溶剂的晶体属于分子晶体,则TiCl4的晶体类型为分子晶体;
(3)配合物[TiCl(H2O)5]Cl2·H2O中,配位体是内界的1个Cl-和5个H2O,中心离子的配位数是6,作为配体的Cl-难以电离出来与Ag+发生反应,故向1mol该配合物中加入足量AgNO3溶液,可以得到2molAgCl沉淀;
(4)根据均摊法,晶胞中有2个原子和4个O原子,因此晶胞质量=,晶胞体积=459,因此,晶胞密度=。
2. 蒸馏烧瓶 排尽装置内的空气,防止二价铁被氧气氧化 1、3 2CH3CH(OH)COOH+FeCO3=[CH3CH(OH)COO]2Fe+CO2↑+H2O 适量铁粉 bcad 57.6%
【分析】结合仪器构造和用途书写仪器;加入适量稀硫酸反应一段时间,生成氢气,排除空气,排除空气后,将亚铁离子引入到后面装置中与碳酸氢根发生反应生成碳酸亚铁;乳酸和碳酸亚铁反应生成乳酸亚铁和二氧化碳,加入铁粉防止乳酸亚铁变质,反应结束后,要避免乳酸亚铁被氧气,由于乳酸亚铁不溶于乙醇,因此用适量乙醇洗涤;根据关系式计算乳酸亚铁的物质的量,再计算纯度。
【详解】(1) 仪器B是带支管的烧瓶,名称是蒸馏烧瓶;
(2) 实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,生成氢气,排除空气,其目的是:排尽装置内的空气,防止二价铁被氧气氧化;然后打开活塞2,关闭活塞1、3;
(3) 乳酸和碳酸亚铁反应生成乳酸亚铁和二氧化碳,其反应化学方程式为2CH3CH(OH)COOH+FeCO3=[CH3CH(OH)COO]2Fe+CO2↑+H2O;为防止乳酸亚铁变质,在上述体系中还应加入适量铁粉;反应结束后,从所得溶液中获得乳酸亚铁晶体,主要避免乳酸亚铁被氧气氧化,因此要隔绝空气,低温蒸干,过滤后再用适量乙醇洗涤,所以排序为:bcad ;
(4) 根据电子守恒,铁化合价由+2升高到+3,铬由+6降低到+3,可得关系为
解得n( Fe2+) = 1.2×10-3mol
乳酸亚铁晶体的纯度为: 。
【点睛】计算时直接由电子守恒、元素化合价的变化得到反应的关系式,不一定要通过化学方程式来进行计算,同时注意量的10倍关系。
3. 分液漏斗 2NaClO3+Na2SO3+H2SO4(浓)=2Na2SO4+2ClO2↑+H2O 稀释ClO2,防止发生危险(爆炸) 作安全瓶(或缓冲瓶),防止C中液体倒吸进入装置A中 减少H2O2分解(或减少ClO2的挥发) 溶液蓝色刚好褪去,且半分钟内颜色不再变化 偏高 90.5%。
【分析】本题实验目的是制备氯酸钠,原理是2NaOH+H2O2+2C1O2=2NaClO2+O2+2H2O,A装置为制备ClO2,B装置为安全瓶,C装置为制备氯酸钠,D装置的作用是吸收ClO2,纯净的ClO2易爆炸。
【详解】(1) 装置A中仪器a的名称为分液漏斗;产生ClO2的化学方程式为2NaClO3+Na2SO3+H2SO4(浓)=2Na2SO4+2ClO2↑+H2O;
(2) ClO2浓度过高,易发生爆炸,故实验过程中通入稀有气体的目的是稀释ClO2,防止发生危险(爆炸);
(3)仪器B是安全瓶,防止C中液体倒吸进入A中;
(4) ClO2高温易挥发,制取NaClO2时用到双氧水,双氧水高温易分解,挥发藕汁产率降低,因此冰水浴可以减少双氧水的分解;
(5)①淀粉遇碘变蓝,滴定终点时溶液蓝色褪去,且半分钟内颜色不再变化,故达到滴定终点时的现象为溶液蓝色刚好褪去,且半分钟内颜色不再变化;正确判断滴定终点后,仰视读数,会导致测定结果偏高;
②NaClO2被还原为氯离子,碘离子被氧化为I2,由得失电子守恒:,结合题目所给反应式可得:,所得粗品的纯度为。
4.(1) 浓 防止G中水蒸气进人E装置 将和分别充分排入装置E和G中
(2) A中导管内液面上升 对D处稍加热
(3)
(4) 79.25% AB
【分析】实验室制取CrCl3的反应为CnO3(s)+3CCl4(g)2CrCl3(s)+3COCl2(g),CrCl3 易潮解高温下易被氧气氧化,所以要防止装置内在高温条件下不能存在空气,反应结束后继续通入一段时间氮气,让CrCl3在氮气氛围中冷却,防止空气进入使CrCl3氧化,A中装浓H2SO4干燥N2并防止空气中水蒸气进入C装置;无水CaCl2防止G中水蒸气进入E及C装置;反应结束后继续通入一段时间氮气,将CrCl3充分排入装置E,将COCl2排入装置G中并被充分吸收,回收尾气,以此来解析;
【详解】(1)根据题目信息:CrCl3 易潮解高温下易被氧气氧化,所以要防止装置内在高温条件下不能存在空气,反应结束后继续通入一段时间氮气,主要目的是让CrCl3在氮气氛围中冷却,防止空气进入使CrCl3氧化;A中装浓H2SO4,作用是干燥N2并防止空气中水蒸气进入C装置,无水CaCl2的作用是防止中水蒸气进入E及C装置;反应结束后继续通入一段时间氮气,将CrCl3充分排入装置E,将COCl2排入装置G中并被充分吸收,回收尾气;
(2)若D处出现堵塞,则C装置内压强增大,A中导管内液面上升; D处堵塞是因CrCl3升华后在D处凝聚而产生的,故可对D处稍加热,使实验能继续进行;
(3)装置G中可以看做是COCl2先与水反应生成二氧化碳和氯化氢,二氧化碳和氯化氢再与氢氧化钠反应,根据电荷守恒和原子守恒,可得反应的离子方程式为:COCl2+4OH-=CO + 2C1-+2H2O;
(4)①
根据得失电子守恒和原子守恒可得测定过程中的物质的量的关系为:2CrCl3~2CrO~Cr2O~6(NH)4Fe(SO4)2,(NH)4Fe(SO4)2的物质的量:n=cV=30.00×10-3L×1.0mol⋅L-1=3×10-2mol,测定产品中CrCl3质量分数为:=79.25%;
②
A.步骤I未继续加热一段时间,过量的H2O2在步骤I中会将Cr2O还原为Cr3+,则滴定时消耗标准溶液(NH)4Fe(SO4)2体积减小,测定的CrCl3质量分数偏低,A符合题意;
B.由提示可知,步骤Ⅱ中用盐酸代替硫酸,由于Cl-具有还原性,会反应消耗Cr2O,导致(NH)4Fe(SO4)2消耗的体积偏小,读取标准液体积小于实际,测出的CrCl3质量分数偏低,B符合题意;
C.步骤I中所(NH)4Fe(SO4)2已变质,则滴定用标准液体积偏大,测出的CrCl3质量分数偏高,C不符合题意;
D.步骤中读数时滴定前俯视(读数偏小),滴定后平视,读取标准液的体积偏大,测出的CrCl3质量分数偏高,D不符合题意;
故选AB。
5. 12 TiF4晶体为离子晶体,TiC14晶体为分子晶体 当H+浓度高时,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;若OH-浓度较高时,OH-与Fe2+反应,也会影响与邻二氮菲配位 < 6 N、O 若Pt以sp3杂化轨道成键,分子应为四面体结构,则不存在顺铂和反铂同分异构现象 (0.25,0.25,0.25)
【详解】(1)基态Ti原子核外电子排布式为1s22s22p63s23p63d24s2,s轨道有一种空间运动状态,p轨道有三种空间运动状态,d轨道有五种空间运动状态,3d轨道只有两个电子,有两种空间运动状态,因此基态Ti原子的核外电子的空间运动状态有12种;TiF4晶体为离子晶体,TiC14晶体为分子晶体,所以TiF4的熔点远高于TiC14的熔点;
(2)当H+浓度高时,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;若OH-浓度较高时,OH-与Fe2+反应,也会影响与邻二氮菲配位,所以适宜pH范围为2~9;
(3)Ni与Cu的第二电离能:Ni<Cu,因为Ni失去的是4s1电子,铜失去的是全充满的3d10电子,全充满结构稳定,铜不易失去3d轨道上的电子,所以Cu的第二电离能较大;由题可知,只有成环的配位键才能起到螯合作用,再结合题目中所给的结构可以知道,1个该配合物中通过螯合作用形成的配位键有6个;由结构图可知,提供孤对电子的原子为N、O;
(4)①若Pt以sp3杂化轨道成键,分子应为四面体结构,则不存在顺铂和反铂同分异构现象;
②距离PtC1 (0,0,0)最近的K+(0.25,0.25,0.25);由题意K (0.25,0.75,0.25),而晶胞边长为1,一个晶胞有4个,8个钾离子,设棱长为acm,一个晶胞质量为,体积为a3cm3,故d=,=×1010pm,K (0.25,0.75,0.25)、K (0.75,0.25,0.25),AB=,则A、B两个K+的距离为。
6.(1) sp2 1∶3
(2)Ⅰ
(3)HCOOH沸点较高,因为HCOOH分子之间存在氢键
(4) 4d105s2 原子半径N<P,电负性N>P,NH3更易结合水中的H+而电离出OH-
(5) (,1,)
【解析】(1)
在石墨烯结构中每个C原子与相邻的3个C原子形成共价键,因此C原子杂化类型是sp2杂化;
在一个正六边形中含有6个C原子,每个C原子与相邻的3个C原子形成3个C-C共价键,为相邻的3个正六边形所共有,则1个小六边形中含有的C原子数目是6×=2,每个C-C共价键都是σ键,是相邻的2个C原子形成,故平均1个六边形含有2个C原子,含有3个σ键;12 g 石墨烯中C的物质的量是1 mol,则其中含有六元环物质的量是0.5 mol,含有σ键物质的量是1.5 mol,因此12 g石墨烯中含有六元环个数与σ键个数之比为0.5 mol:1.5 mol=1:3;
(2)
导电性增强的原因:该晶体导电时,Na+在电场作用下迁移到空位上,形成电流;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+不可能通过途径II迁移到空位处,则是Na+最可能通过途径I迁移到空位处;
(3)
HCHO、HCOOH都是由分子通过分子间作用力结合形成的分子晶体,由于HCOOH的分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引作用,导致HCOOH的沸点比只存在分子间作用力的HCHO高;
(4)
Zn是第四周期四IIB元素,原子核外价电子排布式是3d104s2,则与Zn同一族且处于相邻周期的Cd元素的基态原子的价电子排布式为4d105s2;
由于原子半径:N<P,元素的电负性:N>P,则NH3更易结合水中的H+而电离出OH-,因此溶液的碱性:NH3强于PH3;
(5)
如图的原子坐标系,①号位在底面的投影应位于底面对角线的处,根据①号位的坐标为(,,) ,可知该坐标系中晶胞的棱长为1,③号位碳原子在底面的投影位于底面棱心上,所以x、y坐标为、1;③号位碳原子位于右侧面的面心,所以z坐标为,则该原子的坐标为(,1,);
根据均摊法,该晶胞中As原子个数为:8×+6×=4,含有Cd原子数为6个,该晶胞中距离最远的两个Cd原子之间的距离为体对角线的。假设晶胞边长为a pm,则根据晶胞密度计算公式可得ρ=,a=×1010 pm,故该晶胞中距离最远的两个Cd原子之间的距离为L=pm。
山东省济南市2020届-2022届高考化学三年模拟(二模)试题汇编-实验、填空、结构与性质题: 这是一份山东省济南市2020届-2022届高考化学三年模拟(二模)试题汇编-实验、填空、结构与性质题,共18页。试卷主要包含了填空题,实验题,结构与性质等内容,欢迎下载使用。
内蒙古呼和浩特市2020届-2022届高考化学三年模拟(一模)试题汇编-实验、填空、结构与性质题: 这是一份内蒙古呼和浩特市2020届-2022届高考化学三年模拟(一模)试题汇编-实验、填空、结构与性质题,共17页。试卷主要包含了填空题,计算题,实验题,结构与性质等内容,欢迎下载使用。
河南省郑州市2020届-2022届高考化学三年模拟(一模)试题汇编-实验、填空、结构与性质题: 这是一份河南省郑州市2020届-2022届高考化学三年模拟(一模)试题汇编-实验、填空、结构与性质题,共15页。试卷主要包含了填空题,实验题,元素或物质推断题等内容,欢迎下载使用。












