
所属成套资源:浙江省各地区2020届-2022届高考化学三年模拟试题汇编
江苏省南京市、盐城市2020届-2022届高考化学三年模拟(二模)试题汇编-填空、实验题
展开
这是一份江苏省南京市、盐城市2020届-2022届高考化学三年模拟(二模)试题汇编-填空、实验题,共7页。试卷主要包含了填空题,实验题等内容,欢迎下载使用。
一、填空题
1.(2020·江苏·统考二模)配合物X{[Cu(phen)(Thr)(H2O)]ClO4}能够通过插入或部分插入的模式与DNA作用,它可由Cu(ClO4)2、HThr(结构简式如图l所示)、phen等为原料制备。
(1)Cu2+基态电子排布式为___。
(2)ClO4-的空间构型为__(用文字描述),与ClO4-互为等电子体的一种分子的化学式为___。
(3)HThr分子中,碳原子的杂化类型为___;1mlHThr中含有σ键的数目为___。
(4)配合物X中配离子的结构如图2所示,则配位原子为___(填元素符号)。
2.(2021·江苏·统考二模)氧化还原法、沉淀法等是常用于治理水体污染的重要化学方法。
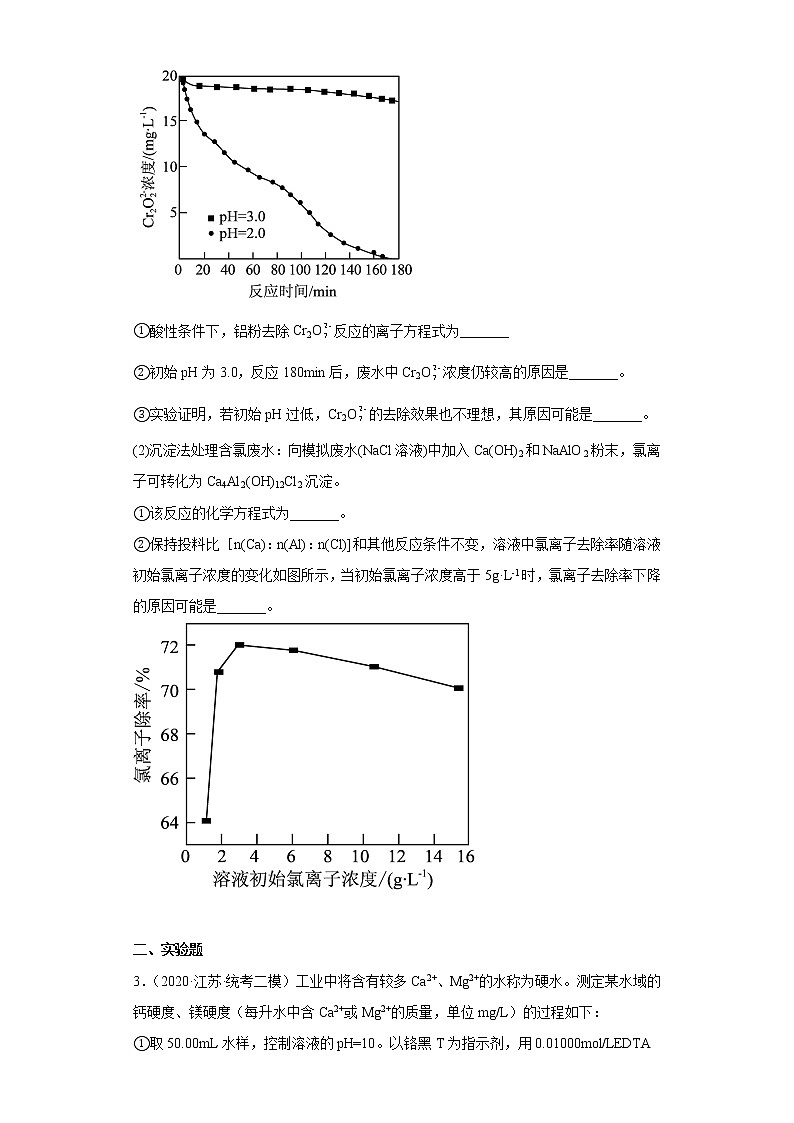
(1)还原法处理含铬废水:铝粉可将废水中的Cr2O还原为Cr3+。如图所示,废水的不同初始pH对Cr2O去除效果有重要影响。
①酸性条件下,铝粉去除Cr2O反应的离子方程式为_______
②初始pH为3.0,反应180min后,废水中Cr2O浓度仍较高的原因是_______。
③实验证明,若初始pH过低,Cr2O的去除效果也不理想,其原因可能是_______。
(2)沉淀法处理含氯废水:向模拟废水(NaCl溶液)中加入Ca(OH)2和NaAlO2粉末,氯离子可转化为Ca4Al2(OH)12Cl2沉淀。
①该反应的化学方程式为_______。
②保持投料比[n(Ca):n(Al):n(Cl)]和其他反应条件不变,溶液中氯离子去除率随溶液初始氯离子浓度的变化如图所示,当初始氯离子浓度高于5g·L-1时,氯离子去除率下降的原因可能是_______。
二、实验题
3.(2020·江苏·统考二模)工业中将含有较多Ca2+、Mg2+的水称为硬水。测定某水域的钙硬度、镁硬度(每升水中含Ca2+或Mg2+的质量,单位mg/L)的过程如下:
①取50.00mL水样,控制溶液的pH=10。以铬黑T为指示剂,用0.01000ml/LEDTA标准溶液滴定硬水中钙和镁的总含量至终点,消耗EDTA标准溶液30.00mL。
②另取50.00mL水样,加入10%NaOH溶液至pH=12.5,加入钙指示剂,用001000ml/LEDTA标准溶液滴定硬水中钙的含量至终点,消耗EDTA标准溶液20.00mL。
已知:Ca2+、Mg2+与EDTA反应的化学汁量比均为1:1。
(1)向硬水中加入石灰,可使Ca2+、Mg2+沉淀,以达到软化硬水的目的,写出Ca(OH)2和Ca(HCO3)2反应的化学方程式:___。
(2)“加入10%NaOH溶液至pH=12.5”的目的是___。
(3)计算该水样的钙硬度、镁硬度(写出计算过程)___。
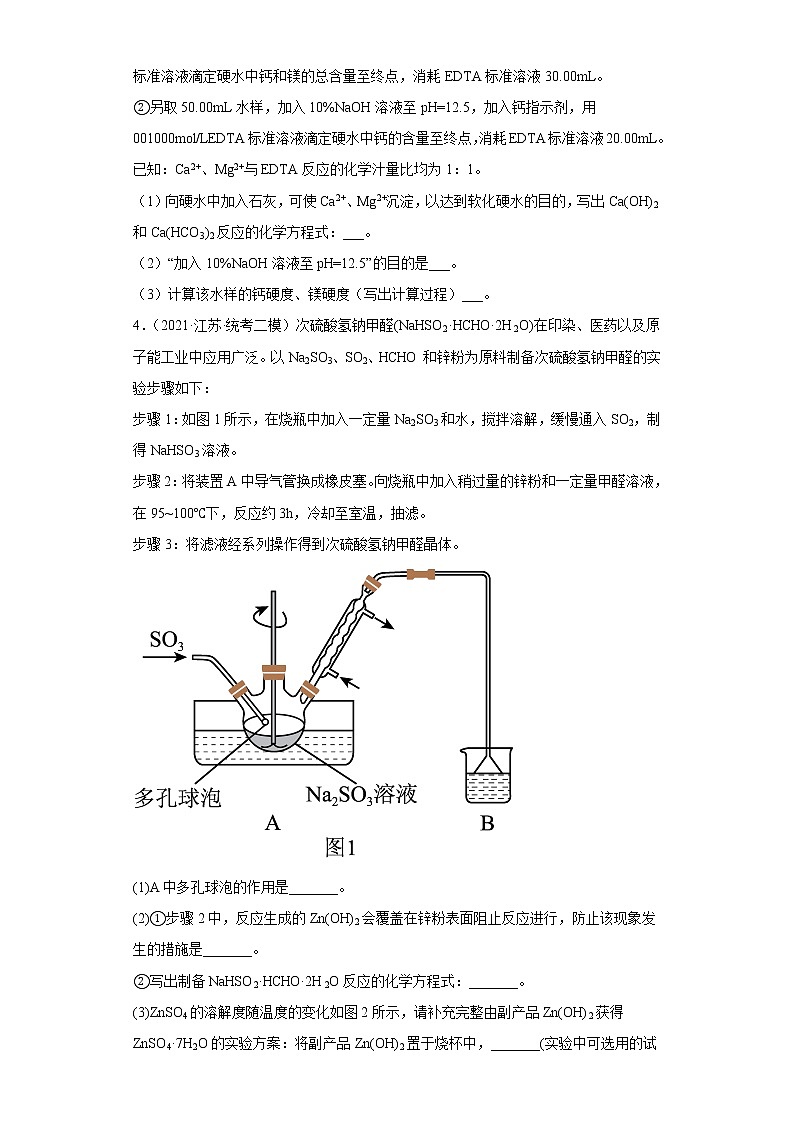
4.(2021·江苏·统考二模)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:如图1所示,在烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在95~100℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液经系列操作得到次硫酸氢钠甲醛晶体。
(1)A中多孔球泡的作用是_______。
(2)①步骤2中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是_______。
②写出制备NaHSO2·HCHO·2H2O反应的化学方程式:_______。
(3)ZnSO4的溶解度随温度的变化如图2所示,请补充完整由副产品Zn(OH)2获得ZnSO4·7H2O的实验方案:将副产品Zn(OH)2置于烧杯中,_______(实验中可选用的试剂:稀硫酸、无水乙醇)。
(4)通过下列方法测定产品纯度:准确称取2.000 g NaHSO2·HCHO·2H2O样品,完全溶于水配成100.00mL溶液,取20.00mL于碘量瓶中,加入50.00 mL 0.09000 ml·L-1 I2标准溶液,振荡,于暗处充分反应。以淀粉溶液为指示剂,用0.1000 ml·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液 10.00mL。测定过程中发生下列反应:NaHSO2·HCHO·2H2O+2I2=NaHSO4+4HI+HCHO,2S2O+I2=S4O+2I-
计算NaHSO2·HCHO·2H2O样品的纯度(写出计算过程)_______。
参考答案:
1. 1s22s22p63s23p63d9或者[Ar] 3d9 正四面体形 CCl4等 sp2、sp3 16ml或16×6.02×1023个 O、N
【详解】(1)Cu为29号元素,失去2e-得到Cu2+,则Cu2+基态电子排布式为1s22s22p63s23p63d9或者[Ar] 3d9,故答案为:1s22s22p63s23p63d9或者[Ar] 3d9;
(2) ClO4-的孤电子对数= ,则ClO4-的空间构型为正四面体形,与ClO4-互为等电子体的有CCl4等,故答案为正四面体形;CCl4;
(3) 分子中C原子含有双键和单键,则C的杂化方式有:sp2、sp3,1个HThr中含有16个σ键,则1mlHThr中含有σ键的数目为:16ml或16×6.02×1023个,故答案为:sp2、sp3;16ml或16×6.02×1023个;
(4)根据配合物X中配离子的结构可知,配合物X中配离子的配位原子为O、N,故答案为:O、N。
2. Al的还原性较弱 pH过低,Al和H+反应生成Al3+ Cl-浓度较高时,使得OH-浓度较高,Ca2+、在溶液中浓度降低,导致氯离子去除率下降
【详解】(1)①酸性条件下,铝粉可将废水中的Cr2O还原为Cr3+,化学方程式为:;
②pH为3.0,Al的还原性较弱;
③pH过低,溶液中H+含量较高,Al和H+反应生成Al3+,导致Cr2O的去除效果不理想;
(2)①NaCl溶液、Ca(OH)2和NaAlO2反应生成Ca4Al2(OH)12Cl2沉淀,化学方程式为:;
②保持投料比[n(Ca):n(Al):n(Cl)] 和其他反应条件不变,当初始氯离子浓度高于5g·L-1时,,Cl-浓度较高时,使得OH-浓度较高,Ca2+、在溶液中浓度降低,导致氯离子去除率下降。
3. Ca(OH)2+Ca(HCO3)===2CaCO3↓+2H2O 使Mg2+转化为Mg(OH)2的沉淀,不干扰钙含量的测定 n(Ca2+)=0.01000 ml·L-1×20.00 mL×10—3 L·mL—1 = 2.000×10—4 ml
钙硬度为:
n(Mg2+)=0.01000 ml·L-1×(30.00-20.00) mL×10—3 L·mL—1 = 1.000×10—4 ml
镁硬度为:
【详解】(1)Ca(OH)2和Ca(HCO3)2发生复分解反应,反应方程式为:Ca(OH)2+Ca(HCO3)===2CaCO3↓+2H2O,故答案为:Ca(OH)2+Ca(HCO3)===2CaCO3↓+2H2O
(2)加入10%NaOH溶液至pH=12.5的目的是调节pH,使Mg2+转化为Mg(OH)2的沉淀故答案为:使Mg2+转化为Mg(OH)2的沉淀,不干扰钙含量的测定;
(3)因为钙硬度、镁硬度为每升水中含Ca2+或Mg2+的质量,根据题干信息可以得出n(Ca2+)=0.01000 ml·L-1×20.00 mL×10—3 L·mL—1 = 2.000×10—4 ml,n(Mg2+)=0.01000 ml·L-1×(30.00-20.00) mL×10—3 L·mL—1 = 1.000×10—4 ml,根据m=n·M得,
m(Ca2+)= ,
m(Mg2+)= ,
钙硬度为:,镁硬度为:;故答案为:
n(Ca2+)=0.01000 ml·L-1×20.00 mL×10—3 L·mL—1 = 2.000×10—4 ml
钙硬度为:
n(Mg2+)=0.01000 ml·L-1×(30.00-20.00) mL×10—3 L·mL—1 = 1.000×10—4 ml
镁硬度为:。
4. 增大接触面积,使SO2充分反应 快速搅拌 加入适量稀硫酸使沉淀溶解,通过蒸发浓缩,冷却结晶,控制温度在20℃-39℃之间,使ZnSO4·7H2O析出,用乙醇进行洗涤,干燥后得到ZnSO4·7H2O晶体 77.00%
【分析】步骤1:在烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,Na2SO3、H2O、SO2反应生成NaHSO3,A中多孔球泡的是为了增大接触面积,使SO2充分反应;步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在95~100℃下,反应约3h ,NaHSO3溶液、锌粉和甲醛反应生成NaHSO2·HCHO·2H2O和,化学方程式为:。
【详解】(1)A中多孔球泡的作用是可以增大接触面积,使SO2充分反应;
(2)①通过快速搅拌可防止Zn(OH)2会覆盖在锌粉的表面;
②NaHSO3溶液、锌粉和甲醛反应生成NaHSO2·HCHO·2H2O和,化学方程式为:;
(3)由副产品Zn(OH)2获得ZnSO4·7H2O的实验方案:将副产品Zn(OH)2置于烧杯中,加入适量稀硫酸使沉淀溶解,通过蒸发浓缩,冷却结晶,控制温度在20℃-39℃之间,使ZnSO4·7H2O析出,用乙醇进行洗涤,干燥后得到ZnSO4·7H2O晶体。
(4)用0.1000 ml·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液 10.00mL,根据离子方程式2S2O+I2=S4O+2I-可知,与NaHSO2·HCHO·2H2O反应后剩余的I2的物质的量为,反应前加入50.00 mL 0.09000 ml·L-1 I2标准溶液,由此可计算出与NaHSO2·HCHO·2H2O反应消耗I2的物质的量为,根据化学方程式NaHSO2·HCHO·2H2O+2I2=NaHSO4+4HI+HCHO,算出NaHSO2·HCHO·2H2O的物质的量为,其纯度为,总计算过程为。
相关试卷
这是一份山东省济南市2020届-2022届高考化学三年模拟(二模)试题汇编-实验、填空、结构与性质题,共18页。试卷主要包含了填空题,实验题,结构与性质等内容,欢迎下载使用。
这是一份江苏省苏锡常镇四市2020届-2022届高考化学三年模拟(二模)试题汇编-实验、填空、结构与性质题,共12页。试卷主要包含了填空题,实验题,结构与性质等内容,欢迎下载使用。
这是一份江苏省南京市、盐城市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共22页。试卷主要包含了工业流程题,有机推断题,原理综合题等内容,欢迎下载使用。









