
所属成套资源:浙江省各地区2020届-2022届高考化学三年模拟试题汇编
山东省日照市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题2
展开
这是一份山东省日照市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题2,共12页。试卷主要包含了实验题,结构与性质等内容,欢迎下载使用。
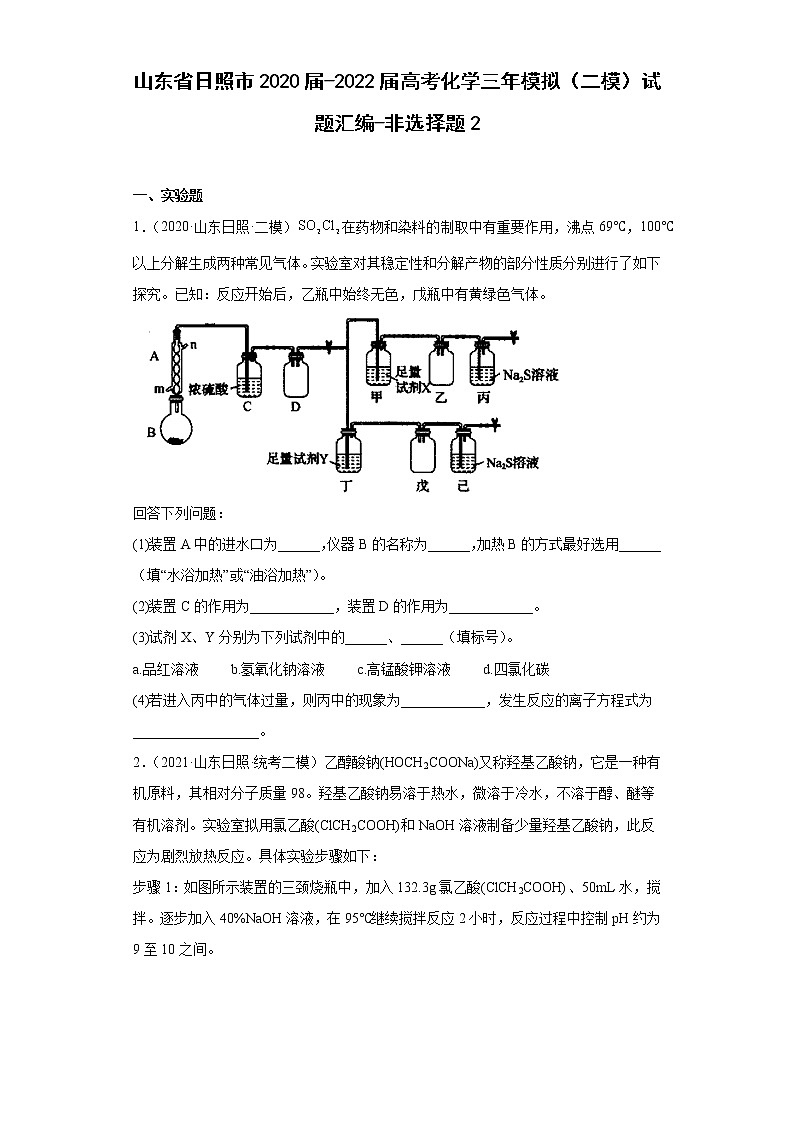
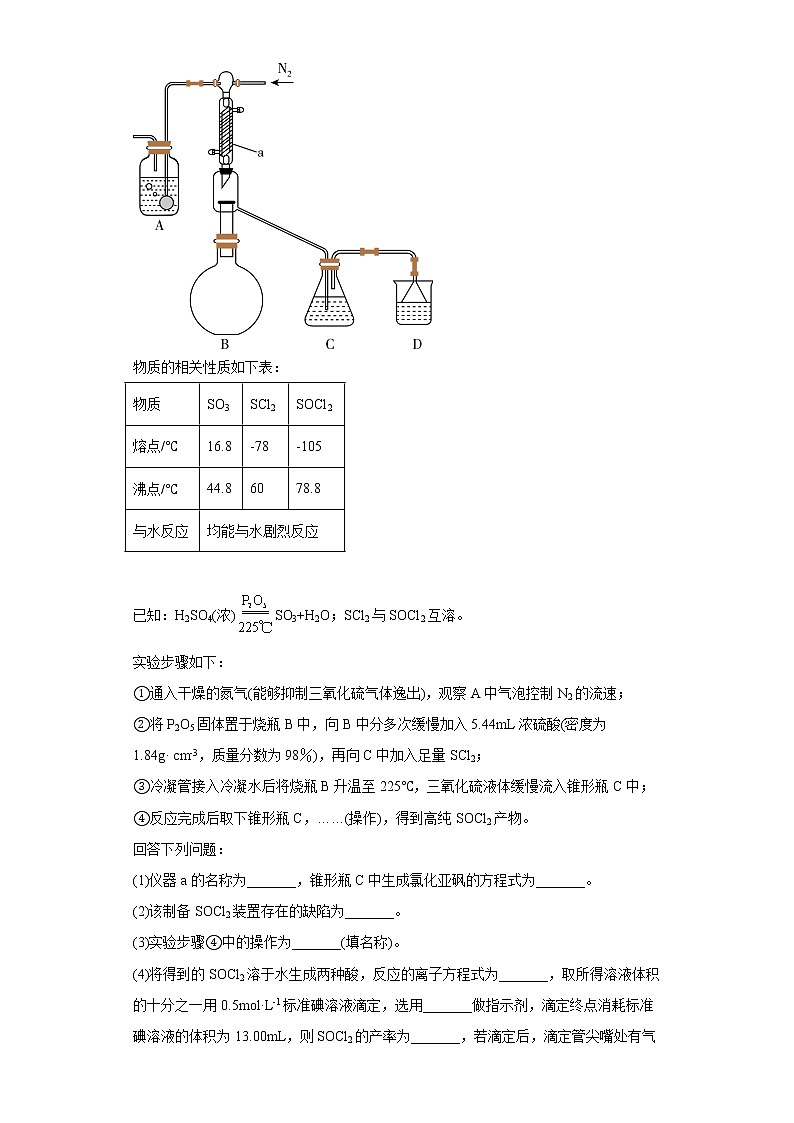
山东省日照市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题2 一、实验题1.(2020·山东日照·二模)在药物和染料的制取中有重要作用,沸点69℃,100℃以上分解生成两种常见气体。实验室对其稳定性和分解产物的部分性质分别进行了如下探究。已知:反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体。回答下列问题:(1)装置A中的进水口为______,仪器B的名称为______,加热B的方式最好选用______(填“水浴加热”或“油浴加热”)。(2)装置C的作用为____________,装置D的作用为____________。(3)试剂X、Y分别为下列试剂中的______、______(填标号)。a.品红溶液 b.氢氧化钠溶液 c.高锰酸钾溶液 d.四氯化碳(4)若进入丙中的气体过量,则丙中的现象为____________,发生反应的离子方程式为__________________。2.(2021·山东日照·统考二模)乙醇酸钠(HOCH2COONa)又称羟基乙酸钠,它是一种有机原料,其相对分子质量98。羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。实验室拟用氯乙酸(ClCH2COOH)和NaOH溶液制备少量羟基乙酸钠,此反应为剧烈放热反应。具体实验步骤如下:步骤1:如图所示装置的三颈烧瓶中,加入132.3g氯乙酸(ClCH2COOH)、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9至10之间。步骤2:蒸出部分水至液面有薄膜,加少量热水,操作1。滤液冷却至15℃,过滤得粗产品。步骤3:粗产品溶解于适量热水中,加活性炭脱色,操作2,分离掉活性炭。步骤4:将去除活性炭后的溶液加到适量乙醇中,操作3、过滤、干燥,得羟基乙酸钠。请回答下列问题:(1)仪器A的名称为_______。步骤1中,发生反应的化学方程式是_______。(2)如图所示的装置中仪器B为球形冷凝管,下列说法不正确的是_______(填字母)。A.球形冷凝管与直形冷凝管相比,冷却面积更大,效果更好B.球形冷凝管既可以做倾斜式蒸馏装置,也可用于垂直回流装置,应用广泛C.在使用冷凝管进行蒸馏操作时,一般蒸馏物的沸点越高,蒸气越不易冷凝(3)逐步加入40%NaOH溶液的目的是_______,_______。(4)步骤2中,三颈烧瓶中如果忘加磁转子该如何操作:_______。(5)上述步骤中,操作1、2、3的名称分别是_______(填字母)。A.过滤,过滤,冷却结晶B.趁热过滤,过滤,蒸发结晶C.趁热过滤,趁热过滤,冷却结晶(6)步骤4中,得纯净羟基乙酸钠1.1mol,则实验产率为_______%(结果保留1位小数)。3.(2022·山东日照·统考二模)氯化亚砜(SOCl2)具有较强的巯基和羟基取代能力,广泛应用于有机合成中。工业上可以利用SO3与SCl2反应制得,装置如下图所示(夹持及加热装置已略去):物质的相关性质如下表:物质SO3SCl2SOCl2熔点/℃16.8-78-105沸点/℃44.86078.8与水反应均能与水剧烈反应 已知:H2SO4(浓)SO3+H2O;SCl2与SOCl2互溶。实验步骤如下:①通入干燥的氮气(能够抑制三氧化硫气体逸出),观察A中气泡控制N2的流速;②将P2O5固体置于烧瓶B中,向B中分多次缓慢加入5.44mL浓硫酸(密度为1.84g· cm-3,质量分数为98%),再向C中加入足量SCl2;③冷凝管接入冷凝水后将烧瓶B升温至225℃,三氧化硫液体缓慢流入锥形瓶C中;④反应完成后取下锥形瓶C,……(操作),得到高纯SOCl2产物。回答下列问题:(1)仪器a的名称为_______,锥形瓶C中生成氯化亚砜的方程式为_______。(2)该制备SOCl2装置存在的缺陷为_______。(3)实验步骤④中的操作为_______(填名称)。(4)将得到的SOCl2溶于水生成两种酸,反应的离子方程式为_______,取所得溶液体积的十分之一用0.5mol·L-1标准碘溶液滴定,选用_______做指示剂,滴定终点消耗标准碘溶液的体积为13.00mL,则SOCl2的产率为_______,若滴定后,滴定管尖嘴处有气泡,则测定结果_______(填“偏高”“偏低”或“不变”)。 二、结构与性质4.(2020·山东日照·二模)氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:(1)瑞德西韦是一种抗病毒药物,结构如下。该结构中N、O、P原子的电负性由大到小的顺序为____________。该药物的分子间作用力有____________。(2)(异环磷酰胺)常用作抗癌药,1mol该物质含键数目为______NA。(3)实验测得中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。(4)可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,的空间构型为____________。(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为____________,该晶体的密度为,晶体中白磷分子之间的最短距离为____________cm(用含、NA的式子表示)。5.(2021·山东日照·统考二模)Fe、Co、Ni 是几种重要的金属元素。请回答下列问题:(1)基态 Ni 原子的价电子排布式为_______。(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4 是_______分子(填“极性”或“非极性”)。(3)实验室常用 KSCN 溶液或苯酚()检验。①第一电离能:N_______O(填“>”或“<”)②苯酚中碳原子杂化类型为_______。(4)配位化合物中心原子Co的配位数为_______,配位原子为_______。(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的填充在正四面体空隙中,和另一半填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为_______。(6)已知 Ni可以形成多种氧化物,其中一种 NixO 晶体的晶胞结构为 NaCl 型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为_______g·cm-3(NA 表示阿伏加德罗常数的值,只需列出表达式)。6.(2022·山东日照·统考二模)金属钴及其化合物在航天、航空、航海和催化剂等领域发挥着重要的作用。回答下列问题:(1)基态钴原子的价电子排布式为_______,其最高能层电子云轮廓图为_______形。(2)钴能够形成以钴中心原子的多种配位化合物。①CO分子作为配体时,碳原子和氧原子均能够提供孤电子对。CO与钴形成配位化合物时,提供孤电子对的为_______原子(填元素名称)。②高氯酸六氨合钴(II)的结构为。其外界离子的空间构型为_______;下列对[Co(NH3)6]2+的中心原子采取的杂化类型判断合理的是_______(填标号)。A.sp3 B.sp3d C.sp3d2 D.dsp2(3)工业上用CH4处理N2O的化学方程式为:CH4+N2ON2+CH3OH。①写出一种与N2O互为等电子体的阴离子的化学式:_______。②CH3OH与水任意比互溶,其原因除与水分子的极性相似外,还有_______。(4)金属钴有两种堆积方式,其晶体结构如图所示。①甲图所示的堆积方式中,每个晶胞中实际占有的钴原子数为_______;乙图所示的堆积方式中,晶胞的原子空间利用率为_______。②已知:NA为阿伏加德罗常数的值,钴原子半径为r pm。甲图中正六棱柱的高为hpm,则该晶胞的密度为_______g·cm-3(用含r、h、NA的式子表示,列出计算式即可)。
参考答案:1. m 圆底烧瓶 油浴加热 通过观察气泡速率调节油浴温度,控制反应速率 安全瓶,防止倒吸 d c 溶液变浑浊 【分析】现实验室欲对的稳定性和分解产物的部分性质分别进行探究,已知反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体,则分解生成氯气和二氧化硫,已知在100℃以上分解,则可采用油浴加热装置B,通过观察装置C中的气泡速率调节油浴温度,控制反应速率;装置D作安全瓶,可防止倒吸;装置甲用于除去二氧化硫中的氯气,在装置丙中二氧化硫与硫化钠溶液反应生成硫单质,溶液变浑浊;装置丁用于除去氯气中的二氧化硫,在装置己中氯气氧化硫化钠生成硫单质,溶液变浑浊;装置乙和装置戊均作安全瓶,可防止倒吸,据此分析解答。【详解】(1)冷凝管的冷凝水应下口进上口出,则应从m口进水;仪器B的名称为圆底烧瓶;已知在100℃以上分解,则加热B的方式最好选用油浴加热,故答案为:m;圆底烧瓶;油浴加热;(2)可通过观察装置C浓硫酸中的气泡速率调节油浴温度,控制反应速率;装置D作安全瓶,可防止倒吸;(3)装置甲中试剂X用于除去二氧化硫中的氯气,因此试剂X应能吸收氯气,而不能吸收二氧化硫,因此应选择四氯化碳;装置丁中试剂Y用于除去氯气中的二氧化硫,因此试剂Y能吸收二氧化硫,而不能吸收氯气,因此应选择高锰酸钾溶液,故答案为:d;c;(4)过量二氧化硫与硫化钠反应生成硫单质和亚硫酸氢钠,则丙中溶液变浑浊,发生反应的离子方程式为。2. (球形)分液漏斗 ClCH2COOH+2NaOHHOCH2COONa+NaCl+H2O BC 防止升温太快 控制反应体系 pH 冷却后补加磁转子 C 78.6【分析】实验室拟用氯乙酸(ClCH2COOH)和NaOH溶液制备少量羟基乙酸钠,此反应为剧烈放热反应,反应方程式为:ClCH2COOH+2NaOHHOCH2COONa+NaCl+H2O,生成的羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂,得到的粗产品通过步骤1、步骤2、步骤3进行分离提纯,以此解答。【详解】(1)根据图中仪器可知仪器A的名称为(球形)分液漏斗;三颈烧瓶中ClCH2COOH和NaOH反应生成HOCH2COONa、NaCl和H2O,方程式为:ClCH2COOH+2NaOHHOCH2COONa+NaCl+H2O,故答案为:(球形)分液漏斗;ClCH2COOH+2NaOHHOCH2COONa+NaCl+H2O;(2)A.球形冷凝管与直形冷凝管相比,冷却面积更大,效果更好,故A正确;B.球形冷凝管内芯管为球泡状,容易在球部积留蒸馏液,故不适宜做倾斜式蒸馏装置,多用于垂直蒸馏装置,适用于回流蒸馏操作,故B错误;C.在使用冷凝管进行蒸馏操作时,一般蒸馏物的沸点越高,蒸气越易冷凝,故C错误;故答案为:BC;(3)逐步加入40%NaOH溶液的目的是防止升温太快,同时控制反应体系的pH,故答案为:防止升温太快;控制反应体系 pH;(4)三颈烧瓶中磁转子在反应过程中起到搅拌的作用,如果忘加磁转子需要冷却后补加磁转子,故答案为:冷却后补加磁转子;(5)蒸出部分水至液面有薄膜,说明有固体开始析出,加少量热水趁热过滤;粗产品溶解于适量热水中,加活性炭脱色,需要过滤分离掉活性炭固体;将去除活性炭后的溶液加到适量乙醇中,冷却结晶,过滤、干燥,得羟基乙酸钠;操作1、2、3的名称分别是:趁热过滤,趁热过滤,冷却结晶,故答案为:C。(6)加入132.3g氯乙酸(ClCH2COOH)的物质的量为:=1.4mol,根据方程式ClCH2COOH+2NaOHHOCH2COONa+NaCl+H2O可知,理论上可以生成1.4mol羟基乙酸钠,步骤4中,得纯净羟基乙酸钠1.1mol,则实验产率为=78.6%,故答案为:78.6。3.(1) 蛇形冷凝管 SO3+SCl2=SOCl2+SO2(2)尾气处理装置D前无干燥装置(3)蒸馏(4) SOCl2+2H2O=H2SO3+2Cl-+2H+ 淀粉溶液 65% 偏低 【分析】观察A中气泡控制N2的流速,装置B发生反应H2SO4(浓)SO3+H2O用于制取SO3,装置C中SO3与SCl2反应制取SOCl2,装置D用于吸收尾气;(1)仪器a的名称为蛇形冷凝管;SO3与SCl2反应生成SOCl2和SO2,反应方程式为SO3+SCl2=SOCl2+SO2;(2)SOCl2能与水剧烈反应,该制备SOCl2装置存在的缺陷为尾气处理装置D前无干燥装置;(3)利用沸点不同,可用蒸馏法收集SOCl2,实验步骤④中的操作为蒸馏;(4)SOCl2中S元素为+4价,溶于水生成两种酸分别为HCl和H2SO3,反应的离子方程式为SOCl2+2H2O=H2SO3+2Cl-+2H+;H2SO3具有还原性,与标准碘溶液发生氧化还原反应生成I-,可选用淀粉溶液做指示剂,滴定终点时溶液由无色变为蓝色;滴定的原理为:H2SO3+I2+ H2O =SO+2I-+4H+,则n(H2SO3)=n(I2)=cV=0.5mol·L-1×13.00×10-3L=6.5×10-3mol,取所得溶液体积的十分之一,由元素守恒可得m(SOCl2)=10nM=10×6.5×10-3mol×119g/mol=7.735g,由制取SOCl2原理H2SO4(浓)SO3+H2O、SO3+SCl2=SOCl2+SO2,加入5.44mL浓硫酸(密度为1.84g· cm-3,质量分数为98%),m(H2SO4)= 5.44×1.84×98%=9.8g,n(H2SO4)=,n(SOCl2)=n(H2SO4)=0.1mol,理论得到的质量m(SOCl2)=nM=0.1mol×119 g/mol=11.9g,则SOCl2的产率为;滴定终点时,发现滴定管尖嘴处有气泡,消耗标准液体积偏小,则测定结果偏低。4. O>N>P 氢键、范德华力 29 S 正四面体 16 【分析】根据白磷分子在晶胞中的位置,在1个白磷分子的晶胞中,8个白磷分子位于晶胞的顶点,六个白磷分子位于晶胞的面心,故1个晶胞中白磷分子的个数为,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16,然后计算1mol白磷分子晶胞的质量为,计算出晶胞参数a。【详解】(1)同周期主族元素的电负性,从左到右随着元素原子序数的递增,电负性逐渐增强,故N、O、P原子的电负性由大到小的顺序为O>N>P;该药物的分子内含有氨基和羟基,所以该药物的分子间作用力有氢键、范德华力;(2)1个分子中含有29个键,故1mol该物质含键数目为29NA;(3)SCN-的结构式为,因为Mn,C,N三种原子不在同一水平线上,所以S原子为配位原子提供孤电子对,形成配位键后,S原子的价层电子对数为4,并且S原子含有2对孤电子对,所以S原子的杂化方式为sp3;(4)As元素原子序数为33,为第ⅤA族元素,基态原子核外电子排布式为[Ar]3d104s24sp3,故As元素基态原子的价电子排布式为4s24sp3;的价层电子对数为4,并且中心原子As不含有孤电子对,故的空间构型为正四面体;(5)在1个白磷分子的晶胞中,8个白磷分子位于晶胞的顶点,六个白磷分子位于晶胞的面心,故1个晶胞中白磷分子的个数为,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16;已知晶胞参数为acm,阿伏加德罗常数的值为NA,1mol该晶胞的质量为,a= ,晶体中白磷分子的最短距离为该晶胞面对角线的一半,该晶胞的面对角线为cm,故晶体中白磷分子之间的最短距离为cm。 【点睛】本题考查晶胞的相关计算,关键是利用“均摊法”找到晶胞内所含分子数,然后根据一个白磷分子中含有4个磷原子,计算出一个晶胞中所含有的磷原子数,利用密度表达式列式计算晶胞参数a,计算时切勿漏掉原子个数。5. 非极性 > sp2 6 N、Cl 7:2 【详解】(1)基态 Ni 原子的价电子排布式为;(2)H2O为极性分子,Ni(CO)4难溶于水,则Ni(CO)4为非极性分子;(3)①N原子的价电子排布式为2s22p3,O原子的价电子排布式为2s22p4,N达到了半充满稳定结构,故较难失电子,第一电离能较大,所以第一电离能:N>O;②苯酚中的C共同形成大π键,有1个p轨道未杂化,为sp2杂化;(4)配位化合物中心原子Co的配位数为6;配位原子是N、Cl;(5) Fe3O4晶胞中O2-个数为:个,所以有2个,有1个,其中正四面体空隙共8个,1个填充在正四面体空隙中,剩余7个正四面体空隙,正八面体空隙共个,一个和一个填充在正八面体空隙中,剩余2个正八面体空隙,故没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为7:2;(6)一个晶胞的质量为,体积为,因此密度为。6.(1) 3d74s2 球(2) 碳 正四面体形 C(3) 、CNO-、SCN- CH3OH与水分子能够形成分子间氢键(4) 2 68% 【解析】(1)已知Co是27号元素,故基态钴原子的价电子排布式为3d74s2,其最高能层为4s能级,s能级的电子云轮廓图为球形,故答案为:3d74s2;球;(2)①由于C的电负性比O的弱,电负性弱的原子易提供孤电子对形成配位键, CO与钴形成配位化合物时,提供孤电子对的为碳原子,故答案为:碳;②高氯酸六氨合钴(II)的结构为。其外界离子即,由于中心原子Cl周围的价层电子对数为:4=4,故其空间构型为正四面体形,根据杂化轨道理论可知,参与杂化的轨道数之和等于杂化之后形成的轨道数,且杂化轨道只用于形成σ键或者存放孤电子对, [Co(NH3)6]2+的中心原子Co2+周围形成了6个σ键,故中心原子杂化后形成了6个轨道,故其采取的杂化类型判断合理的是sp3d2,故答案为:正四面体形;C;(3)①等电子体是指原子总数相等价电子总数相等的微粒,故与N2O互为等电子体的阴离子的化学式有:、CNO-、SCN-等,故答案为:、CNO-、SCN-;②CH3OH与水任意比互溶,其原因除与水分子的极性相似外,还有CH3OH与水分子能够形成分子间氢键,故答案为:CH3OH与水分子能够形成分子间氢键;(4)①根据均摊法可知,甲图所示的堆积方式中,每个晶胞中实际占有的钴原子数为=6,六方最密堆积中晶胞一般取六方锥的三分之一,即为2个;乙图所示的堆积方式即体心立方中,晶胞的原子空间利用率为68%,故答案为:2;68%;②已知:NA为阿伏加德罗常数的值,钴原子半径为r pm,则底面边长为2rpm,甲图中正六棱柱的高为hpm,六棱柱的底面由6个正三角形构成,正三角形的高为:pm,每个正三角形的面积为:=pm2=×10-20cm2,故晶胞的体积为:6×h×10-30cm3,由①分析可知,一个晶胞的质量为:g,则该晶胞的密度为=g·cm-3,故答案为:。
相关试卷
这是一份山东省日照市2021届-2023届高考化学三年模拟(一模)按题型分类汇编-02非选择题,共35页。试卷主要包含了结构与性质,工业流程题,原理综合题,实验题,有机推断题等内容,欢迎下载使用。
这是一份山东省泰安市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题2,共15页。试卷主要包含了填空题,实验题,结构与性质等内容,欢迎下载使用。
这是一份山东省日照市2020届-2022届高考化学三年模拟(二模)试题汇编-选择题,共35页。试卷主要包含了单选题,多选题等内容,欢迎下载使用。









