

河北省邯郸市2022-2023学年高一上学期期末考试化学试题(含答案)
展开邯郸市2022- 2023学年第一学期质量检测
高一化学
注意事项:
1.答卷前,考生务必将自己的姓名、班级和考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回 。
可能用到的相对原子质量:H 1 N 14 O 16 S32 Ca40 Fe56 Cu64 Zn 65
一、 单项选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列物质中,属于共价化合物的是
A. NH4Cl B. MgCl2 C. Cl2 D. CO2
2.邯郸被誉为“中国成语典故之都”,据统计,与邯郸有关的成语典故共有1584条,下列说法错误的是
A.“背水一战”中“水”指河水,属于混合物
B.“完璧归赵”中“璧”属于金属材料
C.“火树银花”形容焰火的灿烂,燃放烟花的过程中发生了氧化还原反应
D.“纸上谈兵”中“纸”的制作中若用SO2处理纸浆,是利用SO2的漂白性
3.下列关于钠的叙述中,错误的是
A.银白色金属 B.熔点比较低
C.具有氧化性 D.可保存在煤油中
4.下列物质与其化学式对应,且相关表述正确的是
A.硫黄(S),分子晶体,可作为工业制硫酸的原料
B.酒精(CH3CH2OH),可以萃取溴水中的溴单质
C.液氯(Cl2),黄绿色液体,具有漂白性
D.过氧化氢(H2O2),与水互为同分异构体
5.下列说法正确的是
A.水分子的球棍模型:
B. CO2的结构式:O=C=O
C. 14C的原子结构示意图:
D.用电子式表示氯化钙的形成过程:
6.石墨烯是一种从石墨中剥离出来,只有一层原子厚度的二维晶体,是目前发现的最薄,,最强韧、导电性最好的新型纳米材料,被誉为“黑金”。下列有关说法错误的是
A.石墨烯由碳原子构成
B.石墨烯与金刚石、石墨互为同素异形体
C.石墨烯能导电,所以是电解质
D.等质量的石墨烯和金刚石含有相同数目的碳原子
7.氡(Rn)因具有放射性是室内污染物之一,Rn可发生衰变: →+。下列有关说法正确的是
A. 的核外电子数是86 B. 的中子数比 多4个
C. 和互为同位素 D. 到的变化为化学变化
8.某婴儿血液中微量元素检验报告单的部分数据如表所示:
* * *医院检验报告单
名称
检测结果
单位
参考值
铜
25.308
μmol·L-1
11.8~39.3
锌
48.526
μmol·L-1
58~ 100
铁
8.948
mmol·L-1
6.63~11.82
钙
1.656
mmol·L-1
1.5~2.5
下列说法错误的是
A.该婴儿血液中锌含量偏低
B.报告单中“ μmol·L-1”、“ mmol·L-1”为物质的量浓度的单位
C.服用维生素C可使食物中的Fe3+转化为Fe2+ ,维生素C表现了还原性
D.某钙片主要成分为CaCO3,由于溶解度很小,其补钙效果不佳
9.每年10月23日上午的6: 02到晚上的6: 02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:02 10/23,外观与阿伏加德罗常数6.02×1023相似。通常用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,28gN2含有的分子数目为NA
B.标准状况下,22.4L H2O含有的分子数目为NA
C.1 mol·L-1 CaCl2溶液中含有的氯离子数目为2NA
D.标准状况下,22.4LCl2与足量Fe反应,转移电子数目为3NA
10.为除去下列物质中的杂质,所选用的除杂试剂或操作错误的是
选项
物质(杂质)
除杂试剂或操作
A
Cl2(HCl)
饱和食盐水
B
NaHCO3溶液(Na2CO3)
适量Ca(OH)2溶液
C
稀盐酸(Cl2)
光照
D
CO2(SO2)
酸性KMnO4溶液
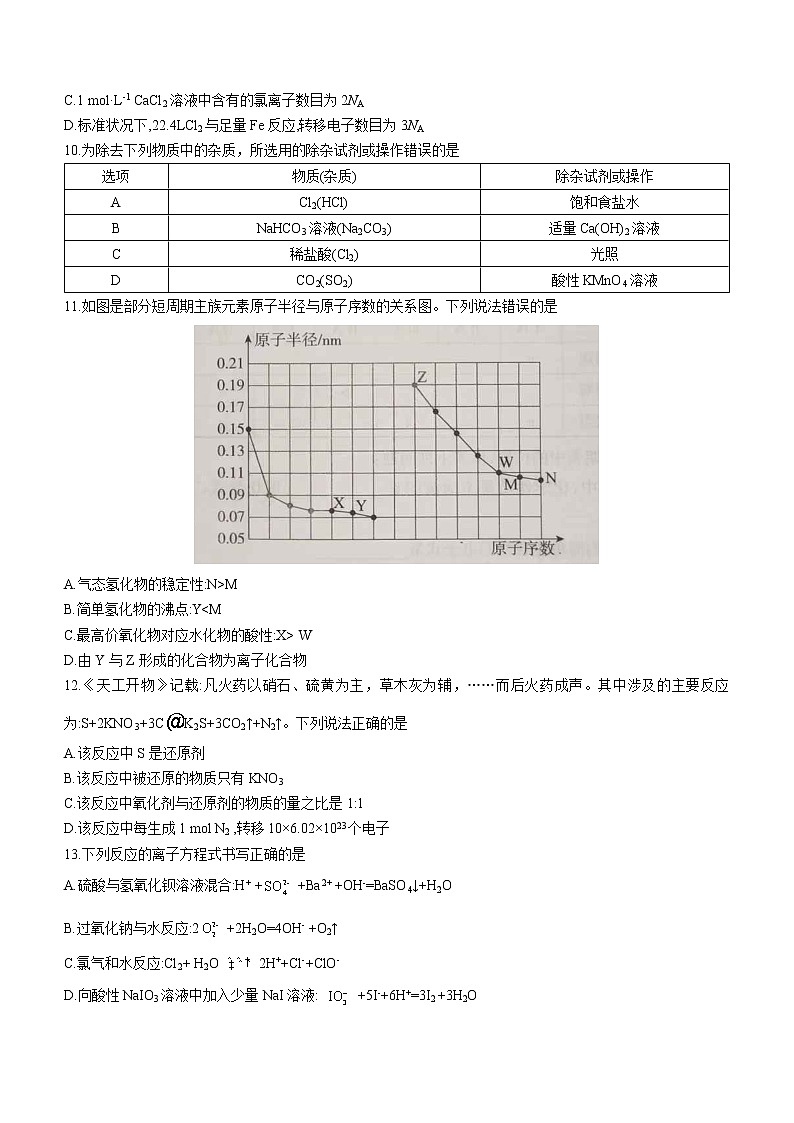
11.如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
A.气态氢化物的稳定性:N>M
B.简单氢化物的沸点:Y
D.由Y与Z形成的化合物为离子化合物
12.《天工开物》记载:凡火药以硝石、硫黄为主,草木灰为辅,……而后火药成声。其中涉及的主要反应为:S+2KNO3+3CK2S+3CO2↑+N2↑。下列说法正确的是
A.该反应中S是还原剂
B.该反应中被还原的物质只有KNO3
C.该反应中氧化剂与还原剂的物质的量之比是1:1
D.该反应中每生成1 mol N2 ,转移10×6.02×1023个电子
13.下列反应的离子方程式书写正确的是
A.硫酸与氢氧化钡溶液混合:H+ + +Ba2+ +OH-=BaSO4↓+H2O
B.过氧化钠与水反应:2 +2H2O=4OH- +O2↑
C.氯气和水反应:Cl2+ H2O 2H++Cl-+ClO-
D.向酸性NaIO3溶液中加入少量NaI溶液: +5I-+6H+=3I2 +3H2O
14.天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用氧化亚铁硫杆菌(T· f菌)可实现天然气的催化脱硫,其原理如图所示(天然气已略去)。下列说法错误的是
A.过程①中H2S为还原剂
B.过程②中反应的离子方程式为4Fe2+ +O2 +4H+= 4Fe3+ +2H2O
C.该脱硫过程需要不断补充Fe2(SO4)3溶液
D.该脱硫过程的总反应为2H2S+O2=2S+2H2O
二、非选择题:本题共4小题,共58分。
15. (14分)下表是元素周期表中的一部分:
I A
IIA
IIIA
IVA
VA
VIA
VIIA
0
第1周期
a
第2周期
b
c
d
第3周期
e
f
g
h
i
根据a~i在周期表中的位置,回答下列问题:
(1)a~i的单质中,化学性质最不活泼的是__ __(填化学式,下同),氧化性最强的是 。
(2)a与b形成的简单化合物的电子式是 。
(3)最高价氧化物对应的水化物酸性最强的是_____ (填化学式);e、f的最高价氧化物对应的水化物之间反应的离子方程式为 。
(4)g的最高价氧化物对应水化物的浓溶液可与Cu在加热时反应,反应的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为 。
(5)下图表示由c、g元素组成的两种气体分子在一定 条件下的密闭容器中充分反应的转化关系,请写出该转化过程的化学方程式: 。
16. (14分)溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,空气吹出法是海水提溴的常用方法,其工艺流程如图所示,回答下列问题:
(1)在实验室若想达到步骤①的目的,需要的仪器有:酒精灯、三脚架、_ 、 。
(2)步骤②为工业上电解饱和食盐水制备Cl2的方法,该过程还同时生产
(填化学式)。
(3)步骤④通入热空气吹出Br2 ,利用了溴的_ (填标号,下同);步骤⑤中SO2为吸收剂,利用了SO2的 。
A.氧化性 B.还原性 C.挥发性 D.漂白性
(4)步骤⑥中反应的离子方程式为 。
(5)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是
。
(6)提取溴单质,采用蒸馏“溴水混合物II”而不是蒸馏“溴水混合物I”,请说明原因:
。
17. (15分)生活离不开化学。家庭厨卫中有许多中学化学常见的物质,它们的主要成分如下表。
商品
食盐
碱面
84消毒液
发酵粉
主要成分
① NaCl
② Na2CO3
③ NaClO
④ NaHCO3
⑤KAl(SO4)2·12H2O
商品
料酒
白醋
洁厕灵
\
主要成分
⑥C2H5OH
⑦CH3COOH
⑧HCl
回答下列问题:
(1)以上主要成分中属于弱电解质的有 (填序号)。NaCl中所含化学键类型为 。
(2)当碱面不慎洒落在天然气火焰上,观察到的现象是 。
(3) KAl(SO4)2·12H2O的电离方程式为 。
(4)Na2CO3溶液中混有少量NaHCO3,可加适量的NaOH溶液除杂,离子反应方程式为 ;
Na2CO3固体中若含有少量NaHCO3,可采取的除杂方法为 。
(5)NaHCO3溶液与白醋反应的离子方程式为 。
(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由: . 。
18. (15分)碱式碳酸铜[Cu2 (OH)2CO3]是一.种草绿色晶体,可用于铜盐、油漆和烟花的生产。实验室制备碱式碳酸铜的步骤如下:
I.分别配制0. 50 mol·L-1CuSO4溶液和0. 50 mol· L-1 Na2CO3溶液。
II.将30 mL CuSO4 溶液和36 mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75° C,搅拌15 min。
IV.静置使产物沉淀完全后,经一系列操作,即可得到碱式碳酸铜。
回答下列问题:
(1)步骤I中,用CuSO4·5H2O固体配制500 mL 0.50 mol·L-1的CuSO4溶液,需要CuSO4·5H2O的质量为_ _;在烧杯中,溶解胆矾时,需要用到玻璃棒,玻璃棒的作用是 。
(2)配制溶液过程中,下列实验操作会使溶质的物质的量浓度偏低的是___(填标号)。
a.未将洗涤液转移到容量瓶中
b.容量瓶底部有少量水
c.反复摇匀后发现液面低于刻度线,继续加水至刻度线
d.定容时俯视刻度线
(3)步骤II的反应方程式如下:
2CuSO4+2Na2CO3+ H2O= Cu2(OH)2CO3↓+2Na2SO4+CO2↑该反应为 (填“氧化还原”或“非氧化还原”)反应;30 mL 0. 50 mol ·L-1CuSO4溶液中溶质的物质的量为______mol;步骤II中两溶液混合充分反应,生成的
CO2在标准状况下的体积为 mL。
(4)步骤IV中的一系列操作为_ 、 干燥。
(5)制备过程中,若改变CuSO4溶液和Na2CO3溶液的体积,可能会得到化学式为[Cux (OH)y (SO4)z]·nH2O的晶体,其中x、y、z应满足关系 。
邯郸市2022-2023学年第-学期质量检测
高一化学参考答案
lD 2B 3C 4A 5B 6C 7A 8D 9A 10B 11B 12C 13D 14C
1.D 解析:NH4Cl属于离子化合物,A错误;MgCl2属于离子化合物,B错误;Cl2是含有共价键的单质,不是化合物,C错误;CO2是仅含共价键的化合物,属于共价化合物,D正确。
[命题意图]本题考查学生对物质结构与类别的掌握情况。对化学概念的透彻理解是解题关键。
2. B解析:“水”指河水,属于混合物,A正确;“完璧归赵”中“璧”指和氏璧,是古代的一种玉器,主要成分是硅酸盐,属于无机非金属材料,B错误;“火树银花”形容焰火的灿烂,燃放烟花的过程中发生了氧化还原反应,C正确;“纸”的制作中若用SO2处理纸浆,是利用了SO2的漂白性,D正确。
[命题意图]本题以成语作为背景考查学生对物质类别、变化及应用的掌握情况。具备分析问题的化学视角是解题关键。
3.C解析: 钠具有还原性,C错误。
[命题意图]本题以钠的性质为载体考查学生对基本概念与性质的掌握情况。对基础知识的准确掌握是解题关键。
4.A解析:硫 黄指硫单质,属于分子晶体,可作为工业制硫酸的原料,A正确;酒精是乙醇的俗称,与水互溶,故不能作萃取溴水中溴单质的萃取剂,B错误;Cl2本身没有漂白性,所以液氯也没有漂白性,C错误;同分异构体指分子式相同而结构不同的化合物,过氧化氢(H2O2)与水(H2O)分子式不同,二者不是同分异构体,D错误。
[命题意图]本题考查学生对物质俗称及用途的掌握情况。具有性质决定用途的意识是解题关键。
5. B解析:水分子的球棍模型为,A错误;CO2的结构式为O=C=O ,B正确;14C 的原子结构示意图
为 .C错误;用电子式表示氯化钙的形成过程为:
D错误。
[命题意图]本题通过化学用语考查学生的符号表征能力。符号表征能力是解题关键。
6. C解析 :根据题目信息,石墨烯是一种从石墨中剥离出来,只有一层原子厚度的二维晶体,所以石墨烯也是由碳元素形成的,A正确;石墨烯、金刚石、石墨是碳元素形成的不同单质,三者互为同素异形体,B正确;石墨烯是能导电的单质,电解质必须是化合物,所以石墨烯不是电解质,C错误;石墨烯和金刚石均是.由碳元素形成的单质,等质量的二者含有相同数目的碳原子,D正确。
[命题意图]本题以石墨烯为背景考查学生的信息获取能力和问题分析能力。问题分析能力是解题关键。
7. A解析: 的质量数为222,质子数为86,核外电子数与质子数相等,也是86,A正确; 的中子数为222- 86= 136, 的中子数为218- 84= 134, 的中子数比出多2个,B错误; 和质子数不同,不是同位素,C错误; 到的变化是核裂变,不是化学变化,D错误。
[命题意图]本题以室内污染物氡为载体考查学生微观探析的化学学科核心素养。分析、解决问题的能力
是解题关键。
8.D 解析:锌含量参考值为58~100μmol·L-1,该婴儿血液中锌含量为48. 526 μmol·L-1 ,故锌含量偏低,A正确;报告单中“μmol·L-1”、“ mmol·L-1”均为物质的量浓度的单位,B正确;维生素C将食物中的Fe3+转化为Fe2+,该过程中维生素C表现了还原性,C正确;某钙片主要成分为CaCO3,CaCO3在水中溶解度很小,但胃酸的主要成分是盐酸,CaCO3可溶于盐酸形成Ca2+从而被吸收,D错误。
[命题意图]本题以微量元素检验报告单为情境考查学生的问题分析能力。获取并运用信息的能力是解题关键。
9.A 解析:常温常压下,28gN2含有N2分子的物质的量为28 g÷28 g/mol=1 mol,N2分子数目为NA,A正确;H2O在标况下不是气态,标准状况下,22.4 L H2O的物质的量远大于1 mol,分子数远大于NA,B错误;不知溶液体积,无法计算CaCl2溶液中所含氯离子的数目,C错误;标准状况下,22.4 LCl2的物质的量为1 mol,与足量Fe反应转移电子数目为2NA,,D错误。
[命题意图]本题以阿伏加德罗常数的考查为载体,培养学生宏观辨识与微观探析的核心素养。微观探析能力是解题关键。
10.B解析:Cl2中混有HCl气体,可将其通过饱和食盐水,溶解HCl气体,同时饱和食盐水中Cl2的溶解度较小,A正确;Ca(OH)2在除去 的同时会与反应,故Ca(OH)2溶液不能用于NaHCO3溶液的除杂,B错误;稀盐酸中溶有Cl2,部分Cl2会与水发生反应:Cl2 +H2O HCl + HClO,在光照光照条件下HClO分解:2HClO2HCl+O2↑,从而促进Cl2与H2O反应,最终Cl2完全转化为HCl,生成的O2逸出,得到稀盐酸,C正确;CO2气体中混有SO2可将气体通过酸性KMnO4溶液,KMnO4将SO2氧化为 除去,D正确。
[命题意图]本题以物质除杂为载体考查学生变化观念与平衡思想的化学学科核心素养。综合分析、解决问题的能力是解题关键。
11.B 解析:由原子半径随原子序数的变化规律可知,X.Y、Z、W、M、N依次为N、O、Na、P、S、Cl。 元素非.金属性越强,其气态氢化物越稳定,所以气态氢化物的稳定性:HCl> H2S,A正确;O、S的简单氢化物沸点:H2O>H2S,B错误;元素非金属性越强,其最高价氧化物对应水化物的酸性越强,故酸性:HNO3>H3PO4,C正确;Na与O可形成两种化合物:Na2O、Na2O2,均为离子化合物,D正确。
[命题意图]本题以元素推断为载体考查学生宏观辨识与微观探析的核心素养。微观探析能力是解题关键。
得到
12. C解析:该反 应中的化合价变化及电子转移如图所示: ,该反应中S为氧化剂,A错误;该反应中被还原的物质有KNO3、S,B错误;该反应中氧化剂为KNO3、S,还原剂. 为C,氧化剂与还原剂的物质的量之比是1 : l,C正确;该反应每生成1 mol N2,转移12 mol电子,即12×6.02×1023个,D错误。
[命题意图]本题以古代火药为情境,考查学生对氧化还原反应知识的掌握情况和问题分析能力。问题分析能力是解题关键。
13. D解析:硫酸 与氢氧化钡溶液混合的离子方程式为2H++ + Ba2++2OH - =BaSO4↓+2H2O,A错误;过氧化钠与水反应的离子方程式为2Na2O2 +2H2O=4Na+ +4OH-+O2↑,B错误; HClO是弱酸,在离子方程式中用化学式表示,所以氯气和水反应的离子方程式为Cl2+H2O H++Cl-+HClO,C错误;向酸性NaIO3溶液中加入少量NaI溶液,在酸性条件下, 与I-发生归中反应生成I2: +5I -+6H+=3I2 +3H2O,D正确。
[命题意图]本题通过离子方程式考查学生的符号表征能力。符号表征能力是解题关键。
14.C解析:根据图示信息,过程①中Fe3+将H2S氧化为S单质,本身被还原为Fe2+ ,H2S为还原剂,A正确;过程②中O2将Fe2+氧化为Fe3+ ,反应的离子方程式为4Fe2++O2 +4H+=4Fe3+ +2H2O,B正确;综合反应①、②可知,Fe2(SO4 )3是该总反应的催化剂,不需要补充,C错误;综合反应①、②,该脱硫过程的总反应为2H2S +O2=2S+2H2O,D正确。
[命题意图]本题以天然气催化脱硫为情境,考查学生提取信息并运用的能力。信息提取能力是解题关键。
15.答案:(14分)
(1)Ar(1分) F2(1 分)
(2) (2分)
(3)HClO4(2分) Al(OH)3+OH- = +2H2O或Al(OH)3+OH-=[Al(OH)4] -(2分)
(4)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分) 1 : 1(2分)
(5)2SO2+O22SO3(2分)
解析:(1)在所有单质中,稀有气体的化学性质最不活泼,所以,a~i的单质中,化学性质最不活泼的是Ar。一般情况下,元素非金属性越强,其单质氧化性越强,所以氧化性最强的单质是F。
(2)a与b形成的简单化合物的电子式是。
(3)元素非金属性越强,其最高价氧化物对应水化物的酸性越强,F、O元素无最高价氧化物对应水化物,故最高价氧化物对应水化物酸性最强的是HClO4;e、f分别是Na、Al元素,其最高价氧化物对应水化物之间反应的离子方程式为Al(OH)3+OH- = +2H2O或Al(OH)3+OH-=[Al(OH)4] -。
(4)在加热条件下浓硫酸可与Cu反应,其化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,该反应中浓硫酸是氧化剂,Cu是还原剂,当1 mol Cu被氧化时,有2 mol H2SO4参加反应,但作为氧化.剂的H2SO4只有1 mol,所以氧化剂与还原剂的物质的量之比为1 : 1。
(5)由图可知,表示的是SO2与O2反应生成SO3的过程,充分反应后SO2、O2仍有剩余,可知该反应为可逆反应,其化学方程式为 2SO2+O22SO3
[命题意图]本题以元素推断及性质为载体,考查学生对元素周期表及元素周期律的理解与运用能力。准确提取题中关键信息并运用是解题关键。
16.答案:(14分)
(1)蒸发皿(1分) 玻璃棒(1分,两空互换不影响得分)
(2)NaOH、H2(2分)
(3)C(2分) B(2 分)
(4)2Br- +Cl2=Br2+2Cl- (2分)
(5)分液(2分)
(6)将“溴水混合物I”转变为“溴水混合物II”是Br2的浓缩过程,可提高效率、减少能耗、降低成本(2分,答案合理即可)
解析:(1)在实验室想达到步骤①的目的,应通过蒸发操作,用到的仪器有:酒精灯、三脚架、蒸发皿、玻
璃棒。
(2)步骤②为氯碱工业,即电解饱和食盐水:2NaCl+ 2H2O 2NaOH+H2↑+Cl2↑,制备氯气的同时还生产NaOH和H2。
(3)步骤④通入热空气可以吹出Br2,利用了溴的挥发性;步骤⑤中SO2为吸收剂,吸收Br2过程中发生反应:Br2+SO2 +2H2O=2HBr+ H2SO4该反应中SO2为还原剂,体现还原性。
(4)步骤⑥中反应的离子方程式为2Br- +Cl2=Br2+2Cl-。
(5)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是分液。
(6)将“溴水混合物I”转变为“溴水混合物II”是Br2的浓缩过程,所以提取溴单质采用蒸馏“溴水混合物II”而不是蒸馏“溴水混合物I”,可提高效率、减少能耗、降低成本。
[命题意图]本题以空气吹出法从海水中提取溴的化工流程为载体,考查学生的问题分析能力及实验探究能力。准确理解流程图是解题关键。
17.答案:(15分)
(1)⑦(2分) 离子键(1 分)
(2)火焰呈黄色(2分)
(3)KAl(SO4)2·12H2O=K+ +A13+ +2 +12H2O或 KAl(SO4)2=K++A13+ +2 (2分)
(4) +OH-=H2O+ (2分)加热或灼烧(2 分)
(5) +CH3COOH=CH3COO- + H2O+CO2↑(2分)
(6)ClO- +Cl -+2H+=Cl2↑+H2O(2分)
解析:(1)①~⑧八种物质中只有⑥C2H5OH是非电解质,其余均为电解质,其中⑦CH3COOH为弱电解质。NaCl属于离子化合物,化学键类型为离子键。
(2)当碱面不慎洒落在天然气的火焰上,Na2CO3受热(灼烧时)会使火焰呈现黄色。
(3) KAl(SO4)2·12H2O O的电离方程式为 KAl(SO4)2·12H2O=K+ +A13+ +2 +12H2O或 KAl(SO4)2=K++A13+ +2
(4)Na2CO3溶液中混有少量NaHCO3,用NaOH溶液除杂的离子方程式为 +OH-=H2O+ ;Na2CO3 固体中若含有少量NaHCO3,可通过加热或灼烧除去。
(5)NaHCO3与白醋反应,是与白醋中的CH3COOH反应,离子方程式为 +CH3COOH=CH3COO- + H2O+CO2↑
(6)84消毒液和洁厕灵不能混合使用,是因为酸性条件下ClO-与Cl-会发生归中反应生成有毒的Cl2,反应的离子方程式为ClO- +Cl -+2H+=Cl2↑+H2O。
[命题意图]本题以家庭厨卫中的化学物质为载体,发展学生模型认知、变化观念的化学学科核心素养。问题分析能力和符号表征能力是解题关键。
18.答案:(15分)
(1)62.5 g(2分) 搅拌,加快胆矾溶解速率(2分)
(2)ac(2分,多选、错选不得分,漏选得1分)
(3)非氧化还原(1分) 0.015(2 分) 168(2 分)
(4)过滤(1分)洗涤(1 分)
(5)2x=y+2z(2分)
解析:(1)配制500 mL0.50 mol/L的CuSO4溶液,所需溶质的物质的量为0.50 L ×0.50 mol/L= 0. 25 mol,需要CuSO4·5H2O的质量为0. 25 mol ×250g/ mol=62.5 g;配制500 mL0.50 mol/L 的CuSO4溶液,溶解胆矾时可用玻璃棒搅拌,以加快溶解速率。
(2)配制过程中,若未将洗涤液转移到容量瓶中,会使得溶质偏少,浓度偏低,a正确;容量瓶洗净后容量瓶底部有少量水,不影响所配溶液的浓度,b错误;反复摇匀后发现液面低于刻度线,继续加水至刻度线,
(3)步骤II反应中元素化合价不变,是非氧化还原反应;30 mL0.50 mol/LCuSO4溶液中溶质的物质的量为0. 030 L×0.50 mol/ L=0. 015 mol;步骤II中30 mL0.50 mol/L的CuSO4溶液和36 mL0.50 mol/L的Na2CO3 溶液混合充分反应,生成CO2的体积按量少的计算,应按CuSO4计算,2CuSO4~ CO2,n(CO2)=0. 015 mol ÷2=0.0075 mol,V(CO2)=0. 0075 mol ×22. 4 L/ mol=0. 168 L=168 mL。
(4)步骤IV静置使产物沉淀完全后,得到碱式碳酸铜固体的一系列操作为过滤、洗涤、干燥。
(5)[Cux (OH)y(SO4)z]· nH2O中,根据电荷守恒可得:2x=y+2z。
[命题意图]本题以碱式碳酸铜的制备为载体,考查学生实验探究与创新意识的化学学科核心素养。获取、整合信息的能力和实验探究能力是解题关键。
河北省邯郸市魏县2022-2023学年高二上学期期末考试化学试题: 这是一份河北省邯郸市魏县2022-2023学年高二上学期期末考试化学试题,共17页。试卷主要包含了单选题,计算题,实验题等内容,欢迎下载使用。
精品解析:河北省邯郸市魏县2022-2023学年高二上学期期末考试化学试题(解析版): 这是一份精品解析:河北省邯郸市魏县2022-2023学年高二上学期期末考试化学试题(解析版),共16页。试卷主要包含了选必二前两章;考试时间,计算题,实验题等内容,欢迎下载使用。
河北省邯郸市2022-2023学年高二下学期期末考试化学试题及答案: 这是一份河北省邯郸市2022-2023学年高二下学期期末考试化学试题及答案,共12页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,高效消毒液,对氨基苯甲酸等内容,欢迎下载使用。












