








- 高二化学人教版2019选择性必修二 1.1.1 原子结构(第1课时 能级与能层 原子光谱)课件含视频+练习含解析 课件 18 次下载
- 高二化学人教版2019选择性必修二 1.1.2 原子结构(第2课时 构造原理与电子排布式)课件+练习含解析.zip 课件 14 次下载
- 高二化学人教版2019选择性必修二1.1.4 原子结构(第4课时 泡利原理、洪特规则、能量最低原理)课件+练习含解析.zip 课件 16 次下载
- 高二化学人教版2019选择性必修二 1.2.1原子结构与元素的性质(第1课时原子结构与元素周期表)课件+练习含解析 课件 15 次下载
- 高二化学人教版2019选择性必修二 1.2.2原子结构与元素的性质(第2课时原子半径、电离能)课件+练习含解析 课件 14 次下载
人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构课文内容ppt课件
展开第一节 原子结构
课时3
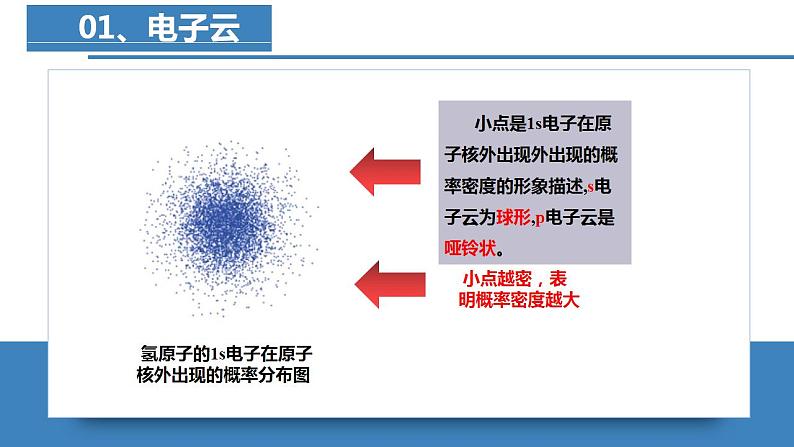
电子云和原子轨道
一、单选题
Ⅰ.夯实基础篇
1.(2022·河北·石家庄精英中学高三阶段练习)下列叙述不正确的是
A.基态碳原子的核外电子排布图:,该图违背了洪特规则
B.原子的电子排布式由1s22s22p33s1→1s22s22p4能释放特定能量产生发射光谱
C.该图为H原子的电子云图,由图可见H原子核外靠近核运动的电子多
D.等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的气态物质
2.(2022·河北·高碑店市崇德实验中学高三阶段练习)下列有关原子核外电子排布的说法,正确的是
A.电子排布为[Ar]3d44s2的中性原子是基态原子
B.1s22s12p2p2p违背了洪特规则,是激发态原子的电子排布
C.不符合泡利原理,是不存在的排布
D.若某核素核外共有15个不同运动状态的电子,则其基态原子中能量最高的电子的电子云的形状为花瓣形
3.(2022·浙江·余姚中学高二期中)玻尔理论、量子力学理论都是对核外电子运动的描述方法,根据对它们的理解,下列叙述中正确的是
A.因为s轨道的形状是球形的,所以s电子做的是圆周运动
B.、、的轨道相互垂直,能量不同
C.钒原子核外有4种形状的原子轨道
D.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
4.(2022·浙江宁波·一模)下列表示不正确的是
A.氯化钙的电子式:
B.基态Cr原子的价层电子轨道表示式:
C.苯酚的分子结构模型:
D.Cl-Cl的p-pσ键电子云图形:
5.(2022·四川省乐山沫若中学高二阶段练习)下列说法正确的是
A.N2、O2和Cl2分子中均既含有σ键,又含有π键
B.Na的核外电子排布由1s22s22p63s1→1s22s22p6的变化需要吸收能量
C.氢原子的电子云图中小黑点表示电子的运动轨迹
D.电离下列状态的铝的最外层一个电子:1s22s22p63s1比1s22s22p63s2所需能量更少
6.(2023·北京·101中学高三期中)下列图示正确的是
A.3p电子的电子云轮廓图:
B.SO3的VSEPR模型:
C.基态氧原子的轨道表示式:
D.H-Cl的形成过程:
7.(2022·湖北·高三阶段练习)下列有关化学用语表示正确的是
A.氮原子2p轨道的电子云轮廓图:
B.HCN的电子式:
C.键线式为的有机物存在顺反异构
D.HClO的结构式H—C1—O
8.(2022·湖南·长沙一中高三阶段练习)下列说法正确的是
A.乙烯的电子式:
B.基态Fe3+的价电子的轨道表示式:
C.基态Mn2+的核外电子排布式为1s22s2p63s23p63d54s2
D.Be原子最外层电子的电子云轮廓图为
Ⅱ.能力提升篇
9.(2022·江苏苏州·高二期末)符号“2p”没有给出的信息是
A.能级 B.电子层
C.电子云形状 D.电子云在空间的伸展方向
10.(2022·福建·三明一中高二阶段练习)下列有关电子云和原子轨道的说法正确的是
A.s、p、d能级所含原子轨道数分别为1,3,5
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道数也增多
D.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
11.(2022·全国·高二课时练习)下列说法正确的是
A.ns电子的能量不一定高于(n-1)p电子的能量
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.同一原子中,1s、2s、3s电子的能量逐渐降低
D.电子云的空间伸展方向与电子的能量大小无关
12.(2022·全国·高二课时练习)下列说法正确的是
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的电子云呈球形,处在该轨道上的电子只能在球壳内运动
C.p电子云轮廓图呈哑铃形,在空间有两个伸展方向
D.2s轨道与1s轨道都是球形,但2s轨道的球形半径更大
13.(2022·四川省绵阳江油中学高二阶段练习)下列有关原子轨道的叙述中正确的是
A.硅原子的2s轨道能量较3p轨道高
B.锂原子的2s轨道与5s轨道均为球形
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道数也在增多
D.第四能层最多可容纳16个电子
14.(2022·甘肃·庆阳第六中学高二期末)对原子结构的认识是理解元素周期律的理论基础。下列说法错误的是
A.s电子的电子云轮廓图是球形
B.处于最低能量状态的原子叫基态原子
C.同一原子中,电子的能量大于电子的能量
D.同一原子中,能级的轨道数等于能级的轨道数
15.(2022·全国·高二课时练习)下列叙述中,不属于核外电子的特点的是
A.质量很小 B.运动范围很小 C.运动速度很快 D.有确定的运动轨迹
16.(2022·全国·高二课时练习)关于电子云的叙述不正确的是
A.电子云是用小点的疏密程度来表示电子在空间出现概率密度大小的图形
B.电子云实际是电子运动形成的类似云一样的图形
C.小点密集的地方电子在那里出现的概率大
D.轨道不同,电子云的形状一般不一样
二、填空题
Ⅰ.夯实基础篇
17.(2022·广东·潮州市湘桥区南春中学高二阶段练习)如图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈_______形,每个s能级有_______个原子轨道;p电子的原子轨道呈_______形,每个p能级有_______个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是_______电子,其电子云在空间有_______方向。
(3)下列原子或离子的电子排布式或轨道表示式正确的是_______(填序号)
①K+:
②F:
③P:
④Cu:
⑤Fe2+:
⑥Mg:
⑦O:
18.(2022·黑龙江·鸡西市英桥高级中学高二期中)下图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈_______形,每个s能级有_______个原子轨道;p电子的原子轨道呈_______形,每个p能级有_______个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是_______电子,其电子云在空间的形状是_______。
第一节 原子结构
课时3
电子云和原子轨道
三、单选题
Ⅰ.夯实基础篇
1.(2022·河北·石家庄精英中学高三阶段练习)下列叙述不正确的是
A.基态碳原子的核外电子排布图:,该图违背了洪特规则
B.原子的电子排布式由1s22s22p33s1→1s22s22p4能释放特定能量产生发射光谱
C.该图为H原子的电子云图,由图可见H原子核外靠近核运动的电子多
D.等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的气态物质
【答案】C
【详解】A.图示排布图中2p能级电子没有优先占满空轨道,违背了洪特规则,A正确;
B.1s22s22p33s1为能量高的激发态,1s22s22p4为能量低的基态,由激发态到基态释放特定能量产生发射光谱,B正确;
C.电子云图中黑点的密集程度表示电子出现在该区域的概率大小,不表示电子多少,C错误;
D.等离子体是由部分电子被剥夺后的原子及原子团被电离后产生的正负离子组成的离子化气体状物质,D正确;
综上所述答案为C。
2.(2022·河北·高碑店市崇德实验中学高三阶段练习)下列有关原子核外电子排布的说法,正确的是
A.电子排布为[Ar]3d44s2的中性原子是基态原子
B.1s22s12p2p2p违背了洪特规则,是激发态原子的电子排布
C.不符合泡利原理,是不存在的排布
D.若某核素核外共有15个不同运动状态的电子,则其基态原子中能量最高的电子的电子云的形状为花瓣形
【答案】C
【详解】该元素原子序数为24,当3d轨道半充满稳定,所以电子排布式应该为[Ar]3d54s1,A错误;
B.1s22s12p2p2p符合能量最低原理,是基态原子的电子排布,B错误;
C.2s电子应该应该自旋相反,不符合泡利原理,是不存在的排布,C正确;
D.某核素核外共有15个不同运动状态的电子,则该原子为P,电子排布式为1s22s22p63s23p3,电子云的形状为哑铃形,D错误;
故答案选C。
3.(2022·浙江·余姚中学高二期中)玻尔理论、量子力学理论都是对核外电子运动的描述方法,根据对它们的理解,下列叙述中正确的是
A.因为s轨道的形状是球形的,所以s电子做的是圆周运动
B.、、的轨道相互垂直,能量不同
C.钒原子核外有4种形状的原子轨道
D.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
【答案】D
【详解】A.s轨道是球形,描述的是电子云轮廓图,表示电子在单位体积内出现概率的大小,故A错误;
B.p能级有三个原子轨道,同一能层上的p轨道能量相同,、、能量相同,它们的差异是延伸方向不同,故B错误;
C.23号钒原子核外电子排布式为1s22s22p63s23p63d3s2,有s、p、d三种能级,对应的原子轨道形状有3种,故C错误;
D.s轨道的空间形状为球形,2s轨道的半径大于1s,因此从空间上看,2s轨道包含了1s轨道,故D项正确;
综上所述,正确的是D项。
4.(2022·浙江宁波·一模)下列表示不正确的是
A.氯化钙的电子式:
B.基态Cr原子的价层电子轨道表示式:
C.苯酚的分子结构模型:
D.Cl-Cl的p-pσ键电子云图形:
【答案】B
【详解】A.氯化钙属于离子化合物,电子式为 ,A正确;
B.Cr元素原子序数是24,价层电子轨道为4s13d5,其电子轨道表示式为: ,B错误;
C.苯酚分子式C6H5OH,结构模型图符合苯酚的结构,C正确;
D.两个p轨道“头碰头”重叠形成p-pσ键,形成轴对称的电子云图形,D正确;
故选B。
5.(2022·四川省乐山沫若中学高二阶段练习)下列说法正确的是
A.N2、O2和Cl2分子中均既含有σ键,又含有π键
B.Na的核外电子排布由1s22s22p63s1→1s22s22p6的变化需要吸收能量
C.氢原子的电子云图中小黑点表示电子的运动轨迹
D.电离下列状态的铝的最外层一个电子:1s22s22p63s1比1s22s22p63s2所需能量更少
【答案】B
【详解】A.N2的结构式为N≡N,既含有σ键,又含有π键,O2的结构式为O=O,既含有σ键,又含有π键,Cl2的结构式为Cl-Cl,只含σ键、不含π键,A错误;
B.核外电子排布由1s22s22p63s1→1s22s22p6的变化,为钠原子形成钠离子,吸收能量,B正确;
C.氢原子的电子云图中,小黑点表示电子在核外空间出现机会的多少,不表示电子的运动轨迹,C错误;
D.1s22s22p63s2为铝的+1价气态离子,1s22s22p63s1为铝的+2价气体离子,则+2价铝失去电子需要的能量多,D错误;
故选B。
6.(2023·北京·101中学高三期中)下列图示正确的是
A.3p电子的电子云轮廓图:
B.SO3的VSEPR模型:
C.基态氧原子的轨道表示式:
D.H-Cl的形成过程:
【答案】C
【详解】A. 为s电子云轮廓图,3p电子的电子云轮廓图为 ,呈哑铃形,A不正确;
B.SO3的价层电子对数为3,发生sp2杂化,VSEPR模型为平面正三角形,B不正确;
C.基态氧原子的电子排布式为1s22s22p4,2p轨道的4个电子排布在三个2p轨道上,由于三个轨道的能量相同,2个成对电子可以排布在任意的1个2p轨道上,则轨道表示式: ,C正确;
D.H-Cl为共价化合物,形成过程为 ,D不正确;
故选C。
7.(2022·湖北·高三阶段练习)下列有关化学用语表示正确的是
A.氮原子2p轨道的电子云轮廓图:
B.HCN的电子式:
C.键线式为的有机物存在顺反异构
D.HClO的结构式H—C1—O
【答案】C
【详解】A.基态氮原子最外层为p轨道,对应的2px、2py、2pz能级能量相同,最外能级的电子云轮廓图可能是2px或2py或2pz,均为纺锤形,故A错误;
B.HCN是共价化合物,故B错误;
C.中有碳碳双键,且双键两边基团不一致,所以存在顺反异构,故C正确;
D.HClO的结构式H—O—Cl,故D错误;
故答案选C。
8.(2022·湖南·长沙一中高三阶段练习)下列说法正确的是
A.乙烯的电子式:
B.基态Fe3+的价电子的轨道表示式:
C.基态Mn2+的核外电子排布式为1s22s2p63s23p63d54s2
D.Be原子最外层电子的电子云轮廓图为
【答案】B
【详解】A.乙烯分子中,碳原子的价层电子对数为3,发生sp2杂化,则两个碳原子间形成2对共用电子,电子式为,A不正确;
B.Fe的电子排布式为1s22s2p63s23p63d64s2,则基态Fe3+的价电子排布式为1s22s2p63s23p63d5,轨道表示式为:,B正确;
C.Mn为25号元素,原子的电子排布式为1s22s2p63s23p63d54s2,则基态Mn2+的核外电子排布式为1s22s2p63s23p63d5,C不正确;
D.Be原子的电子排布式为1s22s2,其最外层电子排布在2s轨道上,其电子云应为s电子云,D不正确;
故选B。
Ⅱ.能力提升篇
9.(2022·江苏苏州·高二期末)符号“2p”没有给出的信息是
A.能级 B.电子层
C.电子云形状 D.电子云在空间的伸展方向
【答案】D
【详解】2p表示原子核外第2能层(电子层)中的p能级,电子云形状为哑铃形,其中p能级应有3个不同伸展方向的原子轨道,可分别表示为px、py、pz,“2p”符号没有表示出电子云在空间的伸展方向,故D项正确。
10.(2022·福建·三明一中高二阶段练习)下列有关电子云和原子轨道的说法正确的是
A.s、p、d能级所含原子轨道数分别为1,3,5
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道数也增多
D.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
【答案】A
【详解】A.s、p、d能级所含原子轨道数分别为1,3,5,故A正确;
B.s能级的原子轨道呈球形,处在该轨道上的电子不只能在球壳内运动,还在球壳外运动,只是在球壳外运动概率较小,故B错误;
C.p能级的原子轨道呈纺锤形,p能级原子轨道数为3,与电子层数无关,故C错误;
D.电子云表示电子出现的几率,即表示电子在核外单位体积的空间出现的机会多少,故D错误;
选A。
11.(2022·全国·高二课时练习)下列说法正确的是
A.ns电子的能量不一定高于(n-1)p电子的能量
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.同一原子中,1s、2s、3s电子的能量逐渐降低
D.电子云的空间伸展方向与电子的能量大小无关
【答案】D
【详解】A.根据构造原理,ns电子的能量一定高于(n-1)p电子的能量,A错误;
B.能量低的电子在离核近的区域运动几乎较多,能量高的电子在离核远的区域运动出现的机会相对多些,B错误;
C.同一原子中原子核外能层序数越大,能级能量也就越高,故1s、2s、3s电子的能量逐渐升高,C错误;
D.同一能级的电子具有相同的能量,与电子云的空间伸展方向无关,与其自旋状态也无关,D正确;
故合理选项是D。
12.(2022·全国·高二课时练习)下列说法正确的是
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的电子云呈球形,处在该轨道上的电子只能在球壳内运动
C.p电子云轮廓图呈哑铃形,在空间有两个伸展方向
D.2s轨道与1s轨道都是球形,但2s轨道的球形半径更大
【答案】D
【详解】A.原子核外电子的概率密度分布看起来像一片云雾,而不是电子像云雾一样笼罩在原子核周围,A错误;
B.处在s原子轨道上的电子,出现在球形内空间的概率为90%,B错误;
C.p电子云轮廓图呈哑铃形,在空间有x、y、z3个伸展方向,C错误;
D.s能级电子云轮廓图都是球形,能层序数越大,s电子云轮廓图的半径越大,D正确;
故选:D。
13.(2022·四川省绵阳江油中学高二阶段练习)下列有关原子轨道的叙述中正确的是
A.硅原子的2s轨道能量较3p轨道高
B.锂原子的2s轨道与5s轨道均为球形
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道数也在增多
D.第四能层最多可容纳16个电子
【答案】B
【详解】A.2s轨道能量低于3p轨道,A错误;
B.2s轨道与5s轨道均为球形,B正确;
C.p能级所含原子轨道数只有3个,与能层序数无关,C错误;
D.第四能层最多可容纳个电子,D错误;
故答案选B。
14.(2022·甘肃·庆阳第六中学高二期末)对原子结构的认识是理解元素周期律的理论基础。下列说法错误的是
A.s电子的电子云轮廓图是球形
B.处于最低能量状态的原子叫基态原子
C.同一原子中,电子的能量大于电子的能量
D.同一原子中,能级的轨道数等于能级的轨道数
【答案】C
【详解】A.s电子的电子云在空间各个伸展方向相同,因此其轮廓图是球形对称的,A正确;
B.当原子核外电子排布遵循构造原理时,原子的能量最低,处于稳定状态,该原子称为基态原子,B正确;
C.在同一原子不同能层的相同能级中,能层序数越大,该能层上电子的能量越高,所以3s电子的能量小于4s的电子的能量,C错误;
D.p能级都有3个轨道,与其所处的能层序数无关,因此同一原子中,3p能级的轨道数等于4p能级的轨道数,D正确;
故选C。
15.(2022·全国·高二课时练习)下列叙述中,不属于核外电子的特点的是
A.质量很小 B.运动范围很小 C.运动速度很快 D.有确定的运动轨迹
【答案】D
【详解】A.核外电子的质量极小,约为,A正确;
B.电子在极小的空间内做高速运动,B正确;
C.电子在极小的空间内高速运动,运动速度非常快,C正确;
D.人们不能准确地测定电子在某一时刻所处的位置及运动速度,也不能描绘出它的运动轨迹,D错误;
故答案选D。
16.(2022·全国·高二课时练习)关于电子云的叙述不正确的是
A.电子云是用小点的疏密程度来表示电子在空间出现概率密度大小的图形
B.电子云实际是电子运动形成的类似云一样的图形
C.小点密集的地方电子在那里出现的概率大
D.轨道不同,电子云的形状一般不一样
【答案】B
【详解】A.用统计的方法描述一定空间运动状态的电子在核外空间出现的概率密度大小的图形称为电子云;常用小点的疏密程度来表示电子在原子核外出现的概率的大小,A正确;
B.电子云是用来描述核外电子在空间出现概率大小的图形,并不是电子实际的运动轨道,B错误;
C.小点密集的地方,表示电子在那里出现的概率大,C正确;
D.电子云的形状与能级有关,如:s能级是球状,p能级是纺锤形,D正确;
故选B。
四、填空题
Ⅰ.夯实基础篇
17.(2022·广东·潮州市湘桥区南春中学高二阶段练习)如图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈_______形,每个s能级有_______个原子轨道;p电子的原子轨道呈_______形,每个p能级有_______个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是_______电子,其电子云在空间有_______方向。
(3)下列原子或离子的电子排布式或轨道表示式正确的是_______(填序号)
①K+:
②F:
③P:
④Cu:
⑤Fe2+:
⑥Mg:
⑦O:
【答案】(1) 球 1 哑铃 3
(2) 2p 三个互相垂直的伸展
(3)①⑤⑥
【解析】(1)
s电子的原子轨道为球形;每个s能级有1个原子轨道;p电子的原子轨道呈哑铃形,每个p能级有3个原子轨道,故答案为:球;1;哑铃;3;
(2)
np轨道已填充电子,说明ns轨道已经排满电子,故n=2,元素X的原子核外电子排布式为1s22s22p3,原子中能量最高的是2p电子,其电子云在空间有3个相互垂直的伸展方向,故答案为:2p;三个互相垂直的伸展;
(3)
①K+核外有18个电子,核电子排布式为1s22s22p63s23p6,故①正确;
②3p能级能量比2p能级高,应是2p能级填充5个电子,故②错误;
③3p能级应是3个电子优先单独占据1个轨道,且自旋方向相同,故③错误;
④应满足洪特规则特例,核外电子排布式为1s22s22p63s23p63d104s1,故④错误;
⑤原子形成阳离子先失去高能级中电子,Fe2+的核外电子排布为1s22s22p63s23p63d6,故⑤正确;
⑥符合能量最低原理,故⑥正确;
⑦同一轨道中2个电子自旋方向相反,故⑦错误,
故答案为:①⑤⑥。
18.(2022·黑龙江·鸡西市英桥高级中学高二期中)下图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈_______形,每个s能级有_______个原子轨道;p电子的原子轨道呈_______形,每个p能级有_______个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是_______电子,其电子云在空间的形状是_______。
【答案】(1) 球 1 哑铃 3
(2) 2p 哑铃形
【解析】(1)
ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。
(2)
因为元素X的原子最外层电子排布式为nsnnpn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,则原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向,电子云在空间的形状是哑铃形。
高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构课前预习课件ppt,共19页。PPT课件主要包含了情境导入,宏观物体的运动轨迹,核外电子的运动,很快接近光速,不可确定,核外电子的运动特点,薛定谔方程,目标一电子云,概率密度,电子云概念等内容,欢迎下载使用。
化学选择性必修2第一节 原子结构优秀习题ppt课件: 这是一份化学选择性必修2第一节 原子结构优秀习题ppt课件,共26页。PPT课件主要包含了电子云,原子轨道,知识回顾,电子云与原子轨道,微观运动的不同,S能级的原子轨道,P能级的原子轨道,d能级原子轨道有5个,f能级原子轨道有7个等内容,欢迎下载使用。
化学选择性必修2第二节 原子结构与元素的性质图文课件ppt: 这是一份化学选择性必修2第二节 原子结构与元素的性质图文课件ppt,文件包含123原子结构与元素的性质第3课时电负性习题精炼高二化学人教版2019选择性必修2含解析docx、123原子结构与元素的性质第3课时电负性课件精讲高二化学同步课件精讲人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













