








- 高二化学人教版2019选择性必修二1.1.4 原子结构(第4课时 泡利原理、洪特规则、能量最低原理)课件+练习含解析.zip 课件 17 次下载
- 高二化学人教版2019选择性必修二 1.2.1原子结构与元素的性质(第1课时原子结构与元素周期表)课件+练习含解析 课件 16 次下载
- 高二化学人教版2019选择性必修二1.2.3原子结构与元素的性质(第3课时 电负性 )课件+练习含解析 课件 15 次下载
- 高二化学人教版2019选择性必修二 第一章原子结构与性质 课件+单元试卷含解析卷 课件 14 次下载
- 高二化学人教版2019选择性必修二 2.1.1共价键(第1课时 共价键)课件+练习含解析 课件 17 次下载
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质图文ppt课件
展开第二节 原子结构与元素的性质
课时2
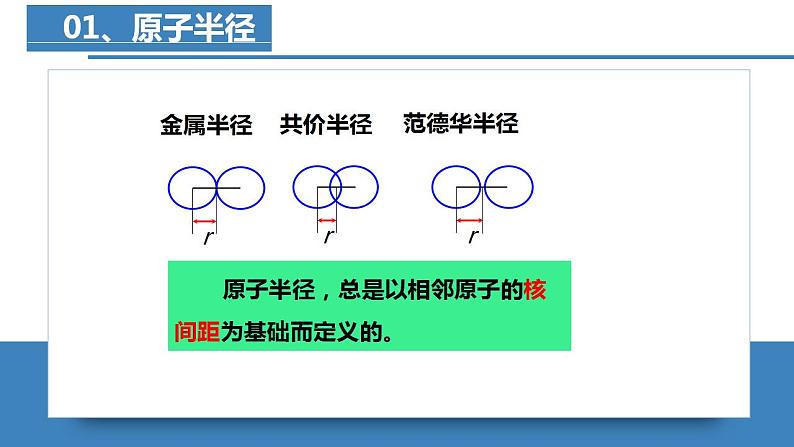
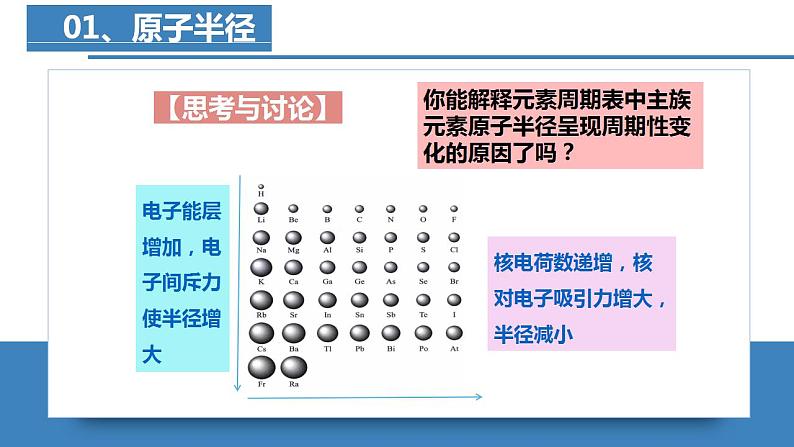
元素周期律——原子半径、电离能
一、单选题
Ⅰ.夯实基础篇
1.(2022秋·广东广州·高三统考阶段练习)下图为“点击化学”的一种反应,下列关I~III三种物质的说法正确的是
A.I中O元素的第一电离能最大 B.I个II分子中含有9个键
C.III中碳氧键的键能均相等 D.基态的价层电子排布式为
2.(2022秋·吉林通化·高二校考期中)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.、、三种元素的电负性顺序为
C.
D.氨分子间存在氢键,故的熔沸点及稳定性均大于
3.(2021春·吉林长春·高二校考阶段练习)甲硫氨酸是构成人体的必需氨基酸之一,结构简式如图所示。下列有关说法正确的是
A.第一电离能:O>N>C>H
B.基态氧原子的电子有8种空间运动状态
C.甲硫氨酸分子中碳原子的杂化类型有sp2和sp3
D.甲硫氨酸分子间不能形成氢键
4.(2021·高二课时练习)下列各组元素中,第一电离能大小次序不正确的是
A. B. C. D.
5.(2022秋·宁夏银川·高二银川二中校考期中)下列各组元素性质的递变情况错误的是
A.、、原子的最外层电子数依次增多
B.、、元素的最高正价依次升高
C.、、元素的第一电离能依次增大
D.F、Cl、Br元素的电负性依次减小
6.(2022秋·四川内江·高二四川省内江市第六中学校考阶段练习)下列状态的铝中,电离最外层的一个电子所需能量最小的是
A.[Ne] B. C. D.
7.(2022·高二单元测试)某元素X的逐级电离能如图所示,下列说法正确的是
A.X元素可能为价 B.X的最高价氢氧化物可能为强碱
C.X为第五周期元素 D.X与氯气反应时最可能生成
8.(2023秋·吉林·高二吉化第一高级中学校校考期末)下列有关电离能的说法中,正确的是
A.第一电离能越大的原子失电子的能力越强
B.第一电离能是元素的原子失去核外第一个电子需要的能量
C.第三周期元素的第一电离能从左到右越来越大
D.可通过一种元素各级电离能的数值,判断元素可能的化合价
Ⅱ.能力提升篇
9.(2022春·重庆万州·高二校考阶段练习)已知X、Y是主族元素,I为电离能,单位是kJ·mo1-1。请根据下表所列数据判断,错误的是
元素 | I1 | I2 | I3 | I4 |
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X与氯形成化合物时,化学式可能是XCl
B.元素Y是IIIA族元素
C.若元素X、Y处于第三周期,X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱性
D.若元素Y处于第三周期,它可与冷水剧烈反应
10.(2022秋·辽宁盘锦·高二辽河油田第二高级中学校考期末)某短周期主族元素R的电离能I1~I4数据如表所示(单位:kJ·mol-1),
I1 | I2 | I3 | I4 | …… |
740 | 1500 | 7700 | 10500 | …… |
关于元素R的下列推断中,错误的是A.R的氯化物最可能的化学式为TCl2
B.R元素的第一电离能高于同周期的相邻元素
C.在周期表中,R位于周期表中的S区
D.R元素基态原子的电子排布式一定为1s22s2
11.(2022秋·重庆九龙坡·高二重庆市育才中学校考阶段练习)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。
| I1 | I2 | I3 | I4 | …… |
R | 740 | 1500 | 7700 | 10500 |
|
下列关于元素R的判断中一定正确的是A.R的最高正价为+3价
B.R元素位于元素周期表中第Ⅱ族
C.R元素第一电离能大于同周期相邻元素
D.R元素基态原子的电子排布式为1s22s2
12.(2022春·福建厦门·高二校考阶段练习)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是
| I1 | I2 | I3 | I4 | …… |
R | 740 | 1500 | 7700 | 10500 | …… |
①R的最高正价为+3价 ②R元素基态原子的电子排布式为1s22s2
③R元素第一电离能大于同周期相邻元素 ④R元素位于元素周期表中第ⅡA族A.①② B.②③ C.③④ D.①④
13.(2022春·山西临汾·高二校考阶段练习)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。关于元素R的判断中一定正确的是
| I1 | I2 | I3 | I4 | …… |
R | 740 | 1 500 | 7 700 | 10 500 |
|
①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2A.①② B.②③ C.③④ D.①④
14.(2023秋·江苏苏州·高三常熟中学校考期末)短周期元素、、、原子序数依次增大,且原子序数,的单质为空气的主要成分且化学性质稳定,的一种盐常用作净水剂,单质及其多种化合物可用作消毒剂。下列说法正确的是
A.第一电离能:
B.简单离子半径:
C.单质及其某些化合物具有漂白性
D.的最高价氧化物对应的水化物是易溶于水的强碱
15.(2023秋·山东淄博·高二山东省淄博第四中学校考期末)是一种重要的染料及合成农药中间体。下列说法错误的是
A.Cu元素位于周期表ds区
B.基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形
C.第一电离能
D.基态O原子的核外电子有8种空间运动状态
16.(2023秋·山东枣庄·高三统考期末)一种新型电池中的电解质(结构如图所示),其中X、Y、Z为原子序数依次增大的短周期不同主族元素,Z原子的单电子数是Y原子的三倍。下列说法中正确的是
A.简单离子半径:X<Y
B.X基态原子电子的空间运动状态有5种
C.第一电离能:Z>X>Y
D.该化合物阴离子呈正八面体结构,键角都是90°
二、填空题
Ⅰ.夯实基础篇
17.(2023·全国·高三专题练习)尿素分子中N、O元素的第一电离能:,原因是_______。
18.(2023·全国·高三专题练习)与相比,第二电离能与第一电离能差值更大的是_______,原因是_______。
19.(2022·全国·高三专题练习)填空。
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
C. D.
(2)基态Fe原子价层电子的电子排布图(轨道表达式)为_______,基态S原子电子占据最高能级的电子云轮廓图为_______形。
(3)基态K原子中,核外电子占据最高能层的符号是_______,占据该能层电子的电子云轮廓图形状为_______。
(4)Co基态原子核外电子排布式为_______。元素Mn与O中,基态原子核外未成对电子数较多的是_______。
Ⅱ.能力提升篇
20.(2022春·新疆喀什·高二校考期中)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。回答下列问题:
(1)写出基态33As原子的核外电子排布式_______
(2)原子半径Ga_______As,第一电离能Ga_______As。
(3)GaAs熔点为1238℃,晶胞结构如图所示则晶体的类型为_______。
21.(2022春·吉林长春·高二统考期中)三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为____。
(2)O、N、C的第一电离能由大到小的顺序为____。
(3)SO2分子的VSEPR模型名称为____,其中心原子的杂化方式为____。
(4)化学式为CrCl3•6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl•2H2O,该物质的配离子中提供孤电子对的原子为____,配位数为____。
22.(2023·全国·高三专题练习)和互为等电子体,电离能:,原因是_______。
23.(2023·全国·高三专题练习)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______(填标号),判断的根据是_______;第三电离能的变化图是_______(填标号)。
a. b. c.
24.(2023秋·北京西城·高二统考期末)我国科学家成功合成了世界上首个全氮阴离子盐,使氮原子簇化合物的研究有了新的突破。
(1)基态N原子中有_____个未成对电子,电子占据的最高能级的符号是_____。
(2)第二周期元素原子的第一电离能介于B、N之间的是_____。
(3)以氮化镓(GaN)等为代表的第三代半导体材料具有优异性能,基态31Ga原子的简化电子排布式为_____。
25.(2023·四川·高二统考学业考试)①~5五种元素在元素周期表中的位置关系如图:
族周期 | IA | II A | III A | IVA | VA | VIA | VIIA | 0 |
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
|
| ② | ③ |
|
|
3 | ④ |
|
|
| ⑤ |
|
|
|
回答下列问题:
(1)①的元素名称是_______。
(2)④的基态原子的电子排布式是_______。
(3)②和③中,电负性较大的是_______(填元素符号)。
(4)②和⑤中,第一电离能较大的是_______(填元素符号)。
(5)②、③、⑤分别与①形成的最简单化合物中,热稳定性最强的是_______(填化学式)。
第二节 原子结构与元素的性质
课时2
元素周期律——原子半径、电离能
三、单选题
Ⅰ.夯实基础篇
1.(2022秋·广东广州·高三统考阶段练习)下图为“点击化学”的一种反应,下列关I~III三种物质的说法正确的是
A.I中O元素的第一电离能最大 B.I个II分子中含有9个键
C.III中碳氧键的键能均相等 D.基态的价层电子排布式为
【答案】D
【详解】A.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故I中N元素的第一电离能最大,A错误;
B.单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;I个II分子中含有14个键,B错误;
C.III中存在碳氧双键、碳氧单键,两种碳氧键的键能不相等,C错误;
D.铜为29号元素,失去一个电子形成,故基态的价层电子排布式为,D正确;
故选D。
2.(2022秋·吉林通化·高二校考期中)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.、、三种元素的电负性顺序为
C.
D.氨分子间存在氢键,故的熔沸点及稳定性均大于
【答案】C
【详解】A.玻尔原子结构模型能够成功地解释氢原子光谱,不能解释各种原子光谱,故A错误;
B.元素的非金属性越强,其电负性越大,非金属性:O>S>P,则电负性:O>S>P,故B错误;
C.同一周期元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,则I1:Na<Mg,Na失去1个电子后,2p能级处于全充满的稳定状态,再失去一个电子较难,因此I2:Na>Mg,故C正确;
D.NH3分子间存在氢键,故NH3的熔沸点大于PH3,但是NH3的稳定性大于PH3,是因为N-H键的键能比H-P键的键能大,故D错误;
故答案选C。
3.(2021春·吉林长春·高二校考阶段练习)甲硫氨酸是构成人体的必需氨基酸之一,结构简式如图所示。下列有关说法正确的是
A.第一电离能:O>N>C>H
B.基态氧原子的电子有8种空间运动状态
C.甲硫氨酸分子中碳原子的杂化类型有sp2和sp3
D.甲硫氨酸分子间不能形成氢键
【答案】C
【详解】A.同周期元素,从左到右第一电离能呈增大的趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,N元素的第一电离能大于O元素,故A错误;
B.原子核外的电子占有几个轨道就有几种空间运动状态,氧原子核外共占有5个轨道,则基态氧原子的电子有5种空间运动状态,故B错误;
C.该分子中C=O上的碳原子是sp2杂化,其他碳原子都是sp3杂化,故C正确;
D.甲硫氨酸分子含有氨基和羧基,分子间能形成氢键,故D错误;
故答案选C。
4.(2021·高二课时练习)下列各组元素中,第一电离能大小次序不正确的是
A. B. C. D.
【答案】C
【详解】A.同一周期随着原子序数变大,第一电离能变大,但是镁原子价电子为3s2全满稳定状态,电离能较大,故Al的第一电离能比Mg小;,A正确;
B.同一周期随着原子序数变大,第一电离能变大,P的3p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故P、S的第一电离能由大到小的顺序为P、S;B正确;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;,C错误;
D.同一主族随原子序数变大,原子半径变大,第一电离能变小;,D正确;
故选C。
5.(2022秋·宁夏银川·高二银川二中校考期中)下列各组元素性质的递变情况错误的是
A.、、原子的最外层电子数依次增多
B.、、元素的最高正价依次升高
C.、、元素的第一电离能依次增大
D.F、Cl、Br元素的电负性依次减小
【答案】C
【详解】A.、、原子的最外层电子数依次为1、2、3,A正确;
B.、、元素的最高正价依次为+5、+6、+7,B正确;
C.N的2p3为半满较稳定结构,、、元素的第一电离能为O<N<F,C错误;
D.F、Cl、Br为同主族元素,从上到下电负性依次减小,D正确;
答案选C。
6.(2022秋·四川内江·高二四川省内江市第六中学校考阶段练习)下列状态的铝中,电离最外层的一个电子所需能量最小的是
A.[Ne] B. C. D.
【答案】B
【详解】A.[Ne]为基态Al3+,2p能级处于全充满,较稳定,电离最外层的一个电子为Al原子的第四电离能;
B.为Al原子的核外电子排布的激发态;
C. 为基态Al原子失去两个电子后的状态,电离最外层的一个电子为Al原子的第三电离能;
D.为基态Al失去一个电子后的状态,电离最外层的一个电子为Al原子的第二电离能;
电离最外层的一个电子所需要的能量:基态大于激发态,而第一电离能小于第二电离能小于第三电离能小于第四电离能,则电离最外层的一个电子所需能量最小的是B;
故选B。
7.(2022·高二单元测试)某元素X的逐级电离能如图所示,下列说法正确的是
A.X元素可能为价 B.X的最高价氢氧化物可能为强碱
C.X为第五周期元素 D.X与氯气反应时最可能生成
【答案】D
【分析】根据电离能图知,第三电离能和第四电离能之间的差距最大,所以该原子最外层有3个电子,属于第ⅢA族元素。
【详解】A.X元素最外层有3个电子,可能为 +3价,故A错误;
B.X元素最外层有3个电子,属于第ⅢA族元素,则X的最高价氢氧化物不可能是强碱,故B错误;
C.周期数=核外电子层数,图象中没有显示X原子有多少电子层,因此无法确定该元素位于第几周期,故C错误;
D.该主族元素最外层有3个电子,在反应中容易失去3个电子形成X3+,所以X与氯反应时可能生成XCl3,故D正确;
故答案选D。
8.(2023秋·吉林·高二吉化第一高级中学校校考期末)下列有关电离能的说法中,正确的是
A.第一电离能越大的原子失电子的能力越强
B.第一电离能是元素的原子失去核外第一个电子需要的能量
C.第三周期元素的第一电离能从左到右越来越大
D.可通过一种元素各级电离能的数值,判断元素可能的化合价
【答案】D
【详解】A.元素原子的第一电离能越大,表示该元素的原子越难失去电子,A错误;
B.第一电离能是基态的气态原子失去核外第一个电子转化为气态基态正离子需要的最低能量,B错误;
C.同周期自左至右第一电离能呈增大趋势,但ⅡA族最外层全满、ⅤA族最外层半满,第一电离能大于相邻元素,C错误;
D.一般来说,元素的电离能按照第一、第二……的顺序逐渐增加,如果突然增加的比较多,电离的难度增大,这里就是元素的通常的化合价,所以可通过一种元素各级电离能的数值,判断元素可能的化合价,D正确;
综上所述答案为D。
Ⅱ.能力提升篇
9.(2022春·重庆万州·高二校考阶段练习)已知X、Y是主族元素,I为电离能,单位是kJ·mo1-1。请根据下表所列数据判断,错误的是
元素 | I1 | I2 | I3 | I4 |
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X与氯形成化合物时,化学式可能是XCl
B.元素Y是IIIA族元素
C.若元素X、Y处于第三周期,X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱性
D.若元素Y处于第三周期,它可与冷水剧烈反应
【答案】D
【分析】X和Y都是主族元素,I是电离能,X第一电离能和第二电离能相差较大,则说明X原子最外层只有一个电子,X为第IA族元素;Y元素第三电离能和第四电离能相差较大,则Y是第IIIA族元素,X第一电离能小于Y,说明X活泼性大于Y。
【详解】A.由上述分析可知,X为第IA族元素,与氯形成化合物时,化学式可能是XCl,故A正确;
B.由上述分析可知,Y是第IIIA族元素,故B正确;
C.元素的金属性越强,其最高价氧化物对应水化物的碱性越强,X活泼性大于Y,则X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱性,故C正确;
D.若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,故D错误;
答案选D。
10.(2022秋·辽宁盘锦·高二辽河油田第二高级中学校考期末)某短周期主族元素R的电离能I1~I4数据如表所示(单位:kJ·mol-1),
I1 | I2 | I3 | I4 | …… |
740 | 1500 | 7700 | 10500 | …… |
关于元素R的下列推断中,错误的是A.R的氯化物最可能的化学式为TCl2
B.R元素的第一电离能高于同周期的相邻元素
C.在周期表中,R位于周期表中的S区
D.R元素基态原子的电子排布式一定为1s22s2
【答案】D
【分析】由R原子的第一至第四电离能可知,R易失去2个电子,可知R为ⅡA,则短周期主族元素R可以为Be或Mg;
【详解】A.据分析,R为ⅡA,氯化物中R的化合价+2价,R的氯化物最可能的化学式为TCl2,A正确;
B.同周期元素第一电离能从左到右有增大的趋势,但ⅡA原子最外层S电子是全满结构,原子的能量较低,使同周期第一电离能:IIA>IIIA,则R元素的第一电离能高于同周期的相邻元素,B正确;
C.R元素基态原子的价电子排布式为2s2 或3s2,则在周期表中,R位于周期表中的S区,C正确;
D. R元素基态原子的电子排布式为1s22s2或1s22s22p63s2,D不正确;
答案选D。
11.(2022秋·重庆九龙坡·高二重庆市育才中学校考阶段练习)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。
| I1 | I2 | I3 | I4 | …… |
R | 740 | 1500 | 7700 | 10500 |
|
下列关于元素R的判断中一定正确的是A.R的最高正价为+3价
B.R元素位于元素周期表中第Ⅱ族
C.R元素第一电离能大于同周期相邻元素
D.R元素基态原子的电子排布式为1s22s2
【答案】C
【详解】A.由表中数据可知,R元素的第三电离能与第二电离能的差距很大,故最外层有2个电子,最高正价为+2价,故A错误;
B.由表中数据可知,R元素的第三电离能与第二电离能的差距很大,故最外层有2个电子,位于第ⅡA族,故B错误;
C.第ⅡA族(ns2np0)的元素,因s轨道处于全满状态,比较稳定,故其第一电离能大于同周期相邻主族元素,故C正确;
D.由表中数据可知,R元素的第三电离能与第二电离能的差距很大,故最外层有2个电子,位于第ⅡA族,可能为Be或Mg元素,故D错误;
选C。
12.(2022春·福建厦门·高二校考阶段练习)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是
| I1 | I2 | I3 | I4 | …… |
R | 740 | 1500 | 7700 | 10500 | …… |
①R的最高正价为+3价 ②R元素基态原子的电子排布式为1s22s2
③R元素第一电离能大于同周期相邻元素 ④R元素位于元素周期表中第ⅡA族A.①② B.②③ C.③④ D.①④
【答案】C
【分析】某短周期元素R的第三电离能剧增,说明该原子最外层有2个电子,处于IIA族,该原子存在第五电离能,说明核外电子数数目大于4,故R为Mg元素。
【详解】①R为Mg元素,R的最高正价为+2价,①错误;
②R为Mg元素,1s2s22p63s2,②错误;
③R元素最外层电子排布式为3s2,为全满稳定状态,第一电离能大于同周期相邻元素的,③正确;
④R为Mg元素,1s2s22p63s2,原子核外最外层共有2个电子,位于元素周期表中第ⅡA族,④正确;
综上所述可知:元素R的判断中一定正确的叙述序号是③④,故合理选项是C。
13.(2022春·山西临汾·高二校考阶段练习)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。关于元素R的判断中一定正确的是
| I1 | I2 | I3 | I4 | …… |
R | 740 | 1 500 | 7 700 | 10 500 |
|
①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2A.①② B.②③ C.③④ D.①④
【答案】B
【详解】从表中所给短周期元素R原子的第一至第四电离能可以看出,元素的第一、第二电离能都较小,可失去2个电子,最高化合价为+2价,即最外层应有2个电子,应为第IIA族元素;
①.最外层应有2个电子,所以R的最高正价为+2价,故①错误;
②.最外层应有2个电子,所以R元素位于元素周期表中第ⅡA族,故②正确;
③.同周期第ⅡA族核外电子排布式为ns2,达稳定结构,所以R元素第一电离能大于同周期相邻元素,故③正确;
④.R元素可能是Mg或Be,故④错误;
答案选B。
14.(2023秋·江苏苏州·高三常熟中学校考期末)短周期元素、、、原子序数依次增大,且原子序数,的单质为空气的主要成分且化学性质稳定,的一种盐常用作净水剂,单质及其多种化合物可用作消毒剂。下列说法正确的是
A.第一电离能:
B.简单离子半径:
C.单质及其某些化合物具有漂白性
D.的最高价氧化物对应的水化物是易溶于水的强碱
【答案】A
【分析】W、X、Y、Z为原子序数依次增大的短周期元素,X的单质为空气的主要成分且化学性质稳定,则X为N元素,Y的一种盐常用作净水剂,则Y为Al元素,Z单质及其多种化合物可用作消毒剂,则Z为Cl元素,原子序数,则W的原子序数为3,则W为Li元素。
【详解】A.原子半径越小,第一电离能越大,则第一电离能:N>Cl>Al,选项A正确;
B.电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,Li+有1个电子层,N3-、Al3+有2个电子层,Cl-有3个电子层,则离子半径:Cl->N3->Al3+>Li+,选项B错误;
C.Z为Cl元素,Cl2不具有漂白性,选项C错误;
D.W为Li元素,其最高价氧化物对应水化物为LiOH,为弱碱,选项D错误;
答案选A。
15.(2023秋·山东淄博·高二山东省淄博第四中学校考期末)是一种重要的染料及合成农药中间体。下列说法错误的是
A.Cu元素位于周期表ds区
B.基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形
C.第一电离能
D.基态O原子的核外电子有8种空间运动状态
【答案】D
【详解】A.Cu元素原子序数为29,位于第四周期IB族,属于ds区元素,故A正确;
B.O元素原子序数8,核外电子数8,基态O原子电子排布式为,最高能级为2p轨道,其电子云轮廓图为哑铃形,故B正确;
C.一般地,同周期元素第一电离能从左到右依次增大,同主族从上到下依次递减,因为ⅡA族和ⅤA族原子轨道全充满和半充满,第一电离能大,所以N、O、S的电离能:,故C正确;
D.电子的空间运动状态:电子的空间运动状态指轨道数,同一轨道中可以填入2个电子,即2个电子拥有相同的空间运动状态。基态O原子电子排布式为,所以基态O原子的核外电子有5种空间运动状态,故D错误;
故选D。
16.(2023秋·山东枣庄·高三统考期末)一种新型电池中的电解质(结构如图所示),其中X、Y、Z为原子序数依次增大的短周期不同主族元素,Z原子的单电子数是Y原子的三倍。下列说法中正确的是
A.简单离子半径:X<Y
B.X基态原子电子的空间运动状态有5种
C.第一电离能:Z>X>Y
D.该化合物阴离子呈正八面体结构,键角都是90°
【答案】D
【分析】X、Y、Z为原子序数依次增大的短周期元素,根据所给的结构为离子化合物,则Y+为Li+或Na+,X形成一个共价键,应为H或F(X、Y、Z序数依次增大,X不是Cl),Z形成6个共价键,Z原子序数是三种元素中最大的,Z原子的单电子数是Y原子的三倍,Y不论是Li还是Na,单电子数均为1,则Z原子的单电子数为3,故Z应为P,三种元素不同主族,故X应为F,则Y为Na,Z为P,据此作答。
【详解】A.由分析可知,X、Y分别为F、Na,F-和Na+电子结构相同,原子序数越小半径越大,故F->Na+,A错误;
B.由分析可知,X为F,是第9号元素,原子核外有9个电子,所以基态原子电子的空间运动状态有9种,B错误;
C.由分析可知,X为F,则Y为Na,Z为P,同周期元素从左到右,第一电离能呈增大趋势,同主族元素从上到下,第一电离能减小,所以第一电离能顺序是F>P>Na,C错误;
D.该化合物阴离子是,中心原子P的价层电子对数=,呈正八面体结构,键角都是90°,D正确;
故选D。
四、填空题
Ⅰ.夯实基础篇
17.(2023·全国·高三专题练习)尿素分子中N、O元素的第一电离能:,原因是_______。
【答案】N元素的能级为半充满状态,是较稳定的结构,失去1个电子需要的能量更多
【详解】同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故N、O的第一电离能大小:N>O;
18.(2023·全国·高三专题练习)与相比,第二电离能与第一电离能差值更大的是_______,原因是_______。
【答案】 的第二电离能失去的是电子,第一电离能失去的是电子,的第二电离能失去的是电子,第一电离能失去的是电子,电子处于全充满状态,较稳定,失去1个电子时所需能量与失去电子所需能量的差值更大
【详解】Cu原子的价电子层结构是3d104s1;的第二电离能失去的是电子,第一电离能失去的是电子;原子的价电子层结构是4s2;的第二电离能失去的是电子,第一电离能失去的是电子,电子处于全充满状态,较稳定,失去1个电子时所需能量与失去电子所需能量的差值更大;故答案为;的第二电离能失去的是电子,第一电离能失去的是电子,的第二电离能失去的是电子,第一电离能失去的是电子,电子处于全充满状态,较稳定,失去1个电子时所需能量与失去电子所需能量的差值更大。
19.(2022·全国·高三专题练习)填空。
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
C. D.
(2)基态Fe原子价层电子的电子排布图(轨道表达式)为_______,基态S原子电子占据最高能级的电子云轮廓图为_______形。
(3)基态K原子中,核外电子占据最高能层的符号是_______,占据该能层电子的电子云轮廓图形状为_______。
(4)Co基态原子核外电子排布式为_______。元素Mn与O中,基态原子核外未成对电子数较多的是_______。
【答案】(1) D C
(2) 哑铃(纺锤)
(3) N 球形
(4) 1s22s22p63s23p63d74s2(或[Ar]3d74s2) Mn
【解析】(1)
根据能级能量E(1s)<E(2s)<E(2p)判断,能量最低的为D,能量最高的为C;
故答案为D,C;
(2)
基态Fe原子核外有26个电子,按照构造原理,其核外电子排布式为[Ar]3d64s2,按照洪特规则,价层电子3d上6个电子优先占据5个不同轨道,故价层电子的电子排布图为。基态S原子的核外电子排布式为1s22s22p63s23p4,电子占据最高能级为3p,p能级的电子云轮廓图为哑铃(纺锤)形;
故答案为,哑铃(纺锤)形;
(3)
基态钾原子核外有4个能层:K、L、M、N,能量依次增大,处于N层的1个电子位于s轨道,s电子云轮廓图形状为球形;
故答案为N,球形;
(4)
根据构造原理可写出Co基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。Mn和O的基态原子核外电子排布式分别为1s22s22p63s23p63d54s2、1s22s22p4,前者的3d轨道中5个电子均未成对,后者的2p轨道中有2个电子未成对,所以Mn的基态原子核外未成对电子数较多;
故答案为1s22s22p63s23p63d74s2(或[Ar]3d74s2),Mn。
Ⅱ.能力提升篇
20.(2022春·新疆喀什·高二校考期中)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。回答下列问题:
(1)写出基态33As原子的核外电子排布式_______
(2)原子半径Ga_______As,第一电离能Ga_______As。
(3)GaAs熔点为1238℃,晶胞结构如图所示则晶体的类型为_______。
【答案】(1)
(2) > <
(3)原子(或共价)晶体
【解析】(1)
As为33号元素,核外共有33个电子,其核外电子排布式为,故答案为:;
(2)
同一周期从左到右原子半径逐渐减小,Ga的原子序数为31,与As位于同一周期,Ga在As的左边,则原子半径:Ga>As;同一周期元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能:Ga<As,故答案为:>;<;
(3)
GaAs熔点为1238℃,熔点很高,则原子间以共价键结合,属于原子(或共价)晶体,故答案为:原子(或共价)晶体。
21.(2022春·吉林长春·高二统考期中)三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为____。
(2)O、N、C的第一电离能由大到小的顺序为____。
(3)SO2分子的VSEPR模型名称为____,其中心原子的杂化方式为____。
(4)化学式为CrCl3•6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl•2H2O,该物质的配离子中提供孤电子对的原子为____,配位数为____。
【答案】(1)3d54s1
(2)N>O>C
(3) 平面三角形 sp2杂化
(4) O、Cl 6
【解析】(1)
Cr是24号元素,基态原子价电子排布为3d54s1,故答案为:3d54s1;
(2)
同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,第一电离能由大到小的顺序为N>O>C;
(3)
SO2分子中S原子孤电子对数==1,价层电子对数=2+1=3,VSEPR模型的名称为平面三角形,空间构型为V形,中心原子的杂化方式为sp2杂化,故答案为:平面三角形;sp2杂化;
(4)
[Cr(H2O)4Cl2]Cl•H2O中配离子中提供孤电子对的原子为O、Cl,配位数为6,故答案为:O、Cl;6。
22.(2023·全国·高三专题练习)和互为等电子体,电离能:,原因是_______。
【答案】和电子排布结构相同,而比的核电荷数大,因此原子核对核外电子的吸引力大于原子核对核外电子的吸引力,所以更难失去电子,电离能更大
【详解】钠离子和氖原子的电子排布结构相同,而钠离子的核电荷数大于氖原子,原子核对核外电子的吸引力大于氖原子,钠离子失去电子难于氖原子,所以钠元素的第二电离能大于氖元素的第一电离能,故答案为:和电子排布结构相同,而比的核电荷数大,因此原子核对核外电子的吸引力大于原子核对核外电子的吸引力,所以更难失去电子,电离能更大。
23.(2023·全国·高三专题练习)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______(填标号),判断的根据是_______;第三电离能的变化图是_______(填标号)。
a. b. c.
【答案】 a 同一周期第一电离能的总体趋势是增大的,但由于N的能级为半充满状态,因此N的第一电离能较C、O两种元素大 b
【详解】C、N、O、F四种元素位于同一周期,同周期元素第一电离能的总体趋势是增大的,但由于N的能级为半充满状态,(第ⅡA族元素的s能级处于全充满状态;第ⅤA族的p能极处于半充满状态,故同周期第ⅡA族和第ⅤA族元素的第一电离能均北相邻主族的大。)因此N的第一电离能较C、O两种元素大,故C、N、O、F的第一电离能从小到大的顺序为,满足这一规律的图像为图a;
气态基态价阳离子失去1个电子生成气态基态价阳离子所需要的能量为该原子的第三电离能,同周期原子的第三电离能的总体趋势也是增大的,但由于C原子在失去2个电子之后的能级为全充满状态,因此其再失去1个电子需要的能量稍高,N、O、F在失去2个电子后,2p轨道上电子分别为1个、2个、3个,再失去一个电子所需能量随着核电荷数增加而变大,则满足这一规律的图像为图b;
故答案为:a;同一周期第一电离能的总体趋势是增大的,但由于N的2p能级为半充满状态,因此N的第一电离能较C、O两种元素大;b。
24.(2023秋·北京西城·高二统考期末)我国科学家成功合成了世界上首个全氮阴离子盐,使氮原子簇化合物的研究有了新的突破。
(1)基态N原子中有_____个未成对电子,电子占据的最高能级的符号是_____。
(2)第二周期元素原子的第一电离能介于B、N之间的是_____。
(3)以氮化镓(GaN)等为代表的第三代半导体材料具有优异性能,基态31Ga原子的简化电子排布式为_____。
【答案】(1) 3 2p
(2)Be、C、O
(3)[Ar]4s24p1
【详解】(1)基态N原子价电子排布式为2s22p3,则其价电子占据的能量最高的能级是2p轨道,其价电子排布图为:,p轨道上3个电子分居在不同的三个轨道上,有3个未成对电子。
(2)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,第二周期元素中,第一电离能介于B、N之间的元素Be、C、O。
(3)Ga原子核外电子数为31,核外电子排布式为:1s22s22p63s23p63d104s24p1,简化电子排布式为[Ar]4s24p1。
25.(2023·四川·高二统考学业考试)①~5五种元素在元素周期表中的位置关系如图:
族周期 | IA | II A | III A | IVA | VA | VIA | VIIA | 0 |
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
|
| ② | ③ |
|
|
3 | ④ |
|
|
| ⑤ |
|
|
|
回答下列问题:
(1)①的元素名称是_______。
(2)④的基态原子的电子排布式是_______。
(3)②和③中,电负性较大的是_______(填元素符号)。
(4)②和⑤中,第一电离能较大的是_______(填元素符号)。
(5)②、③、⑤分别与①形成的最简单化合物中,热稳定性最强的是_______(填化学式)。
【答案】(1)氢
(2)
(3)O
(4)N
(5)H2O
【分析】①在第一周期IA族,故为氢元素,④在第三期IA族,故为钠元素,②在第二期VA族,故为氮元素,⑤在氮元素的同族,且下一个周期,故⑤是磷元素,③在氮元素的同周期,且在氮元素的右边,故③是氧元素,据此分析。
【详解】(1)由上述分析可知,①在第一周期IA族,故为氢元素,答案为:氢;
(2)④为钠元素,11号元素,故钠元素基态原子的电子排布式是:;
(3)②是氮元素,③是氧元素,同周期元素,越往右电负性越大,电负性较大的是氧元素,答案为:O;
(4)②是氮元素,⑤是磷元素,二者同主族,同主族越往下第一电离能越小,故第一电离能较大的是:氮元素;答案为:N;
(5)元素的非金属性越强,对应的氢化物越稳定,氮、磷、氧三种元素中,非金属最强是氧元素,故热稳定性最强的是:H2O;答案为:H2O。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质教课内容课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质教课内容课件ppt,共24页。PPT课件主要包含了复习回顾,目标一原子半径,原子半径,原子半径影响因素,同周期,微粒半径比较,目标二电离能,电离能,思考与讨论等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质课文内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质课文内容ppt课件,共36页。PPT课件主要包含了学习目标,复习回顾,知识点一,思考讨论,拓展延伸,Na+﹥Mg2+,练一练,知识点二,元素的电离能,电离能越小等内容,欢迎下载使用。
化学选择性必修2第二节 原子结构与元素的性质图文课件ppt: 这是一份化学选择性必修2第二节 原子结构与元素的性质图文课件ppt,文件包含123原子结构与元素的性质第3课时电负性习题精炼高二化学人教版2019选择性必修2含解析docx、123原子结构与元素的性质第3课时电负性课件精讲高二化学同步课件精讲人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。














