






2023届高三化学一轮复习 氯及其化合物 课件
展开
这是一份2023届高三化学一轮复习 氯及其化合物 课件,共47页。PPT课件主要包含了课前热身,氯气的物理性质,知识小结,氯气泄漏应急处理,与氢气反应,与碱的反应,与水反应,氯水的反应,②制漂白粉,能力提升等内容,欢迎下载使用。
1. 写出Cl2与下列物质反应的化学方程式⑴ Na、Fe、Cu、H2、
2. 写出Cl2与下列各组物质(溶液)反应的离子方程式⑴ H2O、NaOH、Na2SO3⑵ KI、NaBr 、 FeCl2⑶ 少量Cl2分别与FeSO4、FeBr2、FeI2反应
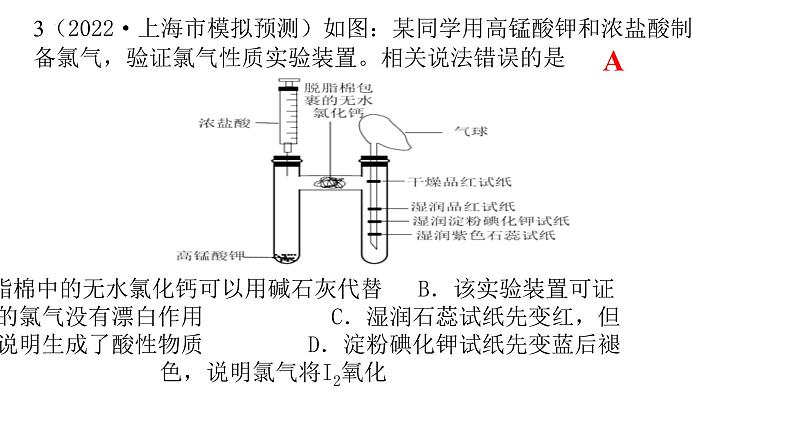
3(2022·上海市模拟预测)如图:某同学用高锰酸钾和浓盐酸制备氯气,验证氯气性质实验装置。相关说法错误的是
A.脱脂棉中的无水氯化钙可以用碱石灰代替 B.该实验装置可证明干燥的氯气没有漂白作用 C.湿润石蕊试纸先变红,但也不能说明生成了酸性物质 D.淀粉碘化钾试纸先变蓝后褪色,说明氯气将I2氧化
氯气是一种黄绿色气体有刺激性气味密度比空气大能溶于水易液化(分子间作用力较大)易被活性炭吸附剧毒
用湿毛巾或湿物遮住鼻子眼睛,往上风头或高处跑
二、氯气的化学性质1. 氯气具有强氧化性,能和绝大多数金属反应,能将变价金属氧化成高价化合物。
H2在Cl2中燃烧的现象:安静燃烧,产生苍白色火焰,瓶口有白雾工业制盐酸的方法:H2在Cl2中燃烧生成HCl,然后用水吸收
2NaOH+Cl2=NaCl+NaClO+H2O2OH— + Cl2=Cl— + ClO— +H2O
实验室常用该反应吸收尾气中的Cl2(不能用Ca(OH)2)工业上常用该反应制漂白液
① 溶于水的氯气只部分与水反应,因此氯水中的主要溶质是Cl2,颜色为浅黄绿色。② 氯水中有 H2O 、Cl2、 HClO、 H+、Cl- 、ClO-、OH-等微粒,氯水在与不同物质反应时,参加反应的成分不同,表现出性质的多样性。③ 氯水的保存:贮存在棕色试剂瓶中避光保存。④ 氯水可以用来杀菌、消毒、漂白
高考指津——氯气与水的反应
CaCO3+2H+=Ca2+ +CO2 ↑ +H2O
Cl2+2OH-=Cl-+ClO-+H2O
Ag++Cl-=AgCl↓
2Br- +Cl2=Br2+2Cl-
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
2HClO=2H++2Cl-+O2
Cl2 H2OHClO
2、工业应用①制漂白液:氯气通入NaOH溶液中可以得到以NaClO为有效成分的漂白液,它的水溶液在低温下存放三年才分解一半左右,比HClO稳定得多。
2NaOH+Cl2=NaCl+NaClO+H2O2OH— +Cl2=Cl— +ClO— +H2O
1、原理:Cl2与碱的作用相当于Cl2与水作用生成两种酸后,两种酸再与碱发生中和反应(故有两种盐生成)。如:
高考指津——氯气与碱的反应
漂白液、漂白粉、漂粉精既可作为漂白棉、麻、纸张的漂白剂,又可作为游泳池及环境的消毒剂。
将氯气与通入冷的消石灰[Ca(OH)2]中即制得以次氯酸钙Ca(ClO)2为有效成分的漂白粉。
2Ca(OH) 2+2Cl2=CaCl2+Ca(ClO)2+2H2O
如果氯气与Ca(OH)2反应充分,并使次氯酸钙为主要成分,则得到漂粉精。
1. 反应原理:在酸性条件下用氧化剂(如MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2)等能将Cl-氧化成Cl2。
高考指津——Cl2的制取
注意:随着反应的进行,盐酸浓度降低后,即使MnO2过量,反应也会自动停止!
1.将0.2ml MnO2和50mL 12ml·L-1盐酸混合后缓缓加
热,反应完全后向留下的溶液中加入足量的AgNO3溶液,生
成AgCl的物质的量为(不考虑盐酸的挥发)( )A.等于0.3mlB.小于0.3mlC.介于0.3~0.6ml之间D.以上都不正确
除杂 : 用饱和食盐水除去Cl2中的HCl气体。干燥: 浓硫酸、P2O5或无水CaCl2等。收集: 向上排空气法或排饱和食盐水法。检验是否收满: 湿润的淀粉KI试纸。
应用提升 实验室中制取气体时装置的设计(1)实验室中制取气体的装置包括发生装置、除杂装置、收集装置和尾气处理装置等。(2)选择各部分装置的依据:①发生装置——反应物的状态和反应条件;②除杂装置——气体及其所含杂质的性质;③收集装置——气体的密度、气体在水中的溶解性,以及是否与水、空气中的成分反应;④尾气处理装置——尾气的性质。(3)实验装置的连接顺序:发生装置→除杂装置→收集装置→尾气处理装置。
考向1.氯气的制备与性质实验的综合典例突破(2021广东卷,17节选)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlrine(中文命名“氯气”)。
2、实验室常用MnO2与浓盐酸反应制备l2(反应装置如右图所示)。 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是_______(填序号)。 A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。乙方案:采用酸碱中和滴定法测定。丙方案:与已知量CaCO3(过量)反应,称量剩余的固体质量。丁方案:与足量Zn反应,测量生成的H2体积。继而进行下列判断和实验:①判定甲方案不可行,理由是_______。
加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度
② 进行乙方案实验:准确量取残余清液稀释一定的倍数后作为
试样。 a.量取试样20.00mL,用0.1000 ml·L—1NaOH标准溶液滴定,消耗22.00mL, 该次滴定测的试样中盐酸浓度为_______ml·L—1; b.平行滴定后获得实验结果。
③ 判断丙方案[与已知量CaCO3(过量)反应,称剩余的固体质量]
的实验结果________ (填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、 Ksp(MnCO3)=2.3×10-11]
④进行丁方案实验:装置如右图所示(夹持器具已略去)。(i)使Y形管中的残余清液与锌粒反应的正确操作是将______转移到_________中。(ii)反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是______________(排除仪器和实验操作的影响因素)。
针对训练(2021湖南长沙炎德英才月考)实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去)。下列说法正确的是( )A.玻璃纤维的作用是防止E装置中液体倒吸入D装置中B.E装置中液体用于吸收多余的氯气和氯化氢C.要使B装置中产生氯气,应先加热圆底烧瓶,再滴加浓盐酸D.实验中加热的先后顺序为先加热硬质玻璃管D,再加热圆底烧瓶B
(2021辽宁营口二模)Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机化合物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2 === HgCl2+Cl2O。下列说法不正确的是( )A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险C.从装置⑤中逸出气体的主要成分是Cl2OD.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
针对训练1. (双选) (2021湖南岳阳一中月考)四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是( )
A.②中应盛装饱和食盐水B.冷凝管有冷凝、回流和导气的作用C.反应结束时,应先停止①处的加热,后停止③处的加热D.该设计存在不足,如④⑤之间缺少防止水蒸气进入④的装置
答案 A C解析 四氯化钛极易水解,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水蒸气,则②中应盛装浓硫酸除水蒸气,A错误;TiCl4的熔、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,B正确;反应结束时,应先停止③处加热,后停止①处加热,可以使制得的TiCl4在氯气氛围中冷却,防止空气进入装置中使TiCl4变质,C错误;因四氯化钛极易水解,所以应在装置④和⑤之间增加一个防止水蒸气进入④的装置,D正确。
1. 若用X代表F、Cl、Br、I四种卤族元素,下列属于它们共性反应的是 ( ) A. 2HX=X2 +H2 B. X2+H2O=HX+HXO C. 2Fe+3X2=2FeX3 D. 2Na+X2=2NaX
1、卤族元素的原子结构
F2 > Cl2 >Br2> I2
HClO4 > HBrO4 > HIO4
最高氧化物
对应水化物
酸性
F-<Cl-<Br-< I-
HF<HCl<HBr< HI
2、卤素单质物理性质的比较
Cl2 、Br2、I2及在不同溶剂中颜色的比较
(1) 与金属(Fe)反应
2Fe+3Br2=2FeBr3
3、卤素单质化学性质的比较
H2+F2==2HF (黑暗中爆炸)
HF>HCl>HBr>HI
HF<HCl<HBr<HI
(3)与水的反应X2+H2O=HX+HXO(X=Cl、Br、I)2F2+2H2O=4HF+O2(了解)(4)与碱的反应X2+2NaOH=NaX+NaXO+H2O( X=Cl、Br、I 且依次变慢)2F2+2NaOH=2NaF+OF2+H2O (了解)
⑸相互置换Cl2+2NaBr=2NaCl+Br2Cl2+2KI=2KCl+I2Br2+2KI=2KBr+I2I2+K2S=S+2KI
氧化性:Cl2 >Br2> I2 >S
4、 Cl- 、 Br-、I- 的检验NaCl+AgNO3=NaNO3+AgCl↓(白色)NaBr+AgNO3=NaNO3+AgBr↓(淡黄色)KI+AgNO3=KNO3+AgI↓ (黄色)
⑴用硝酸银溶液、稀HNO3
高考指津——卤族元素、单质及其化合物性质的特殊性(1) F元素没有正价,只有0价、-1价。(2)HF是弱酸,其余三种是强酸。(3)AgF溶于水,其余均为沉淀。(4)单质溴为液体,易挥发,常用水封。(5)碘为固体,易升华,常用于I2的分离提纯;(6)I2遇淀粉变蓝,常用于相互检验。
高考指津——卤族元素、单质及其化合物性质的特殊性(7)F2、Cl2、Br2均能将Fe氧化为Fe3+,而I2只能把铁氧化为Fe2+。 (8)卤族元素单质能将同主族原子序数大的元素从其盐溶液中置换出来,但氟不能进行相应的置换;原因是F2能与NaX溶液中的水发生反应。(9)卤素单质间能发生下列置换。 2KI+Br2 =2KBr+I2,2KBrO3+I2=2KIO3+Br2
典例突破KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1 ml I2,消耗的KI至少为 ml。I2在KI溶液中可发生反应I2+I- 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是 。
答案 4 防止单质碘析出解析 KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,化学方程式为4KI+2CuSO4 === 2CuI↓+I2+2K2SO4,若生成1 ml I2,则消耗的KI至少为4 ml;反应中加入过量KI,I-浓度增大,可逆反应I2+I- 平衡右移,增大I2的溶解度,防止单质碘析出。
针对训练(2021辽宁抚顺六校联考)某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
查阅资料,有关信息如下。①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl。可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2OCCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl②相关物质的相对分子质量及部分物理性质如表所示:
(1)仪器A中发生反应的化学方程式为 。 (2)装置B中的试剂是 ,若撤去装置B,可能导致装置D中副产物 (填化学式)的量增加;装置D可采用 加热的方法控制反应温度在70 ℃左右。 (3)装置D中球形冷凝管的作用为 。写出E中所有可能发生的无机反应的离子方程式: 。 (4)测定产品纯度:称取产品0.40 g配成待测溶液,加入0.100 0 ml·L-1碘标准溶液22.00 mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.020 00 ml·L-1 Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为 。(计算结果保留三位有效数字)
答案 (1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2)饱和食盐水 C2H5Cl 水浴(3)冷凝回流,导气 Cl2+2OH- === Cl-+ClO-+H2O、H++OH- === H2O(4)73.8%解析 由题给反应原理和装置图可知,A是制取氯气的装置,B、C是除杂装置,D是制备三氯乙醛的装置,E是尾气吸收装置。(1)二氧化锰与浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。(2)装置B的作用是除去Cl2中的HCl气体,故B中应盛放饱和食盐水。结合题给反应,C2H5OH和HCl反应生成C2H5Cl,故若撤去装置B,则副产物C2H5Cl的量增加,可以采用水浴加热的方法控制反应温度在70 ℃左右。
相关课件
这是一份2024届高三化学高考备考一轮复习专题:氯及其化合物课件,共35页。PPT课件主要包含了氯气的物理性质,刺激性,2漂白液,NaClO,3漂白粉,CaClO2,制取原理,实验装置,制取过程,饱和食盐水等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习4.2氯及其化合物卤素课件
这是一份鲁科版高考化学一轮总复习课时质量评价2氯及其化合物课件,共35页。








