




高中人教版 (2019)第二节 元素周期律优质课件ppt
展开The psitin, structure and prperties f elements
第四章 第二节元素周期律
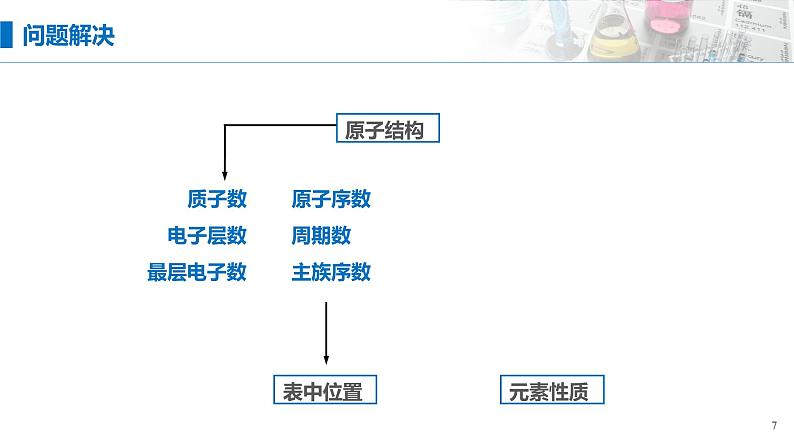
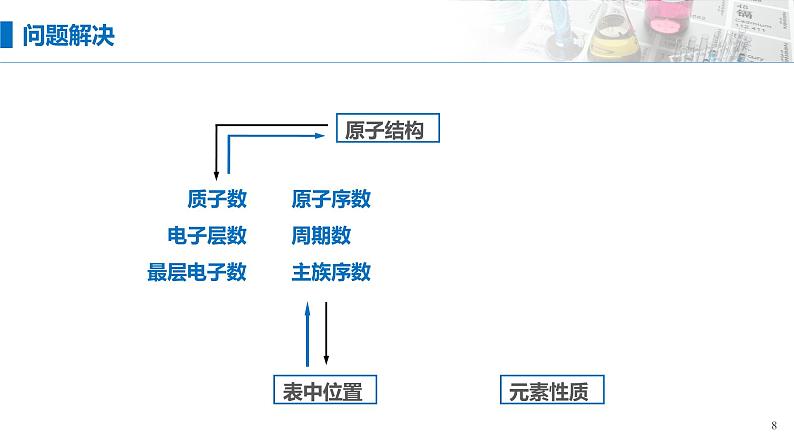
据原子的最外层电子数与电子层数、主族数、周期数的关系互推
据最外层电子数与原子半径,确定原子的性质
据元素在周期表中的位置,确定其化学式及有关性质
说说该元素在周期表的位置。
某元素原子结构示意图如下:
在周期表中位于第四周期、ⅦA族
主族序数=最外层电子数
某负二价的阴离子核外有18个电子,则该元素在周期表中位于____周期、______族。
材料一: l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质镓是银白色金属,密度4.7g·cm-3,能与沸水剧烈反应生成氢气和氢氧化镓。
材料二:1876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g·cm-3 ,从而验证了元素周期表的正确性。
随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于制造半导体材料。镓的原子序数为31,回答下列问题:
(1)镓元素位于周期表的_____________________。
(2)镓与沸水反应的化学方程式为______________________________________。
(3)硫酸镓的化学式为______________。
结构 位置
最外层电子数=元素最高正价
最外层电子数-8=元素负价
①主要化合价________________。②氢化物的分子式__________________。③最高价氧化物水化物分子式_________________。
已知砷(As)原子的各层电子数分别为2、8、18、5。试写出砷的:
镓(1875年布瓦博德朗发现镓后测定)
最高价氧化物对应水化物的酸碱性
碱性:Ca(OH)2_______Ba(OH)2
稳定性:CH4_________SiH4
酸性:H2SO4_______HClO4
稳定性:H2S________HCl
碱性:KOH______Mg(OH)2
比较不同周期不同主族元素的性质
推断一些没学过的元素某些性质
请推测:砹及其化合物的性质。
A.在化合物中呈+2价B.单质能使水分解,放出氢气C.氢氧化物呈两性D.碳酸盐难溶于水
镭位于元素周期表中第七周期ⅡA 族,下列关于镭的性质描述中不正确的是
1. 某元素最高价与负价的绝对值相等,则该元素位于___________族。
2. 某元素最高价是负价的绝对值3倍,则该元素位于____________族。
④物质的应用,如半导体
⑥原子序数:元素A为B的2倍,则A为____
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
f 在元素周期表中的位置是__________________________________。
短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分别占三个不同的周期。W与X同主族,R与Z同主族,R最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素。下列说法正确的是
A.W、X是金属元素B.原子半径:R<Y<ZC.简单气态氢化物的热稳定性:Z>RD.X、Y、Z的最高价氧化物对应的水化物能相互反应
据与原子结构的关系,判断元素
据元素及化合物的性质、应用、制备等,判断元素
X Y Z M N
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。
下列有关说法正确的是
A.X与Y只能形成一种化合物B.最高价氧化物对应水化物的碱性:Y>ZC.气态氢化物的热稳定性:M>ND.单质的氧化性:X<M
这节课我学到了什么?(用一句话表示)
主族序数=最外层电子数
相似性 递变性(从上至下,金属性增强,非金属性减弱)
递变性(从左到右,金属性减弱,非金属性增强)
金属性、非金属性强弱
(主族)最外层电子数 = 最高正价
最外层电子数-8 = 负价
A.周期表中的主族都有非金属元素B.周期表中的主族都有金属元素C.周期表中的非金属元素都不位于副族D.周期表中的非金属元素都位于短周期
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A.R的原子半径比Z的大B.R的氢化物的热稳定性比W的强C.Y形成的单质只有一种D.Y的最高价氧化物的水化物的酸性比W的强
短周期主族元素W、R、X、Y、Z,原子序数依次增大。W、X、Y三种元素原子的最外层电子数之和为15, Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差1。下列叙述正确的是
A.R在化合物中显+1价B.最高价氧化物的水化物的碱性:X>RC.原子半径:X>Y>ZD.简单气态氢化物的热稳定性:Y>W
A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性: X>W>ZC.最简单气态氢化物的热稳定性:Y>X>W>ZD.元素X、Z、W的最高化合价分别与其主族序数相等
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
A.原子半径Z<MB.Y的最高价氧化物对应水化物的酸性比X的弱C.X 的最简单气态氢化物的热稳定性比Z的小D.Z位于元素周期表中第二周期、第ⅥA族
四种短周期元素在周期表中的位置如下图,其中只有M为金属元素。下列说法不正确的是
短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14。X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族。下列说法正确的是
A.X与Y只能形成一种化合物 B.原子半径:r(Y)<r(W)<r(Z) C.W的简单气态氢化物的热稳定性比Y的强 D.Z的最高价氧化物对应的水化物是酸
依据构、位、性三者间的关系
发现新元素 合成新物质
2024版高考化学一轮复习专题基础练专题五物质结构与性质元素周期律热考题型8元素“位_构_性”关系的推断作业课件: 这是一份2024版高考化学一轮复习专题基础练专题五物质结构与性质元素周期律热考题型8元素“位_构_性”关系的推断作业课件,共24页。PPT课件主要包含了热考题型8等内容,欢迎下载使用。
2024届高考化学一轮复习课件 第五章 物质结构与性质、元素周期律 热点强化练4 元素位、构、性综合推断: 这是一份2024届高考化学一轮复习课件 第五章 物质结构与性质、元素周期律 热点强化练4 元素位、构、性综合推断,文件包含热点强化练4元素位构性综合推断pptx、热点强化练4元素位构性综合推断docx等2份课件配套教学资源,其中PPT共14页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律公开课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律公开课ppt课件,共60页。PPT课件主要包含了元素周期律,法国的古名为,“家里亚”,核外电子排布,原子半径,主要化合价,金属性和非金属性,元素性质,金属性与非金属性,Na>Mg>Al等内容,欢迎下载使用。













