






人教版 (2019)必修 第二册第一节 硫及其化合物优秀ppt课件
展开学习目标1、了解浓硫酸的三大特性。2、能运用氧化还原反应知识理解浓硫酸的氧化性。3、认识硫酸在相关反应中体现的性质。
核心素养1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
1、了解浓硫酸的三大特性。2、能运用氧化还原反应知识理解浓硫酸的氧化性。3、认识硫酸在相关反应中体现的性质。
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
纯净的硫酸是无色黏稠的油状液体,密度比水大,能与水以任意比混合,沸点高,难挥发。
【思考一】如何稀释浓硫酸?
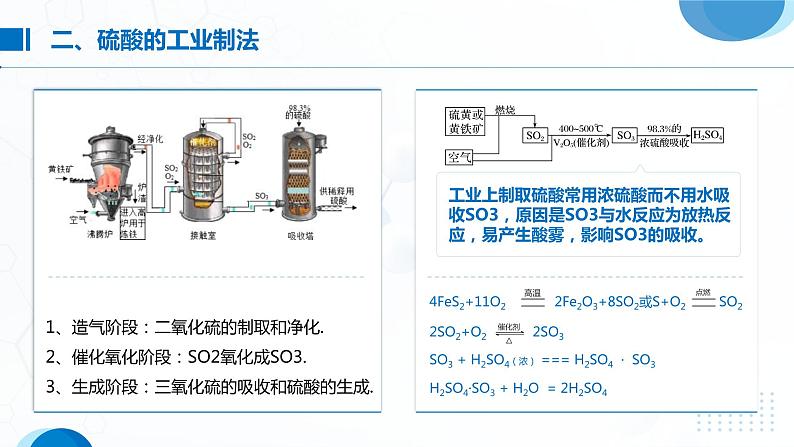
1、造气阶段:二氧化硫的制取和净化. 2、催化氧化阶段:SO2氧化成SO3. 3、生成阶段:三氧化硫的吸收和硫酸的生成.
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
H2SO4·SO3 + H2O = 2H2SO4
SO3 + H2SO4(浓) === H2SO4 · SO3
1. 稀硫酸的性质
①硫酸在水里很容易电离出H+,是强酸。
与活泼金属 (如Fe )
与碱 [如Mg(OH)2]
与碱性氧化物(如MgO)
与盐(如Na2CO3)
Fe+2H+===Fe2+ ++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2+++2H2O
(1) 吸水性:浓硫酸能吸收存在于周围环境中的水分及固体中的结晶水(化学变化),常用做 。
(2) 脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氧、氢元素按水的组成比脱去。
现象:蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并有刺激性气味的气体放出
Click here t enter yur text, change the clr r size f the text. Yu can als frmat the apprpriate text and adjust the line spacing f the text.
Matters needing attentin
注意:在实验时要防止浓硫酸溅到衣服或皮肤上而损坏衣服或灼伤皮肤。即通常所说的腐蚀性(脱水性)
③ 与具有还原性的化合物反应,如HI、HBr、H2S、FeCl2等。
加热时,浓硫酸也能与部分非金属反应(如C) 生成非金属氧化物,硫酸被还原成SO2气体。
请设计实验方案验证碳和浓硫酸反应的产物
d将a试管里的溶液慢慢倒入水中,溶液变为 。
a试管中铜丝表面 _______________________ 且溶液中有固体生成。
b试管中的品红溶液逐渐变为_______。
c试管中的紫色石蕊溶液逐渐变为_______。
逐渐变黑,有气泡产生
还原剂 氧化剂 氧化产物 还原产物
提示:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,一般没有氢气生成通常生成SO2气体。
(1) 2ml 的浓H2SO4与足量的铜反应,可制得多少SO2 ? (2) 浓硫酸在这个反应中体现了什么性质?(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
常温下,浓硫酸能使Fe、Al金属表面形成一层致密的氧化膜而钝化,从而阻止浓硫酸与铁、铝继续反应。
浓H2SO4:由H2SO4分子构成— 强氧化性(由 S 体现)—加热时可与大多数金属和某些非金属反应,通常生成SO2
稀H2SO4:由H+和SO42-构成——弱氧化性(由H+体现)—可与活泼金属反应生成H2
①浓硫酸能与大多数金属反应生成高价态金属的硫酸盐本身一般被还原为SO2②常温下,浓硫酸能使铁、铝钝化③浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸本身被还原为SO2
① 重要的化工原料,实验室必备的重要试剂。② 工业上可用于生产化肥、农药、炸药、染料、盐类等。③ 用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
可干燥:酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。不可干燥:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
1.下列各过程主要表现了浓硫酸的哪些性质?①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体 。
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸 。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体 。
解析:浓硫酸具有高沸点、难挥发性,氯化氢气体易挥发。
解析:磷酸是高沸点的中强酸,利用强酸与弱酸盐反应制弱酸的原理制磷酸。
解析:可干燥酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。不可干燥气体:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
六、课堂小结、深度思考
(4)常温下可以用铁或铝的容器贮存浓硫酸 。
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末 。
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体 。
解析:浓硫酸具有强氧化性,而溴化氢、碘化氢和硫化氢具有强还原性。
解析:常温下,浓硫酸和铝、铁反应,在金属表面生成一层薄而致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应。
解析:浓硫酸吸收胆矾晶体中的结晶水,使之变成无水硫酸铜白色粉末。
解析:浓硫酸可使湿润的蓝色石蕊试纸先变红,利用了浓硫酸的酸性,后变黑是把氢原子和氧原子按照2∶1脱去剩余碳,利用了浓硫酸的脱水性。
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑 。
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
2.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为: 。 利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为 。以上两种方法哪种好?______________ ,原因是 , 。
②第二种方法生成SO2会造成大气污染
先加稀盐酸的目是 。
现在我们炒菜用的精盐又细又白,粗盐中含有不溶性的泥沙以及一些可溶性的硫酸盐、CaCl2、MgCl2等杂质。你知道精盐是由粗盐经过什么样的程序制得的吗?
关键点:为保障杂质离子完全除去,只要碳酸钠溶液在氯化钡之后加入即可。
向奋斗在一线的老师致敬
人教版 (2019)必修 第二册第一节 硫及其化合物集体备课ppt课件: 这是一份人教版 (2019)必修 第二册<a href="/hx/tb_c4000033_t3/?tag_id=26" target="_blank">第一节 硫及其化合物集体备课ppt课件</a>,共1页。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教课ppt课件,共52页。PPT课件主要包含了第一节硫及其化合物,新课情景呈现,课前素能奠基,黄铁矿,SO2,SO3,H2O,有刺激性气味的气体,浓硫酸具有脱水性,液体中的等内容,欢迎下载使用。
人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物课前预习课件ppt: 这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物课前预习课件ppt,共59页。













