





人教版 (2019)第一节 化学反应与能量变化精品ppt课件
展开1、通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随能量变化的观念。
2、能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因,提升证据推理能力。
3、通过多种渠道了解人类对化学反应中能量的利用情况,了解节能的意义和方法,感受化学学科的社会价值,培养科学态度与社会责任。
实验探究一:镁和稀盐酸的反应
有气泡产生,用温度计测量,水银柱上升。
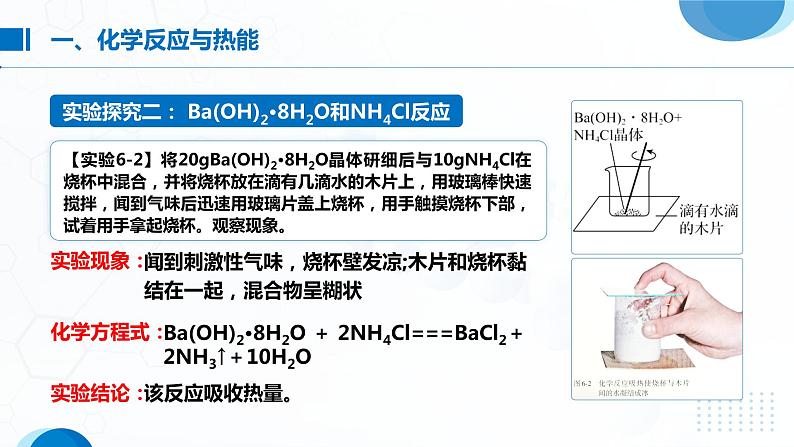
闻到刺激性气味,烧杯壁发凉;木片和烧杯黏结在一起,混合物呈糊状
Ba(OH)2·8H2O + 2NH4Cl===BaCl2+2NH3↑+10H2O
【实验6-2】将20gBa(OH)2•8H2O晶体研细后与10gNH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯。观察现象。
吸热反应: 热量的化学反应;放热反应: 热量的化学反应。
★ 两个基本自然规律——“质量守恒”和“能量守恒”(1)质量守恒定律:自然界中的物质发生转化时总质量保持不变。(2)能量守恒定律:不同形式的能量发生转换时总能量保持不变。
①放热反应:燃烧反应、金属和水或酸的反应、酸碱中和反应、部分化合反应(如生石灰和水反应)、物质的缓慢氧化等。放热过程:浓硫酸稀释、氢氧化钠固体溶解等。
②吸热反应: 部分化合反应(如:C和CO2反应)、C和H2以及CO为还原剂的反应、Ba(OH)2·8H2O和NH4Cl反应、大部分分解反应如煅烧石灰石。吸热过程:大多数铵盐溶于水。
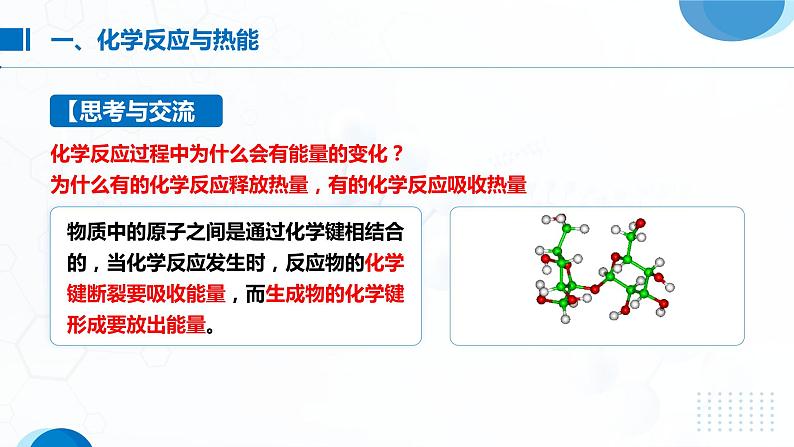
化学反应过程中为什么会有能量的变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
+ =
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。化学键的断裂和形成是化学反应中能量变化的主要原因。
当物质发生化学反应时,断开反应物中的化学键要吸收能量;而形成生成物中的化学键要放出能量。
①断键:断开1 ml H2中的H—H键要______436 kJ能量,断开1 ml Cl2中的Cl—Cl键要_______243 kJ的能量。则断键共需吸收______ kJ的能量。②成键:形成2 ml HCl中的H—Cl键要______862 kJ的能量。③结论:断键吸收的总能量______成键释放的能量,所以发生了______反应。因此:化学键的__________________是物质在化学反应中发生能量变化的主要原因。
实例:H2(g) + Cl2(g) = 2HCl(g)。(25℃,101kPa)
化学键的断裂和形成是化学反应中能量变化的主要原因。
(2)能量变化的决定因素
反应物的总能量>生成物的总能量
反应物的总能量<生成物的总能量
反应物的总能量<生成物的总能量
反应物的能量之和 E反
生成物的能量之和 E生
若E反> E生,放出能量。发生放热反应
若E反< E生,吸收能量。发生吸热反应
(1)“三个不一定”①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;②放热反应常温下不一定容易发生,如铝热反应;③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化NaOH固体溶于水是放热过程,但不是放热反应;升华、蒸发等过程是吸热过程,但不是吸热反应。
(1)人类利用能源的三个阶段 :
煤、石油、_______
_____能、风能、 _____能、海洋能和_____能等
时期、 时期和 时期。
利用过程中面临两个问题
一个是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;另一个环节是能量利用阶段,可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
1、有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。如图所示:
在此构想的物质循环中太阳能最终转化为( )A.化学能 B.热能C.生物质能 D.电能
4.断开1 ml H—H键、1 ml N—H键、1 ml N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ。求:(1)1 ml N2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ。
(2)1 ml H2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ(不考虑可逆反应)。
7、 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:(1)实验中观察到的现象是___________________ (2)产生上述现象的原因是___________________ (3)写出有关反应的离子方程式___________________ (4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
(1)镁片上有大量气泡产生;镁片逐渐溶解;烧杯中析出晶体,溶液变浑浊(2)镁与盐酸反应产生氢气,该反应为放热反应;Ca(OH)2在水中的溶解度随温度的升高而减小,故析出Ca(OH)2晶体(3) 小于
向奋斗在一线的老师致敬
化学必修 第二册第一节 化学反应与能量变化课文配套ppt课件: 这是一份化学必修 第二册<a href="/hx/tb_c4000040_t3/?tag_id=26" target="_blank">第一节 化学反应与能量变化课文配套ppt课件</a>,共53页。PPT课件主要包含了实验探究,答案D,答案B,答案A等内容,欢迎下载使用。
高中人教版 (2019)第一节 化学反应与能量变化背景图课件ppt: 这是一份高中人教版 (2019)<a href="/hx/tb_c4000040_t3/?tag_id=26" target="_blank">第一节 化学反应与能量变化背景图课件ppt</a>,共1页。
高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化获奖课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化获奖课件ppt,共23页。PPT课件主要包含了新课讲授,化学能与热能,实验探究,课堂练习,吸收还是放出热量,放出183,人类对能源的利用,课堂小结等内容,欢迎下载使用。













