




还剩33页未读,
继续阅读
所属成套资源:最新人教版(2019)高中化学必修第二册PPT课件整套
成套系列资料,整套一键下载
第六章《化学反应与能量》(第2课时)复习课件
展开
这是一份第六章《化学反应与能量》(第2课时)复习课件,共41页。
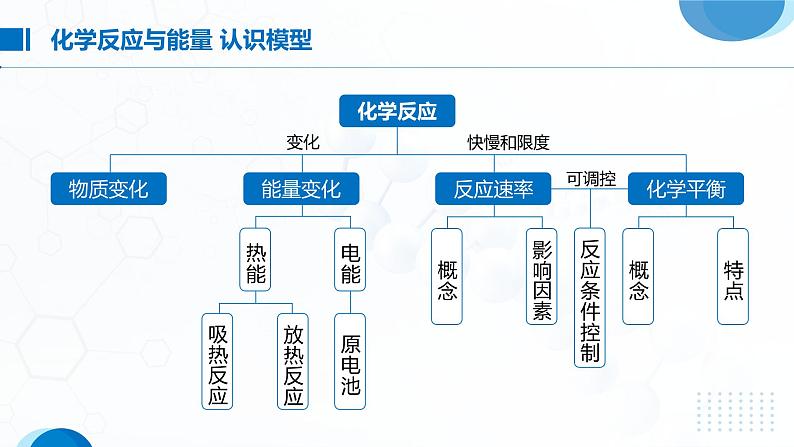
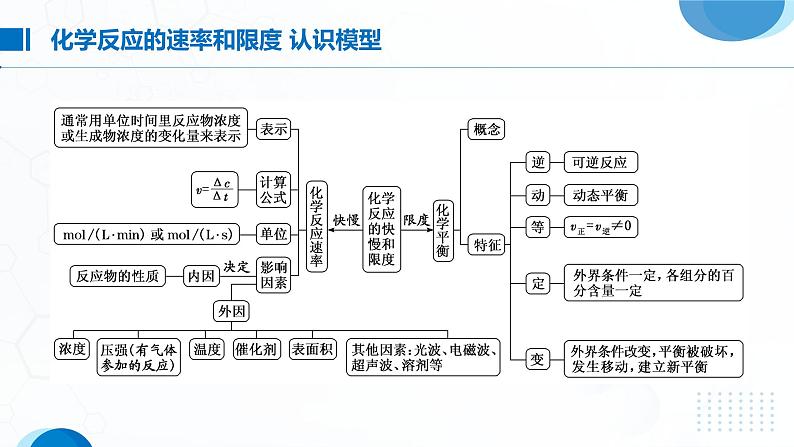
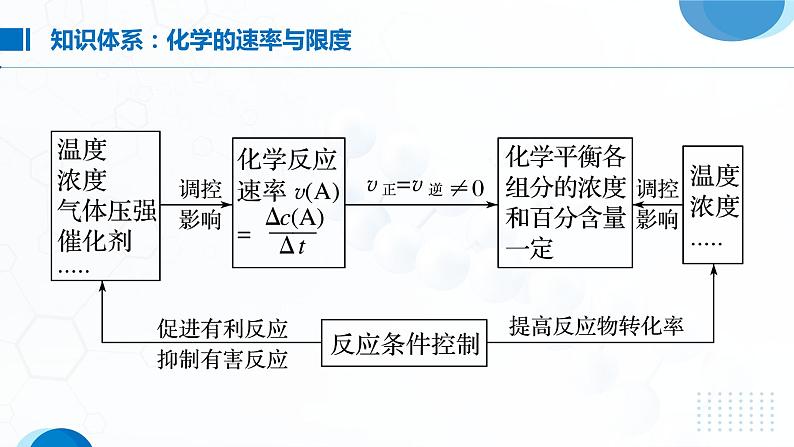
第2课时 化学反应的速率与限度第六章化学反应与能量Click here to enter your text, change the color or size of the text. You can also format the appropriate text and adjust the line spacing of the text. 专题复习选择性必修一通常用单位时间内反应物浓度的_______或生成物浓度的_______来表示。v(B)= ,单位为____________________ 或__________________。(B)同一反应在同一时间内,用不同物质来表示的反应速率可能_______,但反应速率的数值之比等于这些物质在化学方程式中的_____________之比。如在反应aA(g)+bB(g) cC(g)+dD(g)中存在:v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶dmol·L-1·min-1mol·L-1·s-1 等不同化学计量数减少增加由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。(1)看单位是否统一,若不统一,换算成相同的单位。(2)换算成同一物质表示的速率,再比较数值的大小。(3)比较化学反应速率与化学计量数的比值,即对于一般反应aA+bB=== cC+dD,比较 ,则A表示的反应速率比B的大。(1)计算模式设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,mx mol·L-1为反应物A的转化浓度,nx mol·L-1为反应物B的转化浓度,则: m A(g)+n B(g) p C(g)+q D(g)起始浓度/(mol·L-1) a b 0 0转化浓度/(mol·L-1) mx nx px qx终态浓度/(mol·L-1) a-mx b-nx px qx(2)基本步骤①确定反应物或生成物的起始加入量;②确定反应过程中各物质浓度的变化量;③确定反应进行至某时刻时各物质的量;④依据题干中的条件建立等式关系进行解答;⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之 比进行解答。在2 L密闭容器中,发生以下反应:2A(g)+B(g) 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol·L-1·s-1,则10 s时,容器中B的物质的量是( )A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 molB在2A+3B===2C+D的反应中,表示反应速率最快的是( )DA.v(A)=0.5 mol·L-1·min-1B.v(B)=0.6 mol·L-1·min-1C.v(C)=0.35 mol·L-1·min-1D.v(D)=0.4 mol·L-1·min-1在新型RuO2催化剂作用下,使HCl转化为Cl2的反应2HCl(g)+ H2O(g)+Cl2(g)具有更好的催化活性。一定条件下测得反应过程中n(Cl2)的数据如下:计算2~6 min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。所以v(HCl)=2v(Cl2)=2×9.0×10-4 mol·min-1=1.8×10-3 mol·min-1解法一 2~6 min时间内Δn(Cl2)=5.4×10-3 mol-1.8×10-3 mol=3.6×10-3 mol2 1n (5.4-1.8)×10-3 mol解法二 HCl转化的物质的量为n,则NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2, 4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是( )A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.25 mol·L-1·min-1CAX、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )A. ×100% B. ×100%C. ×100% D. ×100%B【解析】 设反应达到平衡时消耗Y物质的量为x。则: X + 2Y 2Z起始量/mol a b 0转变量/mol x x平衡量/mol a- b-x x增大反应物浓度,反应速率______,反之______对于有气体参加的反应,增大压强,反应速率______,反之______升高温度,反应速率______,反之______使用催化剂,能改变化学反应速率,且正、逆反应速率的改变程度______反应物间的__________、光、电磁波、超声波等接触面积加快 减慢加快减慢加快减慢相同—— 反应物本身的性质(1)确定变量:解答这类题目时首先要认真审题,找出影响实验探究结果的因素。(2)定多变一:在探究时,应先控制其他的因素不变,只改变一种因素,探究这种因素与题给问题的关系,然后按此方法依次分析其他因素与所探究问题的关系。(3)数据有效:解答时注意选择的数据(或设置实验)要有效,且变量统一,否则无法做出正确判断。下列各组物质进行反应(表内物质均为反应物),反应刚开始时,放出H2的速率最快的是( )C一定温度下,反应N2(g)+O2(g)⇌ 2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”“减小”或“不变”)(1)缩小体积使压强增大:_____。(2)恒容充入N2:_____。(3)恒容充入He:_____。(4)恒压充入He:_____。增大增大不变减小下列措施能减慢化学反应速率的是( )A. 用Zn和2 mol·L-1 H2SO4溶液反应制取H2时,向溶液中滴加少 量CuSO4溶液B. 日常生活中,将食物贮藏在冰箱中C. 用过氧化氢溶液制氧气时添加少量二氧化锰粉末D. 用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气C反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是( )①增加铁的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持体积不变,充入水蒸气使体系压强增大A.①④ B.②③ C.③④ D.②④D草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4— +5H2C2O4+6H+==2Mn2++10CO2↑+8H2O。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。催化剂Ⅲ 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同(2)实验Ⅳ中加入1 mL蒸馏水的目的是:(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。催化剂Ⅲ确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同(2)实验Ⅳ中加入1 mL蒸馏水的目的是: _________________________________________________________________________________ 。(1) 可逆反应:在_________下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。(2) 化学平衡状态:一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的___________保持不变的状态。同一条件质量或浓度(3)化学平衡的建立:正反应逆反应1.直接标志(1) v正=v逆≠0(化学平衡的本质)①同一种物质的生成速率等于消耗速率。②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于相应物质的化学计量数之比。③化学方程式两边的不同物质的生成(或消耗)速率之比等于相应物质的化学计量数之比。(2) 各组分的浓度保持一定(化学平衡的特征)①各组分的浓度不随时间的改变而改变。②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。2.间接标志——“变→不变”(1)反应体系中的总压强不随时间的改变而变化(适用于有气体参与且反应前后气体的体积不等的可逆反应)。(2)混合气体的密度不随时间的改变而变化(适用于①恒压且反应前后气体的体积不等的可逆反应;②恒容且有固体、液体参与或生成的可逆反应)。(3)对于反应混合物中存在有颜色物质的可逆反应,若体系的颜色不再改变,则反应达到平衡状态。(4)体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数 之比。②恒温恒容下气体体积不变的反应,体系的压强或总物质的量不再随 时间而变化。③全是气体参加体积不变的反应,体系的平均相对分子质量不再随时 间而变化。④全是气体参加的反应,恒容条件下体系的密度保持不变。C一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是 ( )A.单位时间内生成n mol A2同时生成n mol ABB.容器内的总压强不随时间的变化而变化C.单位时间内生成2n mol AB同时生成n mol B2D.单位时间内生成n mol A2同时生成n mol B2 C在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应), 不能说明已经达到平衡状态的是( )A. 正反应生成NO2的速率和逆反应生成O2的速率相等B. 反应容器中压强不变C. 混合气体颜色深浅保持不变D. 混合气体的平均相对分子质量不随时间变化而变化AA可逆反应:2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是 ( )①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦ B.②③⑤⑦C.①③④⑤ D.全部 ①看面:理解各坐标轴所代表量的意义及曲线所示的是哪些量之间的关系。②看线:分清正反应和逆反应,分清突变和渐变、小变和大变;理解曲线“平”与“陡”即斜率大小的意义;理解曲线的变化趋势并归纳出规律。若图中有拐点,可按照先拐先平的规律,即较早出现拐点的曲线所表示的反应先达到平衡,对应的温度高、压强大。化学反应速率与化学反应限度问题常以图像题的形式出现,在相关图像的平面直角坐标系中,可能出现的物理量有物质的量、浓度、压强、时间等。这类问题要按照“一看、二想、三判断”这三个步骤来分析解答。③看点:理解曲线上点的意义,特别是某些特殊点,如坐标轴的交点、几条曲线 的交叉点、极值点、转折点等。分清反应物和生成物,浓度减小的是反应物, 浓度增大的是生成物。④看辅助线:做横轴或纵轴的垂直线(如等温线、等压线、平衡线等)。⑤看量的变化:弄清楚是物质的量的变化、浓度的变化还是转化率的变化。如各物质的转化量之比与化学计量数之比的关系、各物质的化学反应速率之比与化学计量数之比的关系、外界条件的改变对化学反应的影响以及对正、逆反应速率的影响规律等。在实验Ⅰ和实验Ⅱ中,用一定量、一定浓度的盐酸与足量的石灰石反应,并在一定的时间内测量反应所放出的CO2的体积。实验Ⅰ用的是块状的石灰石,实验Ⅱ用的是粉末状的石灰石。下图中能正确反应这两种实验结果的图像是( )B在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )A. t2时,v (正)=v (逆)B. 加入催化剂反应速率不变C. t1时容器内气体的总压强比t2时的大D. t3时,容器中c (Cl2)=c (H2O)=0.4 mol·L-1C一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。>(2)4 min内,CO2的转化率为________;CO的平均反应速率v(CO)=_______________________。71.4%0.125 mol·L-1·min-1(1)t1 min时,正、逆反应速率的大小关系为v 正 ___v 逆 (填“>”“<”或“=”)。(3)下列条件的改变能减慢其反应速率的是_______(填序号)。①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持容积不变,充入He使体系压强增大① ③向奋斗在一线的老师致敬课堂小结感谢您的观看选择性必修一
第2课时 化学反应的速率与限度第六章化学反应与能量Click here to enter your text, change the color or size of the text. You can also format the appropriate text and adjust the line spacing of the text. 专题复习选择性必修一通常用单位时间内反应物浓度的_______或生成物浓度的_______来表示。v(B)= ,单位为____________________ 或__________________。(B)同一反应在同一时间内,用不同物质来表示的反应速率可能_______,但反应速率的数值之比等于这些物质在化学方程式中的_____________之比。如在反应aA(g)+bB(g) cC(g)+dD(g)中存在:v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶dmol·L-1·min-1mol·L-1·s-1 等不同化学计量数减少增加由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。(1)看单位是否统一,若不统一,换算成相同的单位。(2)换算成同一物质表示的速率,再比较数值的大小。(3)比较化学反应速率与化学计量数的比值,即对于一般反应aA+bB=== cC+dD,比较 ,则A表示的反应速率比B的大。(1)计算模式设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,mx mol·L-1为反应物A的转化浓度,nx mol·L-1为反应物B的转化浓度,则: m A(g)+n B(g) p C(g)+q D(g)起始浓度/(mol·L-1) a b 0 0转化浓度/(mol·L-1) mx nx px qx终态浓度/(mol·L-1) a-mx b-nx px qx(2)基本步骤①确定反应物或生成物的起始加入量;②确定反应过程中各物质浓度的变化量;③确定反应进行至某时刻时各物质的量;④依据题干中的条件建立等式关系进行解答;⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之 比进行解答。在2 L密闭容器中,发生以下反应:2A(g)+B(g) 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol·L-1·s-1,则10 s时,容器中B的物质的量是( )A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 molB在2A+3B===2C+D的反应中,表示反应速率最快的是( )DA.v(A)=0.5 mol·L-1·min-1B.v(B)=0.6 mol·L-1·min-1C.v(C)=0.35 mol·L-1·min-1D.v(D)=0.4 mol·L-1·min-1在新型RuO2催化剂作用下,使HCl转化为Cl2的反应2HCl(g)+ H2O(g)+Cl2(g)具有更好的催化活性。一定条件下测得反应过程中n(Cl2)的数据如下:计算2~6 min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。所以v(HCl)=2v(Cl2)=2×9.0×10-4 mol·min-1=1.8×10-3 mol·min-1解法一 2~6 min时间内Δn(Cl2)=5.4×10-3 mol-1.8×10-3 mol=3.6×10-3 mol2 1n (5.4-1.8)×10-3 mol解法二 HCl转化的物质的量为n,则NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2, 4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是( )A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.25 mol·L-1·min-1CAX、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )A. ×100% B. ×100%C. ×100% D. ×100%B【解析】 设反应达到平衡时消耗Y物质的量为x。则: X + 2Y 2Z起始量/mol a b 0转变量/mol x x平衡量/mol a- b-x x增大反应物浓度,反应速率______,反之______对于有气体参加的反应,增大压强,反应速率______,反之______升高温度,反应速率______,反之______使用催化剂,能改变化学反应速率,且正、逆反应速率的改变程度______反应物间的__________、光、电磁波、超声波等接触面积加快 减慢加快减慢加快减慢相同—— 反应物本身的性质(1)确定变量:解答这类题目时首先要认真审题,找出影响实验探究结果的因素。(2)定多变一:在探究时,应先控制其他的因素不变,只改变一种因素,探究这种因素与题给问题的关系,然后按此方法依次分析其他因素与所探究问题的关系。(3)数据有效:解答时注意选择的数据(或设置实验)要有效,且变量统一,否则无法做出正确判断。下列各组物质进行反应(表内物质均为反应物),反应刚开始时,放出H2的速率最快的是( )C一定温度下,反应N2(g)+O2(g)⇌ 2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”“减小”或“不变”)(1)缩小体积使压强增大:_____。(2)恒容充入N2:_____。(3)恒容充入He:_____。(4)恒压充入He:_____。增大增大不变减小下列措施能减慢化学反应速率的是( )A. 用Zn和2 mol·L-1 H2SO4溶液反应制取H2时,向溶液中滴加少 量CuSO4溶液B. 日常生活中,将食物贮藏在冰箱中C. 用过氧化氢溶液制氧气时添加少量二氧化锰粉末D. 用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气C反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是( )①增加铁的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持体积不变,充入水蒸气使体系压强增大A.①④ B.②③ C.③④ D.②④D草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4— +5H2C2O4+6H+==2Mn2++10CO2↑+8H2O。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。催化剂Ⅲ 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同(2)实验Ⅳ中加入1 mL蒸馏水的目的是:(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。催化剂Ⅲ确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同(2)实验Ⅳ中加入1 mL蒸馏水的目的是: _________________________________________________________________________________ 。(1) 可逆反应:在_________下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。(2) 化学平衡状态:一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的___________保持不变的状态。同一条件质量或浓度(3)化学平衡的建立:正反应逆反应1.直接标志(1) v正=v逆≠0(化学平衡的本质)①同一种物质的生成速率等于消耗速率。②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于相应物质的化学计量数之比。③化学方程式两边的不同物质的生成(或消耗)速率之比等于相应物质的化学计量数之比。(2) 各组分的浓度保持一定(化学平衡的特征)①各组分的浓度不随时间的改变而改变。②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。2.间接标志——“变→不变”(1)反应体系中的总压强不随时间的改变而变化(适用于有气体参与且反应前后气体的体积不等的可逆反应)。(2)混合气体的密度不随时间的改变而变化(适用于①恒压且反应前后气体的体积不等的可逆反应;②恒容且有固体、液体参与或生成的可逆反应)。(3)对于反应混合物中存在有颜色物质的可逆反应,若体系的颜色不再改变,则反应达到平衡状态。(4)体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数 之比。②恒温恒容下气体体积不变的反应,体系的压强或总物质的量不再随 时间而变化。③全是气体参加体积不变的反应,体系的平均相对分子质量不再随时 间而变化。④全是气体参加的反应,恒容条件下体系的密度保持不变。C一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是 ( )A.单位时间内生成n mol A2同时生成n mol ABB.容器内的总压强不随时间的变化而变化C.单位时间内生成2n mol AB同时生成n mol B2D.单位时间内生成n mol A2同时生成n mol B2 C在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应), 不能说明已经达到平衡状态的是( )A. 正反应生成NO2的速率和逆反应生成O2的速率相等B. 反应容器中压强不变C. 混合气体颜色深浅保持不变D. 混合气体的平均相对分子质量不随时间变化而变化AA可逆反应:2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是 ( )①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦ B.②③⑤⑦C.①③④⑤ D.全部 ①看面:理解各坐标轴所代表量的意义及曲线所示的是哪些量之间的关系。②看线:分清正反应和逆反应,分清突变和渐变、小变和大变;理解曲线“平”与“陡”即斜率大小的意义;理解曲线的变化趋势并归纳出规律。若图中有拐点,可按照先拐先平的规律,即较早出现拐点的曲线所表示的反应先达到平衡,对应的温度高、压强大。化学反应速率与化学反应限度问题常以图像题的形式出现,在相关图像的平面直角坐标系中,可能出现的物理量有物质的量、浓度、压强、时间等。这类问题要按照“一看、二想、三判断”这三个步骤来分析解答。③看点:理解曲线上点的意义,特别是某些特殊点,如坐标轴的交点、几条曲线 的交叉点、极值点、转折点等。分清反应物和生成物,浓度减小的是反应物, 浓度增大的是生成物。④看辅助线:做横轴或纵轴的垂直线(如等温线、等压线、平衡线等)。⑤看量的变化:弄清楚是物质的量的变化、浓度的变化还是转化率的变化。如各物质的转化量之比与化学计量数之比的关系、各物质的化学反应速率之比与化学计量数之比的关系、外界条件的改变对化学反应的影响以及对正、逆反应速率的影响规律等。在实验Ⅰ和实验Ⅱ中,用一定量、一定浓度的盐酸与足量的石灰石反应,并在一定的时间内测量反应所放出的CO2的体积。实验Ⅰ用的是块状的石灰石,实验Ⅱ用的是粉末状的石灰石。下图中能正确反应这两种实验结果的图像是( )B在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )A. t2时,v (正)=v (逆)B. 加入催化剂反应速率不变C. t1时容器内气体的总压强比t2时的大D. t3时,容器中c (Cl2)=c (H2O)=0.4 mol·L-1C一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。>(2)4 min内,CO2的转化率为________;CO的平均反应速率v(CO)=_______________________。71.4%0.125 mol·L-1·min-1(1)t1 min时,正、逆反应速率的大小关系为v 正 ___v 逆 (填“>”“<”或“=”)。(3)下列条件的改变能减慢其反应速率的是_______(填序号)。①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持容积不变,充入He使体系压强增大① ③向奋斗在一线的老师致敬课堂小结感谢您的观看选择性必修一
相关资料
更多









