



高中化学第一节 化学反应速率试讲课课件ppt
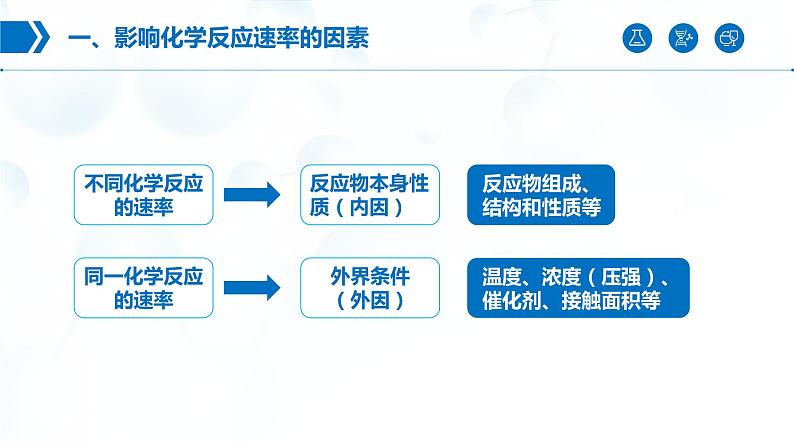
展开一、影响化学反应速率的因素
反应物本身性质(内因)
探究: 定性与定量研究影响化学反应速率的因素
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
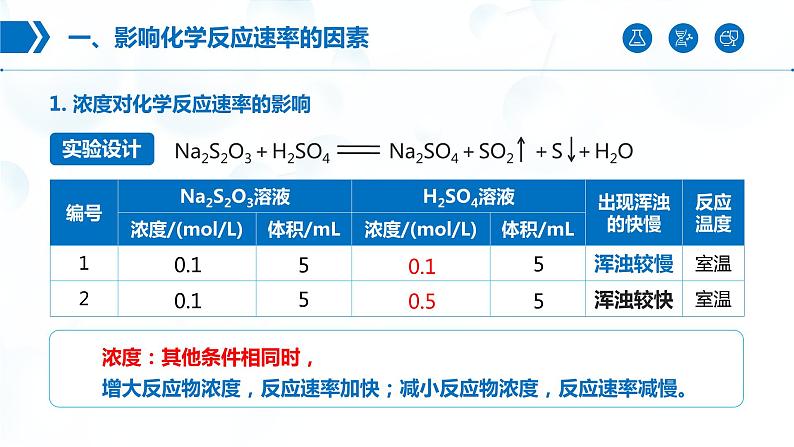
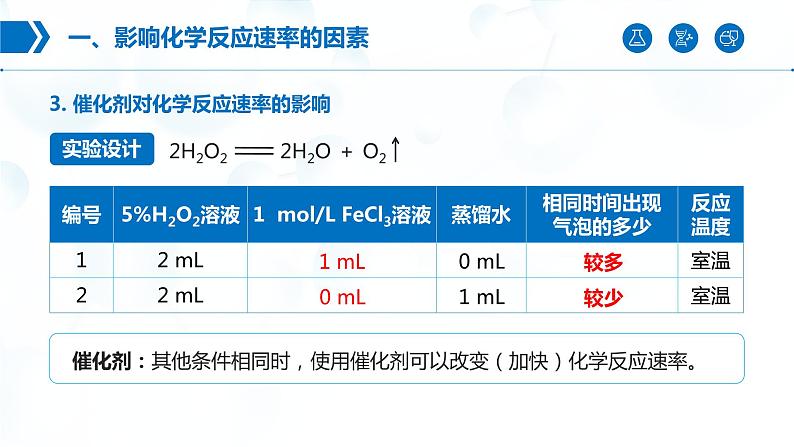
0.1 ml/L Na2S2O3溶液、 0.1 ml/L H2SO4溶液、 0.5 ml/L H2SO4溶液、5% H2O2溶液、1 ml/L FeCl3溶液、蒸馏水、热水。
1. 选取同一个反应,探究不同因素产生的影响。2. 选取不同的反应,探究同一因素产生的影响。
1. 浓度对化学反应速率的影响
2. 温度对化学反应速率的影响
3. 催化剂对化学反应速率的影响
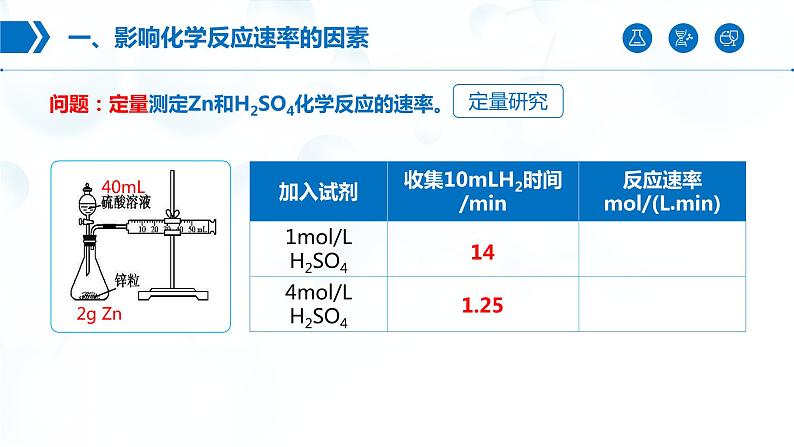
问题:定量测定Zn和H2SO4化学反应的速率。
4. 接触面积对化学反应速率的影响
思考:压强对化学反应速率的影响?
恒容时,向反应2SO2+O2 2SO3充入N2气,化学反应速率如何变化?恒压时,向反应2SO2+O2 2SO3充入N2,化学反应速率如何变化?
光辐射、放射线辐照、超声波、电弧、强磁场、高速研磨等,总之,向反应体系输入能量,都有可能影响化学反应速率。
例如:2HI = H2+I2 实际上是经过下列两步反应完成的:
带有单电子的原子或原子团。
每一步反应都称为基元反应。
反应机理:这两个先后进行的基元反应反应了 2HI = H2+I2 的反应历程,反应历程 又称反应机理。
2.活化能与简单碰撞理论
(1)基元反应发生的先决条件是反应物的分子必须互相接触发生碰撞。我们把能够发生化学反应的碰撞叫做 。能量较高,能够发生有效碰撞的反应物分子叫做 。
( 2 ) 化学反应一般需要一个活化的过程,即能发生反应的分子,必 须是先 能量后形成活化分子。( 3 ) 活化分子具有的平均能量与反应物分子具有的平均能量之差, 叫做反应的活化能。( 4 ) 解释化学反应的过程
反应热 = E1 - E2
增大反应物的浓度 :
增大压强(压缩体积):
3. 碰撞理论解释化学反应速率的影响因素
催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率,反应速率大幅提高。
影响化学反应速率的因素
1.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行, 下列条件的改变对其反应速率几乎无影响的是( ) A.增加C的量 B.将容器的体积缩小一半 C.保持体积不变,充入H2O(g)使体系压强增大 D.保持压强不变,充入N2使容器体积变大
2.已知CO2+C===2CO是吸热反应,反应速率为v1;N2+3H2===2NH3是 放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情 况为( ) A.同时增大 B.同时减小 C.v1增大,v2减小D.v1减小,v2增大
3.对于在一密闭容器中进行的反应:C(s)+O2(g) CO2(g),下列说法中 错误的是( ) A.将木炭粉碎成粉末状可以加快化学反应速率 B.升高温度可以加快化学反应速率 C.用空气代替O2可以加快化学反应速率 D.增加木炭的量不能加快化学反应速率
CLASS SUMMARY
向奋斗在一线的老师致敬
化学选择性必修1专题2 化学反应速率与化学平衡第一单元 化学反应速率获奖课件ppt: 这是一份化学选择性必修1专题2 化学反应速率与化学平衡第一单元 化学反应速率获奖课件ppt,共60页。PPT课件主要包含了内容索引,课时对点练,有效碰撞,平均能量,所有分子,一次碰撞,活化能,正误判断,应用体验,①②=③④等内容,欢迎下载使用。
高中第一单元 化学反应速率课文内容ppt课件: 这是一份高中第一单元 化学反应速率课文内容ppt课件,共60页。PPT课件主要包含了课时对点练等内容,欢迎下载使用。
苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度授课ppt课件: 这是一份苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度授课ppt课件,共16页。PPT课件主要包含了问题导学,举题说法等内容,欢迎下载使用。













