




所属成套资源:新人教版化学选择性必修1PPT课件全套
- 第二章《化学反应速率与化学平衡》专题复习课件 课件 6 次下载
- 3.1《电离平衡》课件 课件 4 次下载
- 3.2《水的电离和溶液的pH》(第2课时)课件 课件 2 次下载
- 3.3《盐类的水解》(第1课时)课件 课件 4 次下载
- 3.3《盐类的水解》(第2课时)课件 课件 3 次下载
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件,共34页。PPT课件主要包含了学习目标,回顾旧知,思考一下,什么是弱电解质,精确的纯水导电性实验,活动与探究,水的电离,水的离子积Kw,2加入酸,3加入碱等内容,欢迎下载使用。
1.变化观念与平衡思想
认识水的电离存在电离平衡,了解水的电离平衡的影响因素,知道水的离子积常数,会分析水的电离平衡移动。
通过分析、推理等方法知道溶液pH的概念、溶液酸碱性与pH的关系,建立溶液酸碱性判断的思维模型。
2.证据推理与模型认知
水乃生命之源,你对水又了解多少呢?
部分电离的电解质叫弱电解质。
电解质溶液中的溶剂水以何形式存在呢?
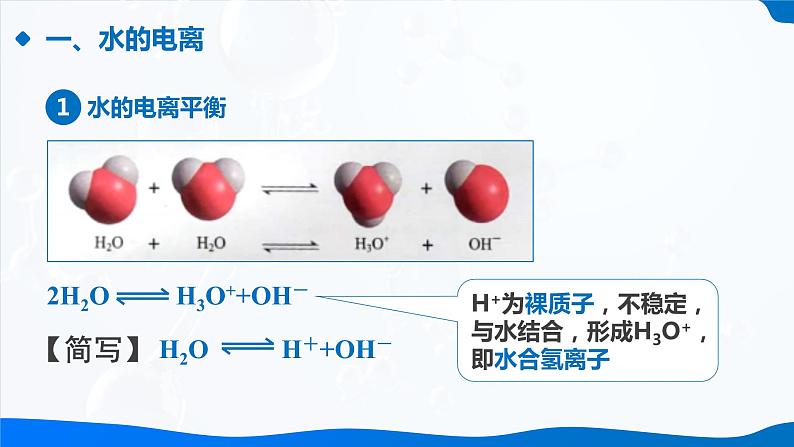
电离特点:可逆的,存在电离平衡
弱电解质的电离有什么特点?
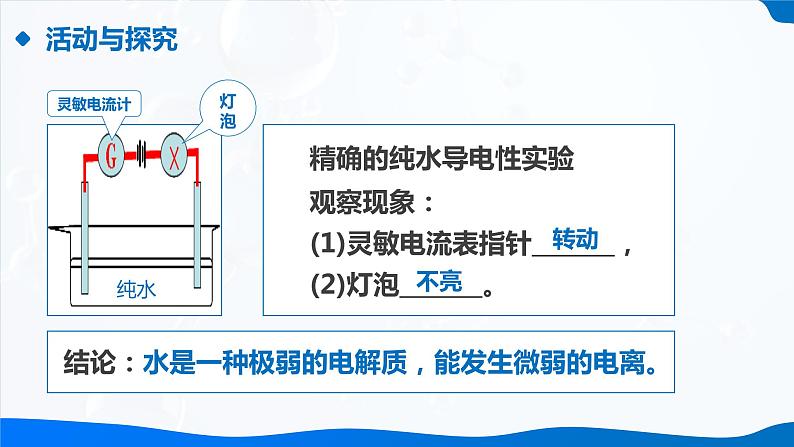
观察现象:(1)灵敏电流表指针_______,(2)灯泡_______。
结论:水是一种极弱的电解质,能发生微弱的电离。
H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
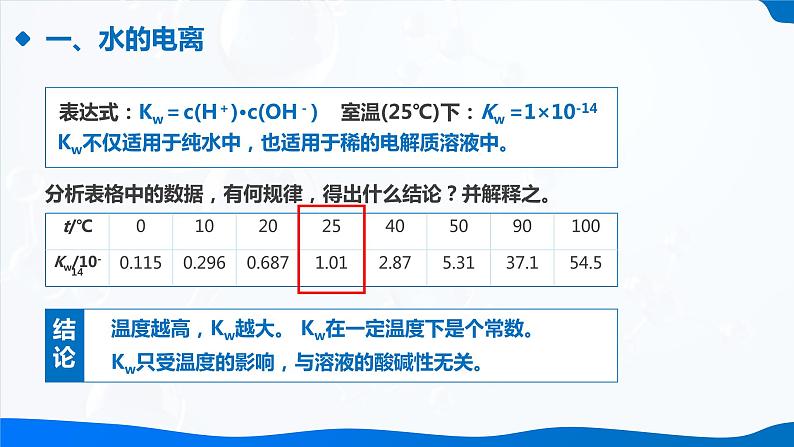
室温(25℃)下:Kw =1×10-14
Kw不仅适用于纯水中,也适用于稀的电解质溶液中。
分析表格中的数据,有何规律,得出什么结论?并解释之。
温度越高,Kw越大。 Kw在一定温度下是个常数。
Kw只受温度的影响,与溶液的酸碱性无关。
分析下列条件的改变对水的电离平衡 H2O⇌H++OH-ΔH>0的影响并填写下表:
正向移动 增大 增大 增大 增大
逆向移动 减小 增大 减小 不变
正向移动 减小 增大 增大 不变
逆向移动 增大 减小 减小 不变
增大c(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则c(OH-)必然会减小。
H2O⇌H+ +OH-
(1)水电离吸热,升温将促进水的电离,故平衡右移。
影响水的电离平衡的因素
例1.某温度下,纯水的c(H+)=2×10-7 ml·L-1,则此时纯水的c(OH-)为________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 ml·L-1,则溶液中c(OH-)为 _______________ 此时温度 ____ (填“高于”“低于”或“等于”)25 ℃。
解析:纯水中的H+的浓度一定等于OH-的浓度,因此某温度下,纯水的c(H+)=2×10-7 ml·L-1,则此时纯水的c(OH-)=2×10-7 ml·L-1。该温度下的离子积常数是4×10-14若温度不变,滴入稀盐酸使c(H+)=5×10-4 ml·L-1则溶液中c(OH-)= ml·L-1=8×10-11 ml·L-1。由于此时水的离子积常数大于10-14水电离吸热,所以此时温度高于25 ℃。
2×10-7 ml·L-1
8×10-11 ml·L-1
例2.水的电离过程为H2O H++OH-,在25 ℃时,水的离子积Kw=1.0×10-14;在35 ℃时,水的离子积Kw=2.1×10-14。则下列叙述正确的是( )A.c(H+)随着温度的升高而降低B.35 ℃时,c(H+)>c(OH-)C.35 ℃时的水比25 ℃时的水电离程度小D.水的电离是吸热过程
点拨:水电离出的c(H+)或c(OH-)的计算思路Kw表达式中c(H+)、c(OH-)均表示整个溶液中所有H+、OH-的总物质的量浓度,但是一般情况下有:(1)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度)。(2)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度)(3)外界条件改变,水的电离平衡发生移动;但由水电离出的c水(H+)与c水(OH-)一定相等。
c(H+) =c(OH-)
c(H+)>c(OH-)
c(H+)c (OH-)
c (H+)
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优质ppt课件,文件包含第二节水的电离和溶液的酸碱性ppt、实验活动2强酸与强碱的中和滴定mp4等2份课件配套教学资源,其中PPT共58页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH精品ppt课件,共36页。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH图文ppt课件,共38页。









