


- 3.3《盐类的水解》(第1课时)课件 课件 4 次下载
- 3.3《盐类的水解》(第2课时)课件 课件 3 次下载
- 3.4《沉淀溶解平衡》(第2课时)课件 课件 2 次下载
- 4.1《原电池》(第1课时)课件 课件 3 次下载
- 4.1《原电池》(第2课时)课件 课件 2 次下载
化学选择性必修1第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡完整版课件ppt
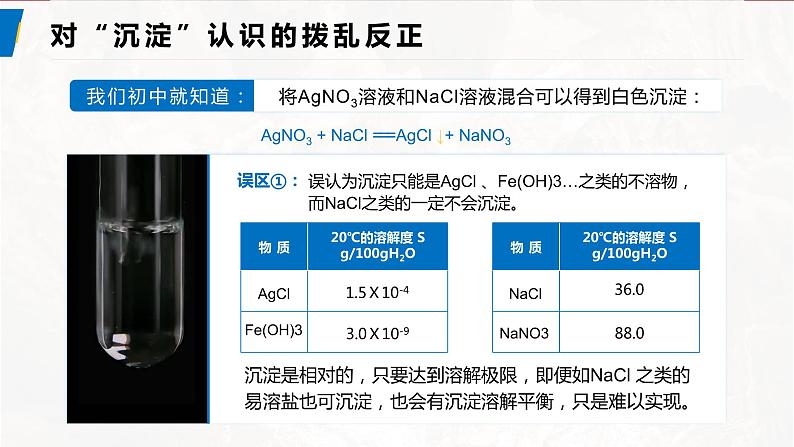
展开对“沉淀”认识的拨乱反正
AgNO3 + NaCl === AgCl ↓+ NaNO3
沉淀是相对的,只要达到溶解极限,即便如NaCl 之类的易溶盐也可沉淀,也会有沉淀溶解平衡,只是难以实现。
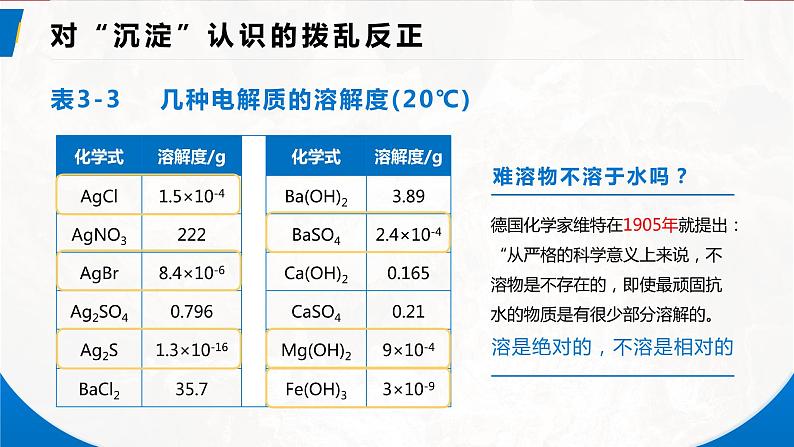
表3-3 几种电解质的溶解度(20℃)
德国化学家维特在1905年就提出:“从严格的科学意义上来说,不溶物是不存在的,即使最顽固抗水的物质是有很少部分溶解的。
溶是绝对的,不溶是相对的
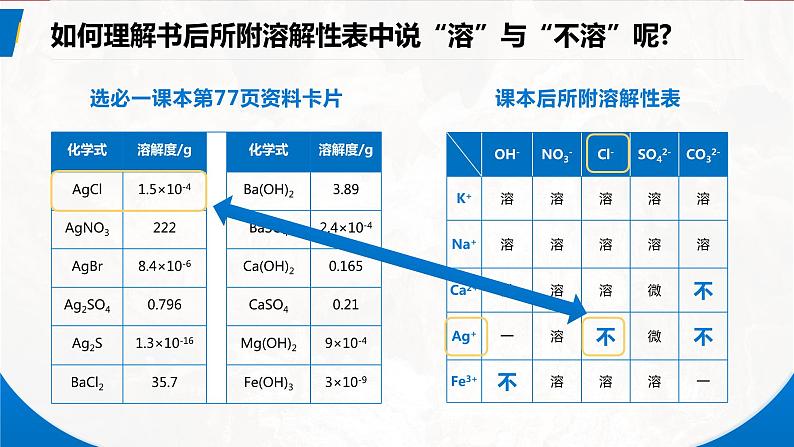
如何理解书后所附溶解性表中说“溶”与“不溶”呢?
选必一课本第77页资料卡片
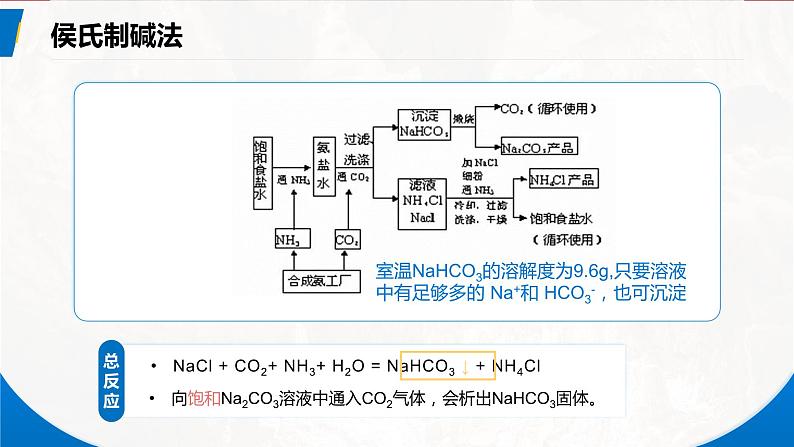
室温NaHCO3的溶解度为9.6g,只要溶液中有足够多的 Na+和 HCO3-,也可沉淀
向饱和Na2CO3溶液中通入CO2气体,会析出NaHCO3固体。
能否生成0.5mml沉淀?
5mL 0.1ml/L NaCl 溶液
将AgCl固体溶于少量水后,得到白色沉淀,请问最终上层液体是什么?是纯水?
对于难容物质,在化学反应中很容易达到溶解极限(饱和溶液),所以本节我们重点介绍难溶物的沉淀溶解平衡。
误区②:误认为“沉淀”就是百分之百的“不容”。
实验2: 已知PbI2为亮黄色微溶物 (溶解度6.9Ⅹ10 – 2 g)。今在装有少量PbI2固体的试管中,加入约3mL蒸馏水,充分震荡后静置,待上层液体变澄清后,向其中滴加几滴0.1ml/L的KI溶液 ,观察现象:
①溶解:在水分子作用下, Pb2+和I-脱离固体表面溶入水中
②沉淀:Pb2+和I- 结合回到固体表面,析出沉淀
最终溶解速率和沉淀速率相等,达到平衡状态,即我们将要学习的沉淀溶解平衡
饱和溶液中 v(结晶)=v(溶解)
结论:NaCl的饱和溶液中存在溶解平衡
加浓盐酸Cl- 的浓度增加,平衡向左移, NaCl析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
200C时,溶解性与溶解度的大小关系
1、溶解是绝对的,不溶是相对的。
2、没有绝对不溶的电解质,难溶电解质都会发生微量溶解
3、生成沉淀的离子反应能发生的原因:生成物的溶解度很小。
化学上通常认为残留在溶液中的离子浓度小于1×10-5 ml/L,沉淀就达完全。
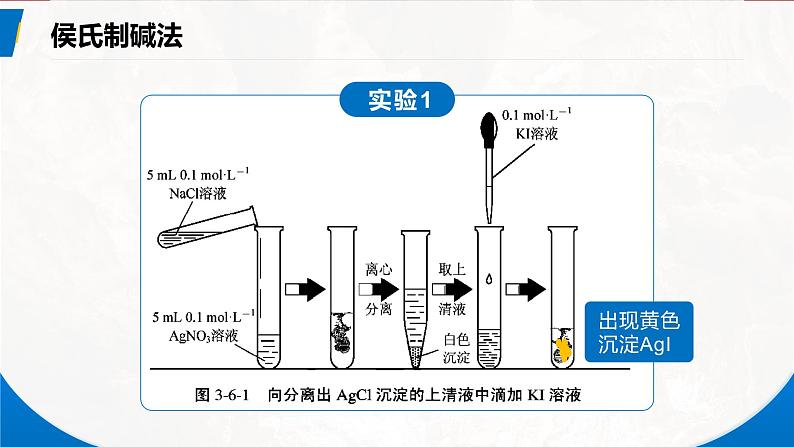
【探究实验】向盛有2 mL 0.1ml/LAgNO3溶液的试管中加入 2 mL 0.1 ml/L NaCl溶液。
现象:有白色沉淀生成,说明溶液中依然有Ag+ Cl-存在,即Ag+和Cl-的反应不能进行到底。
(1)是否恰好反应?(2)溶液中是否还含有Ag+和Cl-?
【继续试验】取上层清液,滴加NaCl溶液,有何现象?说明了什么?
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中存在溶解平衡。
V(溶解)>V(结晶)
V(溶解)=V(结晶)
V(溶解)
二、难溶电解质的溶解平衡
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
标明物质状态和可逆符号
离子浓度小于1×10-5ml/L时,认为反应完全。
AgCl(s) ⇌Ag+(aq) + Cl-(aq)
①内因:电解质本身的性质。
只要是饱和溶液都存在溶解平衡
绝对不溶的物质是没有的
不同难溶物其溶解度差别也很大
难溶的电解质更易建立溶解平衡
(气体,Ca(OH)2除外)
升温,多数平衡向溶解方向移动。
加水,平衡向溶解方向移动;
加与难溶电解质相同离子,平衡向沉淀方向移动
反应消耗难溶电解质的离子,平衡向溶解方向移动。
讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别改变下列条件,将如何变化? AgCl(S)⇌Ag+(aq) + Cl-(aq)
思考:写出难溶物Ag2CrO4、 Fe(OH)3的溶度积表达式
Ksp=cm(An+)·cn(Bm-)
在一定温度下,沉淀达溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。
AmBn(s)⇌mAn+(aq)+nBm-(aq)
Ksp的大小只与难溶电解质本身的性质和温度有关。T↑,Ksp↑ [ Ca(OH)2 相反]
相同类型(阴、阳离子个数比相同)的难溶电解质,溶度积小的电解质,其溶解能力小;不同类型的难溶电解质,应通过计算才能进行比较。
Ksp反映了难溶电解质在水中的溶解能力
讨论:溶度积和溶解度都可以表示难溶电解质在水中的溶解能力,分析下表,你将如何看待溶度积和溶解度的关系?
结论:相同类型(阴、阳离子个数比相同)的难溶电解质的Ksp越小溶解度越小
注意:只有在同种类型的电解质之间才能通过Ksp的大小来直接比较溶解度的大小。
Qc>Ksp时,溶液过饱和,有沉淀析出,直至达到平衡
Qc=Ksp时,沉淀与饱和溶液的平衡
Qc
Qc称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度
Qc= cn(Am+) · cm(Bn-)
① 25℃时,Ksp (AgBr)= 5.0×10-10,求AgBr的饱和溶液中的c(Ag+)和c(Br-)。
② 25℃时,Ksp [Mg(OH)2]= 1.8×10-11,求Mg(OH)2的饱和溶液中的C(Mg2+)和c(OH-)
C(Mg2+)=1.65×10-4,c(OH-)=3.3×10-4
c(Ag+)=c(Br- )=2.2×10-5
室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为143.3g/ml。
解:①把AgCl溶解度单位(g/L)换算成ml·L-1
s=1.93×10-3g/L÷143.3g/ml =1.35×10-5ml·L-1
25℃时,在1.00 L 0.03 ml/L AgNO3溶液中加入0.50 L 0.06 ml/L的CaCl2溶液,能否生成AgCl沉淀?已知:AgCl的Ksp=1.8×10-10
c(Ag+)=(0.03 ml/L×1.00 L)÷(1.00 L+0.50 L) =0.020 ml/L
c(Cl-)=(0.06 ml/L×2×0.50 L)÷(1.00 L+0.50 L) =0.040 ml/L
Qc=c(Ag+)·c(Cl-)=0.020 ml/L×0.040 ml/L=8.0×10-4
实验测得某水样中的铁离子的浓度为6×10-6ml·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?[已知Fe(OH)3的Ksp为2.6×10-39]
解:设溶液中的OH-离子的浓度最少为X才能使水中的铁离子转化为沉淀。
Ksp=c(Fe3+) ·c3(OH-)=2.6×10-39 =6×10-6×X3
求得X=7.57×10-12ml·L-1=c(OH-)
c(H+)=1.32×10-3ml·L-1 pH=2.88答:pH至少要控制在2.88以上。
1.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是( )A.AgCl沉淀的生成和溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl的溶解度不变D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
A [AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;升高温度,AgCl溶解度增大,C错;向平衡体系中加入NaCl固体,增大了c(Cl-),溶解平衡左移,AgCl溶解度减小,D错
2.在0.10 ml·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________ ml·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1 ml·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________ ml·L-1。
[解析] pH=8时,c(OH-)=10-6 ml·L-1,由硫酸铜的溶度积常数可知:Ksp=2.2×10-20=10-12×c(Cu2+),得c(Cu2+)=2.2×10-8 ml·L-1;使Cu2+沉淀完全,已知c(Cu2+)=0.1 ml·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.2 ml·L-1。
[答案] 2.2×10-8 0.2
化学选择性必修1第四节 沉淀溶解平衡试讲课课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4002429_t3/?tag_id=26" target="_blank">第四节 沉淀溶解平衡试讲课课件ppt</a>,文件包含第四节难溶电解质ppt、实验3-3沉淀的转化Imp4、实验3-4沉淀的转化IImp4、实验3-5氢氧化镁沉淀溶解平衡移动mp4等4份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡获奖ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡获奖ppt课件,共60页。PPT课件主要包含了内容索引,沉淀溶解平衡原理,溶度积常数,课时对点练,黄色沉淀,溶解平衡,饱和溶液,保持不变,生成沉淀,正误判断等内容,欢迎下载使用。
高中人教版 (2019)第四节 沉淀溶解平衡图文课件ppt: 这是一份高中人教版 (2019)第四节 沉淀溶解平衡图文课件ppt,共40页。PPT课件主要包含了沉淀溶解平衡,动等定变,表达式,练一练,思考与交流,②外因,a浓度,b温度,平衡右移,平衡左移等内容,欢迎下载使用。













