






- 3.3《盐类的水解》(第2课时)课件 课件 3 次下载
- 3.4《沉淀溶解平衡》(第1课时)课件 课件 4 次下载
- 4.1《原电池》(第1课时)课件 课件 3 次下载
- 4.1《原电池》(第2课时)课件 课件 2 次下载
- 4.2《电解池》(第1课时)课件 课件 2 次下载
选择性必修1第四节 沉淀溶解平衡优秀ppt课件
展开变化观念与平衡思想:能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
科学探究与创新意识:学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。
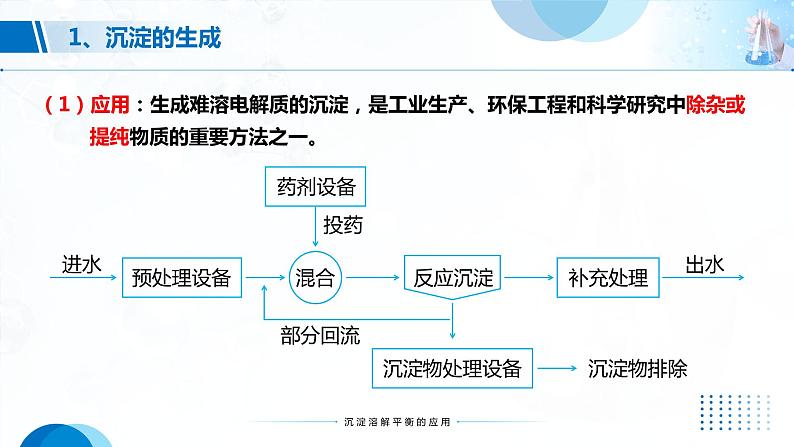
(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或 提纯物质的重要方法之一。
重金属离子(如Cu2+、Hg2+等)转化成沉淀
原则: 生成沉淀的反应能发生,且进行得越完全越好。
Cu2++S2-=CuS↓
沉淀Cu2+、Hg2+等,可以用Na2S或H2S做沉淀剂。
Hg2++S2-=HgS↓
一般认为沉淀离子浓度小于1.0×10-5 ml/L时,则认为已经沉淀完全。
① 要能除去溶液中指定的离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去,如沉淀NaNO3溶液中的Ag+,可用 作沉淀剂。
②溶液中沉淀物的溶解度越小,离子沉淀越完全,例如,除去SO42-,选择Ba2+比Ca2+好。
③要注意沉淀剂的电离程度,如欲使Mg2+沉淀为Mg(OH)2,用NaOH作沉淀剂比用氨水的效果要好。
根据上表的数据,CuCl2中混有少量Fe3+如何除去?
(2) 调节pH形成氢氧化物沉淀
加入氢氧化铜或碱式碳酸铜或氧化铜,调节pH至3~4,促进 Fe3+水解,转化为氢氧化铁沉淀。
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
已知Fe3+在pH3到4之间开始沉淀,在pH7到8之间沉淀完全,而Fe2+,Cu2+在8到9之间开始沉淀11到12之间沉淀完全,CuCl2中混有少量Fe2+如何除去?
先把Fe2+氧化成Fe3+,然后调pH至7到8使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀生成的先后顺序按离子积大于溶度积的先后顺序沉淀,叫作分步沉淀。
Ksp越小越先沉淀,且Ksp相差越大分步沉淀越完全;如AgCl、AgBr、AgI、Ag2S
可溶性钡盐(如BaCl2等)当做食盐食用,会造成钡中毒。中毒患者常用5.0%的Na2SO4溶液洗胃的原因是什么?
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。使Qc < Ksp
例:CaCO3(s) CO32-(aq) + Ca2+(aq)
①酸溶解法:用强酸溶解的难溶电解质有CaCO3、FeS、Al(OH)3、Ca(OH)2等。如CaCO3难溶于水,却易溶于盐酸。
CaCO3+2H+=Ca2++H2O+CO2↑
3Ag2S+8H+ + 2NO3-=6Ag++3S+2NO↑+4H2O
AgCl + 2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
如Ag2S溶于稀HNO3
如Mg(OH)2溶于NH4Cl溶液
Mg(OH)2难溶于水,能溶于盐酸、NH4Cl溶液中。Mg(OH)2溶于NH4Cl溶液反应的离子方程式为:
Mg(OH)2+2NH=== Mg2++2NH3·H2O
分别向氢氧化镁沉淀中加入蒸馏水、盐酸,根据实验现象,得出结论。
在溶液中存在Mg(OH)2的溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解。
应用平衡移动原理分析、解释实验中发生的反应,并试从中找出使沉淀溶解的规律。
A. NH4NO3 B. NaOH C. MgSO4 D. Na2SO4
当氢氧化镁固体在水中达到沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,需加入少量的( )
(1)沉淀转化的过程探究
根据下列图示实验,将观察到的现象填在空格内:
KI = I- + K+
s(AgCl)=1.5×10-4g
s(AgI)=3.7×10-7g
s(Ag2S)=1.3×10-16g
Na2S = I2- + 2Na+
从实验中可以得到什么结论?
沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
向MgCl2溶液中滴加NaOH溶液
向有白色沉淀的溶液中滴加FeCl3溶液
红褐色沉淀析出,溶液变无色
(2)沉淀转化的实质与条件
沉淀的转化是指由一种难溶物转化为另一种难溶物的过程,其实质是沉淀溶解平衡的移动。
两种沉淀的溶解度不同,溶解度小的沉淀可以转化为溶解度_______的沉淀,两者溶解度相差_______转化越_______。
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。
水垢成分CaCO3 Mg(OH)2 CaSO4
用饱和Na2CO3溶液浸泡数天
疏松的水垢CaCO3 Mg(OH)2
CaSO4+CO32- ⇌ CaCO3+SO42- CaCO3+2H+ = Ca2++CO2↑+H2OMg(OH)2+2H+ = Mg2++2H2O
CuSO4+ZnS=== CuS+ZnSO4
CuSO4+PbS=== CuS+PbSO4
工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。用FeS除去Hg2+的离子方程式:
FeS(s)+Hg2+(aq)=== HgS(s)+ Fe2+
已知:Ksp(ZnS)>Ksp(CuS),在有白色固体ZnS存在的饱和溶液中滴加适量CuSO4溶液,产生的实验现象是 ( )A.固体逐渐溶解,最后消失B.固体由白色变为黑色C.固体颜色变化但质量不变D.固体逐渐增多,但颜色不变
1. 某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是 ( )A.NaOH B.ZnO C.ZnSO4 D.Fe2O3
在AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq)。已知常温下, Ksp(AgCl)=1.6×10-10。下列叙述中正确的是( )A. 常温下,AgCl悬浊液中c(Cl-)=4×10-5.5 ml·L-1B. 温度不变,向AgCl悬浊液中加入少量NaCl粉末,平衡向左移动,Ksp(AgCl) 减小C. 向AgCl悬浊液中加入少量NaBr溶液,白色沉淀转化为淡黄色沉淀,说明 Ksp(AgCl)<Ksp(AgBr)D. 常温下,将0.001 ml·L-1 AgNO3溶液与0.001 ml·L-1的KCl溶液等体积混 合,无沉淀析出
解析 AgCl的溶度积Ksp(AgCl)=c(Ag+) · c(Cl-)=1.6×10-10,则AgCl悬浊液中c(Cl-)=c(Ag+)=4×10-5.5 ml·L-1,A正确;
Ksp(AgCl)只与温度有关,温度不变,向AgCl悬浊液中加入少量NaCl粉末,平衡向左移动,但Ksp(AgCl)不变,B错误;
向AgCl悬浊液中加入少量NaBr溶液,白色沉淀转化为淡黄色沉淀,说明AgBr的溶解度小于AgCl,则有Ksp(AgCl)>Ksp(AgBr),C错误;
0.001 ml·L-1 AgNO3溶液与0.001 ml·L-1的KCl溶液等体积混合,此时离子积Q=c(Ag+)·c(Cl-)=0.000 52=2.5×10-7>Ksp(AgCl),故生成AgCl沉淀,D错误。
3. 已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。 下列说法正确的是( )
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大B. 25 ℃时,Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 ml·L-1氨水中的Ksp比在20mL 0.01 ml·L-1 NH4Cl溶液中的Ksp小D. 25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
CLASS SUMMARY
化学选择性必修1第四节 沉淀溶解平衡试讲课课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4002429_t3/?tag_id=26" target="_blank">第四节 沉淀溶解平衡试讲课课件ppt</a>,文件包含第四节难溶电解质ppt、实验3-3沉淀的转化Imp4、实验3-4沉淀的转化IImp4、实验3-5氢氧化镁沉淀溶解平衡移动mp4等4份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt,共60页。PPT课件主要包含了内容索引,沉淀转化原理,沉淀转化的应用,课时对点练,AgCl>,AgI>Ag2S,解的AgI,的方向移动,沉淀溶解平衡的移动,溶解能力相对较强等内容,欢迎下载使用。
高中人教版 (2019)第四节 沉淀溶解平衡图文课件ppt: 这是一份高中人教版 (2019)第四节 沉淀溶解平衡图文课件ppt,共40页。PPT课件主要包含了沉淀溶解平衡,动等定变,表达式,练一练,思考与交流,②外因,a浓度,b温度,平衡右移,平衡左移等内容,欢迎下载使用。













