

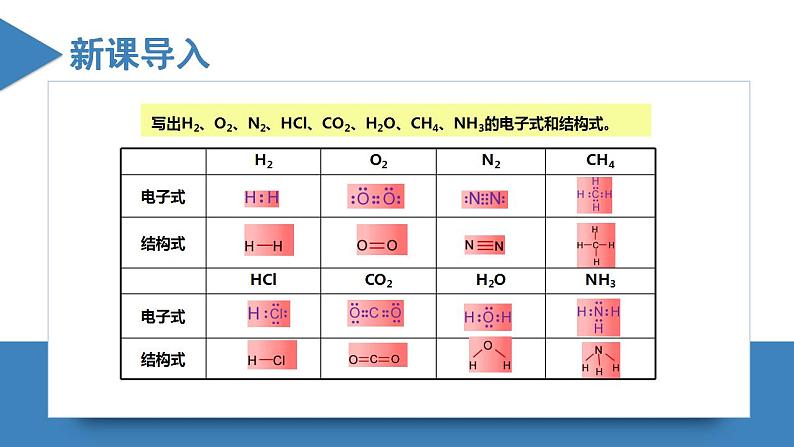





- 高二化学人教版2019选择性必修二 2.2.2分子的空间结构(第2课时+价层电子对互斥模型)课件+练习含解析.zip 课件 19 次下载
- 高二化学人教版2019选择性必修二 2.2.3分子的空间结构(第3课时+杂化轨道理论简介)课件+练习含解析 课件 19 次下载
- 高二化学人教版2019选择性必修二2.3.2分子结构与物质的性质(第2课时 键的极性对化学性质的影响)) 课件+练习含解析 课件 15 次下载
- 高二化学人教版2019选择性必修二2.3.3分子结构与物质的性质(第3课时 范德华力及其对物质性质的影响) 课件(含视频)+练习含解析.zip.zip.zip 课件 14 次下载
- 高二化学人教版2019选择性必修二2.3.4分子结构与物质的性质(第4课时 氢键及其对物质性质的影响) 课件+练习含解析 课件 14 次下载
化学选择性必修2第三节 分子结构与物质的性质优质课件ppt
展开第三节 分子结构与物质的性质
课时1
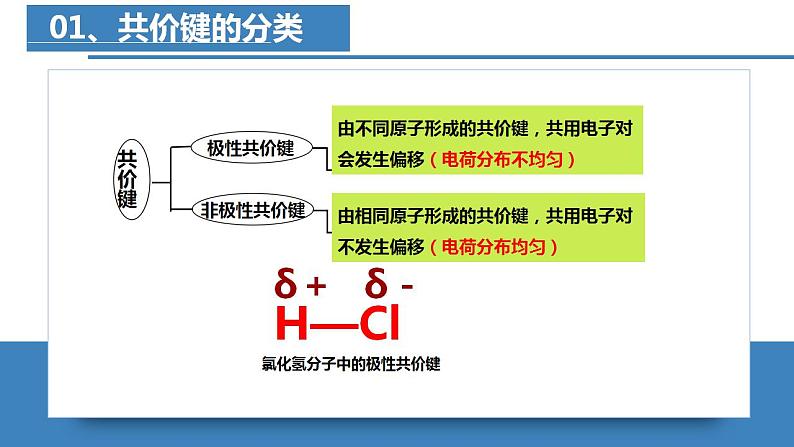
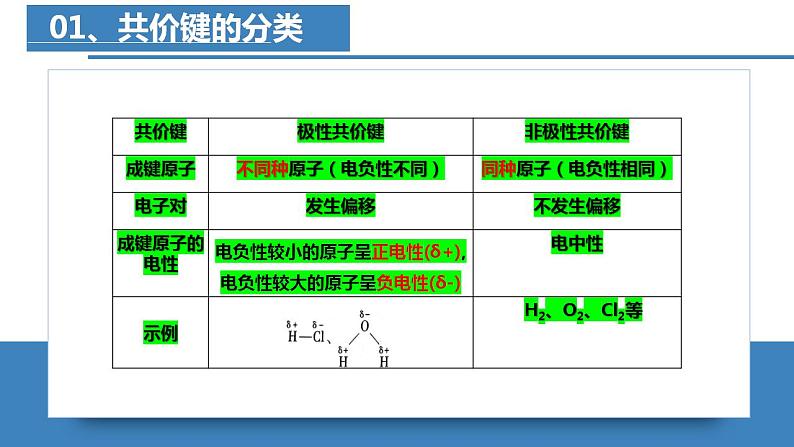
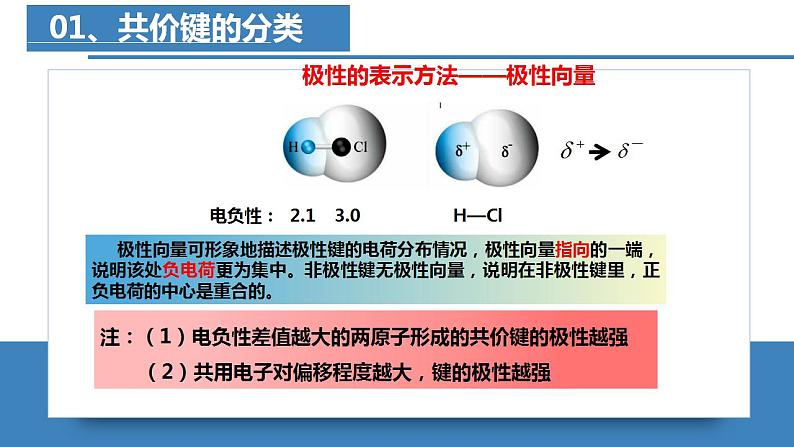
共价键的极性
一、单选题
Ⅰ.夯实基础篇
1.(2022·上海松江·统考一模)我国“十四五”规划中提出“碳中和”,“碳”即,有关的说法错误的是
A.是碳酸的酸酐 B.只含极性共价键
C.是非极性分子 D.是电解质
2.(2022秋·四川达州·高二达州市第一中学校校考阶段练习)下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是
A.CO2和SO2 B.CH4和NO2 C.BF3和NH3 D.HCl和HI
3.(2022春·北京石景山·高二统考期末)下列各组物质中,都是由极性键构成的非极性分子的是
A.CH4和H2O B.CO2和PCl3
C.NH3和H2S D.CS2和BF3
4.(2021·河南商丘·高二校考期末)下列分子中,含有极性键和非极性键的是( )
A.H2S B.N2 C.CS2 D.H2O2
5.(2020春·宁夏中卫·高二海原县第一中学校考阶段练习)以下化合物分子中,都属于极性分子的是( )
A.CO2和AlCl3 B.H2O和NH3 C.CCl4和CS2 D.HCN和SiF4
6.(2022春·宁夏吴忠·高一青铜峡市高级中学校联考期中)下列物质中,同时具有离子键和极性共价键的是( )
A.NH3
B.NH4Cl
C.H2S
D.KCl
7.(2017春·河南焦作·高二阶段练习)下列各组物质中,都是由极性键构成的非极性分子的一组的
A.CH4 和 H2O B.CO2 和HCN C.NH3 和 H2S D.CS2和BF3
8.(2022秋·湖南长沙·高三长沙一中校考阶段练习)化学与生活、科技、社会发展息息相关,下列说法正确的是
A.陶瓷是以石灰石、纯碱、石英砂为原料,经高温烧结而成
B.加工馒头、面包和饼干时,可以加入适量膨松剂——碳酸氢钠、碳酸氢铵
C.冠醚可识别碱金属离子,冠醚与碱金属离子之间形成的配位键属于离子键
D.臭氧是非极性分子,是一种可以替代氯气的净水剂
Ⅱ.能力提升篇
9.(2022秋·浙江·高二统考期末)下列物质的分子中既有σ键又有π键,并含有非极性键的是
①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A.②⑤⑥ B.①②⑤⑥ C.②③④ D.②④⑥
10.(2021春·福建龙岩·高二校联考期中)下列各组物质中,属于由极性键构成的极性分子的是
A.NH3和H2S B.CH4和Br2 C.BF3和CO2 D.BeCl2和HCl
11.(2022·江苏·一模)实验室制备乙炔的反应为CaC2+2H2O=Ca(OH)2+C2H2↑。下列说法正确的是
A.CaC2的电子式为 B.H2O是非极性分子
C.Ca(OH)2中仅含有离子键 D.C2H2的空间结枃为直线形
12.(2022春·上海青浦·高三上海市朱家角中学校考期中)联胺(N2H4)是火箭燃料,其分子结构如图所示。下列有关联胺的说法错误的是
A.分子中既有极性键,也有非极性键
B.该分子是非极性分子
C.联胺晶体内只存在共价键一种化学键
D.具有还原性
13.(2023·山东济南·统考一模)三聚氰胺()是一种有机合成剂和分析剂,结构中含大π键。下列说法错误的是
A.晶体类型为分了晶体 B.1 mol该分子中存在15 mol σ键
C.分子中所有化学键均为极性键 D.六元环上的N原子提供孤对电子形成大π键
14.(2022春·山东济南·高三统考专题练习)关于CH≡CH和的结构与性质,下列说法错误的是
A.CH≡CH是非极性分子 B.存在单双键交替的结构
C.两者的最简式都是CH D.CH≡CH的空间构型是直线形
15.(2022秋·江苏宿迁·高三校考开学考试)工业上利用MgCl2•6H2O+6SOCl2MgCl2+6SO2↑+12HCl↑制备无水MgCl2。下列说法正确的是
A.SO2为非极性分子 B.MgCl2中既含离子键又含共价键
C.H2O的电子式为 D.基态O原子的电子排布式为1s22s22p4
16.(2022春·黑龙江哈尔滨·高二哈师大附中校考期中)下列组合中,属于含有极性键的非极性分子的是
A.、、 B.、、
C.、、 D.、、HCHO
二、填空题
Ⅰ.夯实基础篇
17.(2022春·浙江金华·高二浙江省浦江中学校联考阶段练习)回答下列问题
(1)OF2与H2O结构相似,OF2分子的极性___________H2O(填“>”、“=”或“<”)的极性。
(2)简要解释下表中三种晶体的熔点差异的原因___________。
物质 | SiO2 | SiCl4 | SiF4 |
熔点/°C | 1610 | -69 | -90 |
(3)已知苯环上的一OH能电离出H+,(苯酚)+H+,苯酚的酸性大于(邻羟基苯甲醛),试解释其原因___________。
18.(2022春·新疆喀什·高二莎车县第一中学校考期中)填空
分子式 | 中心原子的孤电子对数 | 分子的立体构型 | 中心原子的杂化类型 | 分子的极性 |
BF3 | _______ | _______ | _______ | _______ |
H2O | _______ | _______ | _______ | _______ |
19.(2022·全国·高二专题练习)分子的极性
分子有___________分子和___________分子。分子的极性与分子的空间结构及分子中键的极性有关。
Ⅱ.能力提升篇
20.(2021·高二课时练习)在HF、H2O、NH3、CS2、CH4、H2O2、N2分子中:
(1)以非极性键结合的非极性分子是___________(填化学式,下同)。
(2)以极性键结合,具有直线形结构的非极性分子是___________。
(3)以极性键结合,具有正四面体结构的非极性分子是___________。
(4)以极性键结合,具有三角锥形结构的极性分子是___________。
(5)以极性键结合,具有V形结构的极性分子是___________。
(6)以极性键结合,且分子极性最大的是___________。
(7)含有非极性键的极性分子是___________。
21.(2021·高三课时练习)数十亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是目前空气和原始大气的主要成分:
目前空气的主要成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
原始大气的主要成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白(填化学式):
(1)含有10个电子的分子有________________。
(2)由极性键构成的非极性分子有____________;
(3)分子中不含孤对电子的分子(稀有气体除外)有_________,它的立体构型为__________;
(4)极易溶于水且水溶液呈碱性的物质的分子是___________,它之所以极易溶于水是因为它的分子和水分子之间形成______________;
分子结构与物质的性质
课时1
共价键的极性
三、单选题
Ⅰ.夯实基础篇
1.(2022·上海松江·统考一模)我国“十四五”规划中提出“碳中和”,“碳”即,有关的说法错误的是
A.是碳酸的酸酐 B.只含极性共价键
C.是非极性分子 D.是电解质
【答案】D
【详解】A.酸酐是指某含氧酸脱去一分子水或几分子水所剩下的部分,CO2是碳酸的酸酐,A正确;
B.不同元素的原子形成的共价键一般是极性共价键,CO2结构式为O=C=O,只含极性共价键,B正确;
C.CO2的结构式为O=C=O,正电中心与负电中心重合,是非极性分子,C正确;O=C=O
D.CO2属于非电解质,D错误;
故答案为:D。
2.(2022秋·四川达州·高二达州市第一中学校校考阶段练习)下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是
A.CO2和SO2 B.CH4和NO2 C.BF3和NH3 D.HCl和HI
【答案】D
【详解】A.CO2是含极性共价键的非极性分子,SO2是含极性共价键的极性分子,分子的极性不相同,A项不符合题意;
B.CH4是含极性共价键的非极性分子,NO2是含极性共价键的极性分子,分子的极性不相同,B项不符合题意;
C.BF3是含极性共价键的非极性分子,NH3是含极性共价键的极性分子,分子的极性不相同,C项不符合题意;
D.HCl和HI都是含极性共价键的极性分子,D项符合题意;
答案选D。
3.(2022春·北京石景山·高二统考期末)下列各组物质中,都是由极性键构成的非极性分子的是
A.CH4和H2O B.CO2和PCl3
C.NH3和H2S D.CS2和BF3
【答案】D
【详解】A.H2O是V形结构,是极性分子,A错误;
B.PCl3是三角锥形分子,正负电荷中心不重合,属于极性分子,B错误;
C.NH3是三角锥形结构,H2S是V形结构,二者均是极性分子,C错误;
D.CS2是直线形结构,BF3是平面三角形结构,二者均是由极性键构成的非极性分子,D正确;
答案选D。
4.(2021·河南商丘·高二校考期末)下列分子中,含有极性键和非极性键的是( )
A.H2S B.N2 C.CS2 D.H2O2
【答案】D
【详解】A.H2S分子中只含有氢硫极性共价键,选项A错误; B.N2分子中只含有氮氮非极性共价键,选项B错误;C.CS2分子中只含有碳硫极性共价键,选项C错误;D.H2O2分子中含有氧氢极性共价键和氧氧非极性共价键,选项D正确。答案选D。
点睛:本题考查化学键的极性,明确化学键判断的方法是解答本题的关键,应熟悉常见分子的构型,根据同种非金属元素的原子间易形成非极性共价键;不同种非金属元素的原子间易形成极性共价键。
5.(2020春·宁夏中卫·高二海原县第一中学校考阶段练习)以下化合物分子中,都属于极性分子的是( )
A.CO2和AlCl3 B.H2O和NH3 C.CCl4和CS2 D.HCN和SiF4
【答案】B
【详解】A.CO2分子为直线形,正负电荷中心重合,为非极性分子,AlCl3是以Al2Cl6的形式存在,分子中Al的价层电子对数为3,不含孤电子对,正负电荷中心重合,为非极性分子,故A不符合题意;
B.H2O分子为V形,正负电荷中心不重合,为极性分子;NH3分子为三角锥性,N原子位于顶点,正负电荷中心不重合,为极性分子,故B符合题意;
C.CCl4分子为正四面体形,正负电荷中心重合,为非极性分子,CS2分子为直线形,正负电荷中心重合,为非极性分子,故C不符合题意;
D.HCN分子为直线形,但碳原子一侧为氢原子,一侧为氮原子,正负电荷中心不重合,为极性分子,SiF4分子为正四面体形,正负电荷中心重合,为非极性分子,故D不符合题意;
故答案为B。
6.(2022春·宁夏吴忠·高一青铜峡市高级中学校联考期中)下列物质中,同时具有离子键和极性共价键的是( )
A.NH3
B.NH4Cl
C.H2S
D.KCl
【答案】B
【详解】A.氨气中只含N-H共价键,故A错误;
B.存在铵根离子与氯离子形成的离子键,N-H共价键,故B正确;
C.只存在H-S共价键,故C错误;
D.KCl中只存在K+和Cl-之间的离子键,故D错误;
故答案为B。
【点睛】考查化学键,为高频考点,把握化学键判断的一般规律为解答的关键,一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,铵盐中全部为非金属元素,但铵盐为离子化合物,且铵盐中含离子键和共价键。
7.(2017春·河南焦作·高二阶段练习)下列各组物质中,都是由极性键构成的非极性分子的一组的
A.CH4 和 H2O B.CO2 和HCN C.NH3 和 H2S D.CS2和BF3
【答案】D
【详解】A. H2O是V形结构,是极性分子,A错误;B. HCN是直线形结构,但正负电荷中心不重合,属于极性分子,B错误;C. NH3是三角锥形结构,H2S是V形结构,二者均是极性分子,C错误;D. CS2是直线形结构,BF3是平面三角形结构,二者均是非极性分子,D正确,答案选D。
8.(2022秋·湖南长沙·高三长沙一中校考阶段练习)化学与生活、科技、社会发展息息相关,下列说法正确的是
A.陶瓷是以石灰石、纯碱、石英砂为原料,经高温烧结而成
B.加工馒头、面包和饼干时,可以加入适量膨松剂——碳酸氢钠、碳酸氢铵
C.冠醚可识别碱金属离子,冠醚与碱金属离子之间形成的配位键属于离子键
D.臭氧是非极性分子,是一种可以替代氯气的净水剂
【答案】B
【详解】A.陶瓷是以黏土为原料经高温烧结而成的,普通玻璃是以纯碱、石英砂、石灰石为原料制得,故A错误;
B.碳酸氢钠和碳酸氢铵受热分解会释放出大量气体,故可作为膨松剂,故B正确;
C.冠醚与碱金属之间形成配位键,故冠醚可识别碱金属离子,配位键属于共价键,故C错误;
D.臭氧为极性分子,故D错误;
故答案选B。
【点睛】本题主要考查无机非金属材料、极性分子与非极性分子的判断,为基础知识的考查,题目难度不大。
Ⅱ.能力提升篇
9.(2022秋·浙江·高二统考期末)下列物质的分子中既有σ键又有π键,并含有非极性键的是
①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A.②⑤⑥ B.①②⑤⑥ C.②③④ D.②④⑥
【答案】A
【详解】①NH3分子中只有N-H键;②N2分子中有氮氮三键,为非极性键,既有σ键又有π键;③H2O分子中只有O-H键;④HCl分子中有H-Cl键;⑤C2H4分子中有碳碳双键;为非极性键,既有σ键又有π键;⑥C2H4分子中有碳碳三键,为非极性键,既有σ键又有π键;所以②⑤⑥分子中既有σ键又有π键;并含有非极性键,
故答案选A。
10.(2021春·福建龙岩·高二校联考期中)下列各组物质中,属于由极性键构成的极性分子的是
A.NH3和H2S B.CH4和Br2 C.BF3和CO2 D.BeCl2和HCl
【答案】A
【分析】一般来讲,极性键是指不同的非金属元素原子之间形成的共价键,可以用通式A−B键表示,反之为非极性键,即A−A键;极性分子是指整个分子的正、负电荷的中心不重合,反之为非极性分子,以此进行判断。
【详解】A.NH3含有极性键,空间构型为三角锥形,分子中正、负电荷的中心不重合,属于极性键形成的极性分子;H2S为V形,分子中正、负电荷的中心不重合,且含有极性键,属于极性键形成的极性分子,满足条件,故A正确;
B.CH4含极性键,空间构型为正四面体形,分子中正、负电荷的中心重合,属于极性键形成的非极性分子;Br2含有非极性键,为非极性键形成的极性分子,不满足条件,故B错误;
C.BF3分子中含有极性键,空间构型为平面三角形,结构对称,正负电荷的中心重合,属于非极性分子;CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故C错误;
D.BeCl2中正、负电荷的中心是重合的,为非极性分子;HCl为极性键形成的极性分子,故D错误;
故答案选A。
11.(2022·江苏·一模)实验室制备乙炔的反应为CaC2+2H2O=Ca(OH)2+C2H2↑。下列说法正确的是
A.CaC2的电子式为 B.H2O是非极性分子
C.Ca(OH)2中仅含有离子键 D.C2H2的空间结枃为直线形
【答案】D
【详解】A.CaC2中碳原子达到8电子结构,电子式为,A错误;
B.H2O为V形结构,是极性分子,B错误;
C.Ca(OH)2的氢氧根离子中含有O-H共价键,C错误;
D.C2H2中碳原子为sp杂化,空间结枃为直线形,D正确;
故选D。
12.(2022春·上海青浦·高三上海市朱家角中学校考期中)联胺(N2H4)是火箭燃料,其分子结构如图所示。下列有关联胺的说法错误的是
A.分子中既有极性键,也有非极性键
B.该分子是非极性分子
C.联胺晶体内只存在共价键一种化学键
D.具有还原性
【答案】B
【详解】A.从图中可以看出,联氨分子中既有N-H极性键,也有N-N非极性键,A正确;
B.从图中可以看出,该分子结构不对称,是极性分子,B错误;
C.联胺为共价化合价,其晶体内只存在共价键一种化学键,C正确;
D.联氨中氮元素显-2价,氮元素化合价能升高体现出还原性,D正确;
故选B。
13.(2023·山东济南·统考一模)三聚氰胺()是一种有机合成剂和分析剂,结构中含大π键。下列说法错误的是
A.晶体类型为分了晶体 B.1 mol该分子中存在15 mol σ键
C.分子中所有化学键均为极性键 D.六元环上的N原子提供孤对电子形成大π键
【答案】D
【详解】A.三聚氰胺中原子间的化学键只有共价键,其晶体的构成粒子为分子,晶体类型为分子晶体,A项正确;
B.1个三聚氰胺分子中含6个N—Hσ键、9个碳氮σ键,1个三聚氰胺分子中15个σ键,1mol该分子中存在15molσ键,B项正确;
C.该分子中存在N—H极性键和碳氮极性键,所有化学键均为极性键,C项正确;
D.N原子的价电子排布式为2s22p3,该分子中—NH2中N原子采取sp3杂化,六元环上的N原子采取sp2杂化,六元环上的每个N原子通过2个杂化轨道与2个碳原子形成碳氮σ键、每个N上剩余的1个杂化轨道容纳1对孤电子对,六元环上的N原子未参与杂化的p轨道上的1个电子形成大π键,孤电子对不形成大π键,D项错误;
答案选D。
14.(2022春·山东济南·高三统考专题练习)关于CH≡CH和的结构与性质,下列说法错误的是
A.CH≡CH是非极性分子 B.存在单双键交替的结构
C.两者的最简式都是CH D.CH≡CH的空间构型是直线形
【答案】B
【详解】A.乙炔分子结构对称,正负电荷重合,为非极性分子,A正确;
B.苯中不存在碳碳双键,B错误;
C.二者最简式都为CH,C正确;
D.乙炔为直线形分子,D正确;
故选B。
15.(2022秋·江苏宿迁·高三校考开学考试)工业上利用MgCl2•6H2O+6SOCl2MgCl2+6SO2↑+12HCl↑制备无水MgCl2。下列说法正确的是
A.SO2为非极性分子 B.MgCl2中既含离子键又含共价键
C.H2O的电子式为 D.基态O原子的电子排布式为1s22s22p4
【答案】D
【详解】A.二氧化硫是极性分子,是sp2杂化,二氧化硫分子并不是直线形的,它是V形分子,硫氧键的极性不能互相抵消,所以是极性分子,A项错误;
B.MgCl2中只有镁离子、氯离子形成的离子键,B项错误;
C.H2O的电子式为 ,C项错误;
D.基态O原子的电子排布式为1s22s22p4,D项正确;
答案选D。
16.(2022春·黑龙江哈尔滨·高二哈师大附中校考期中)下列组合中,属于含有极性键的非极性分子的是
A.、、 B.、、
C.、、 D.、、HCHO
【答案】A
【详解】A.三种物质都含有极性键,结构对称,属于非极性分子,A项符合题意;
B.甲烷含有极性键,为正四面体结构,属于非极性分子,三氯甲烷含有极性键,为四面体结构,结构不对称,属于极性分子,三氟化硼是含有极性键的非极性分子,B项不符合题意;
C.三种物质都是只有非极性键的非极性分子,C项不符合题意;
D.只有氢气是非极性分子,D项不符合题意。
故选A。
四、填空题
Ⅰ.夯实基础篇
17.(2022春·浙江金华·高二浙江省浦江中学校联考阶段练习)回答下列问题
(1)OF2与H2O结构相似,OF2分子的极性___________H2O(填“>”、“=”或“<”)的极性。
(2)简要解释下表中三种晶体的熔点差异的原因___________。
物质 | SiO2 | SiCl4 | SiF4 |
熔点/°C | 1610 | -69 | -90 |
(3)已知苯环上的一OH能电离出H+,(苯酚)+H+,苯酚的酸性大于(邻羟基苯甲醛),试解释其原因___________。
【答案】(1)<
(2)SiO2是共价晶体,熔化时破坏共价键,而SiCl4、SiF4是分子晶体,熔化时破坏分子间作用力,所以SiO2熔点最高;SiCl4、SiF4是分子晶体,组成和结构相似,SiCl4的相对分子质量更大,分子间作用力越大,熔点越高
(3)邻羟基苯甲醛易形成分子内氢键,使得羟基难以电离出H+
【解析】(1)
从电负性上看氧与氢的电负性差值大于氧与氟的电负性差值,OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性,从而导致H2O分子的极性很强,故OF2分子的极性小于H2O;
(2)
SiO2是共价晶体,熔化时破坏共价键,而SiCl4、SiF4是分子晶体,熔化时破坏的是分子间作用力,所以SiO2的熔点是最高的;SiCl4、SiF4组成和结构相似,相对分子质量越大,熔点越高,固SiCl4的熔点大于SiF4。
(3)
醛基是亲水基,在水中易形成氢键,而使酚羟基难以电离,所以苯酚的酸性大于邻羟基苯甲醛。
18.(2022春·新疆喀什·高二莎车县第一中学校考期中)填空
分子式 | 中心原子的孤电子对数 | 分子的立体构型 | 中心原子的杂化类型 | 分子的极性 |
BF3 | _______ | _______ | _______ | _______ |
H2O | _______ | _______ | _______ | _______ |
【答案】 0 平面三角形 sp2杂化 非极性分子 2 V形 sp3杂化 极性分子
【详解】BF3分子的中心原子的价电子对数为,中心原子B原子采用sp2杂化,不含有孤电子对,则分子的立体构型为平面三角形,分子中正负电荷中心重合,属于非极性分子;
H2O分子的中心原子的价电子对数为,中心原子O原子采用sp3杂化,含有2个孤电子对,则分子的立体构型为V形,分子中正负电荷中心不重合,属于极性分子。
19.(2022·全国·高二专题练习)分子的极性
分子有___________分子和___________分子。分子的极性与分子的空间结构及分子中键的极性有关。
【答案】 极性 非极性
【解析】略
Ⅱ.能力提升篇
20.(2021·高二课时练习)在HF、H2O、NH3、CS2、CH4、H2O2、N2分子中:
(1)以非极性键结合的非极性分子是___________(填化学式,下同)。
(2)以极性键结合,具有直线形结构的非极性分子是___________。
(3)以极性键结合,具有正四面体结构的非极性分子是___________。
(4)以极性键结合,具有三角锥形结构的极性分子是___________。
(5)以极性键结合,具有V形结构的极性分子是___________。
(6)以极性键结合,且分子极性最大的是___________。
(7)含有非极性键的极性分子是___________。
【答案】 N2 CS2 CH4 NH3 H2O HF H2O2
【分析】HF中含有H-F极性键,正、负电荷中心不重合,属于极性分子;H2O中含有极性键,其空间结构为Ⅴ形,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正、负电荷中心不重合,属于极性分子;CS2中含有极性键,空间结构为直线形,属于非极性分子;CH4中含有极性键,空间结构为正四面体形,正、负电荷中心重合,属于非极性分子;H2O2中含有极性键和非极性键正、负电荷中心不重合,为极性分子;N2中只含有非极性键,属于非极性分子。
【详解】(1)以非极性键结合的非极性分子是N2,故答案为N2;
(2)以极性键相结合,具有直线型结构的非极性分子是CS2,故答案为CS2;
(3)以极性键结合,具有正四面体结构的非极性分子是CH4,故答案为CH4;
(4)以极性键结合,具有三角锥形结构的极性分子是NH3,故答案为NH3;
(5)以极性键结合,具有V形结构的极性分子是H2O,故答案为H2O;
(6)题给几种物质中,以极性键相结合,且分子极性最大的是HF,故答案为HF;
(7)含有非极性键的极性分子是H2O2,故答案为H2O2。
21.(2021·高三课时练习)数十亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是目前空气和原始大气的主要成分:
目前空气的主要成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
原始大气的主要成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白(填化学式):
(1)含有10个电子的分子有________________。
(2)由极性键构成的非极性分子有____________;
(3)分子中不含孤对电子的分子(稀有气体除外)有_________,它的立体构型为__________;
(4)极易溶于水且水溶液呈碱性的物质的分子是___________,它之所以极易溶于水是因为它的分子和水分子之间形成______________;
【答案】 H2O、Ne、CH4、NH3 CH4、CO2 CH4 正四面体形 NH3 氢键
【详解】(1)含有10个电子的分子有H2O、Ne、CH4、NH3。
(2)由极性键构成的非极性分子有CH4、CO2。
(3)分子中不含孤对电子的分子(稀有气体除外)有CH4 ,它的立体构型为正四面体形。
(4)极易溶于水且水溶液呈碱性的物质的分子是NH3 ,由于它的分子和水分子之间形成氢键,所以NH极易溶于水。
点睛:本题以原始大气为资料背景,考查CH4、NH3、CO、CO2四种气体的性质,以及质量守恒定律等知识,难度不大,根据已有的知识分析解答即可。
人教版 (2019)选择性必修2第三节 分子结构与物质的性质完美版习题课件ppt: 这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质完美版习题课件ppt,共33页。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质优秀课件ppt,文件包含235分子结构与物质的性质第5课时溶解度手性习题精练高二化学同步习题精练人教版2019选择性必修2含解析卷docx、235分子结构与物质的性质第5课时溶解度手性课件含视频高二化学同步课件人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)选择性必修2第三节 分子结构与物质的性质试讲课课件ppt: 这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质试讲课课件ppt,文件包含233分子结构与物质的性质第3课时范德华力及其对物质性质的影响习题精练高二化学同步习题精练人教版2019选择性必修2含解析卷docx、233分子结构与物质的性质第3课时范德华力及其对物质性质的影响课件含视频高二化学同步课件人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













