



【新高考】2023年高考化学二轮题型精讲精练——专题17 化学平衡图表分析
展开专题17 化学速率和平衡图表分析
目录
一、热点题型归纳…………………………………………………………………………………………………………1
【题型一】速率-时间图像…………………………………………………………………………………………………1
【题型二】某量-时间图像…………………………………………………………………………………………………3
【题型三】含量-条件图像…………………………………………………………………………………………………5
【题型四】某量-投料比图像………………………………………………………………………………………………8
【题型五】某量-条件图像………………………………………………………………………………………………10
【题型六】某量-条件-条件图像…………………………………………………………………………………………12
【题型七】选择性-条件图像……………………………………………………………………………………………15
【题型八】速率平衡表格分析……………………………………………………………………………………………17
二、最新模考题组练………………………………………………………………………………………………………19
【题型一】速率-时间图像
【典例分析】
【典例1】(双选)(2021·湖南等级考)已知:A(g)+2B(g)3C(g) ΔH<0,向一恒温恒容的密闭容器中充入1 mol A和3 mol B发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )。
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入C
C.平衡时A的体积分数φ:φ(Ⅱ)>φ(Ⅰ)
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
【解析】选BC。恒温恒容条件下进行反应,该反应前后气体分子数不变,所以容器内的气体压强始终保持不变,A项错误;t2时,正反应速率在平衡状态Ⅰ的基础上逐渐增大,则说明为增大产物C的浓度导致的,B项正确;t2时刻增大产物C的浓度,v逆'>v正',平衡逆向移动,平衡时A的体积分数φ(Ⅱ)>φ(Ⅰ),C项正确;平衡常数只与温度有关,温度不变,故平衡常数不变,D项错误。
【提分秘籍】
1.“渐变点”一定是浓度变化引起的
图像
条件变化
增大生成物的浓度
增大反应物的浓度
2.变化趋势相同的“突变点”可能是温度或压强变化引起的
图像
条件变化
升高放热反应的温度
升高吸热反应的温度
增大增体反应的压强
增大减体反应的压强
3.变化趋势不同的“突变点”可能是容器体积和物质的量共同变化引起的
图像
条件变化
恒温恒压下,增大反应物的浓度
恒温恒压下,增大生成物的浓度
4.v正和v逆重合的“突变点”可能是催化剂或压强变化引起的
图像
条件变化
加入催化剂
增大等体反应的压强
【变式演练】
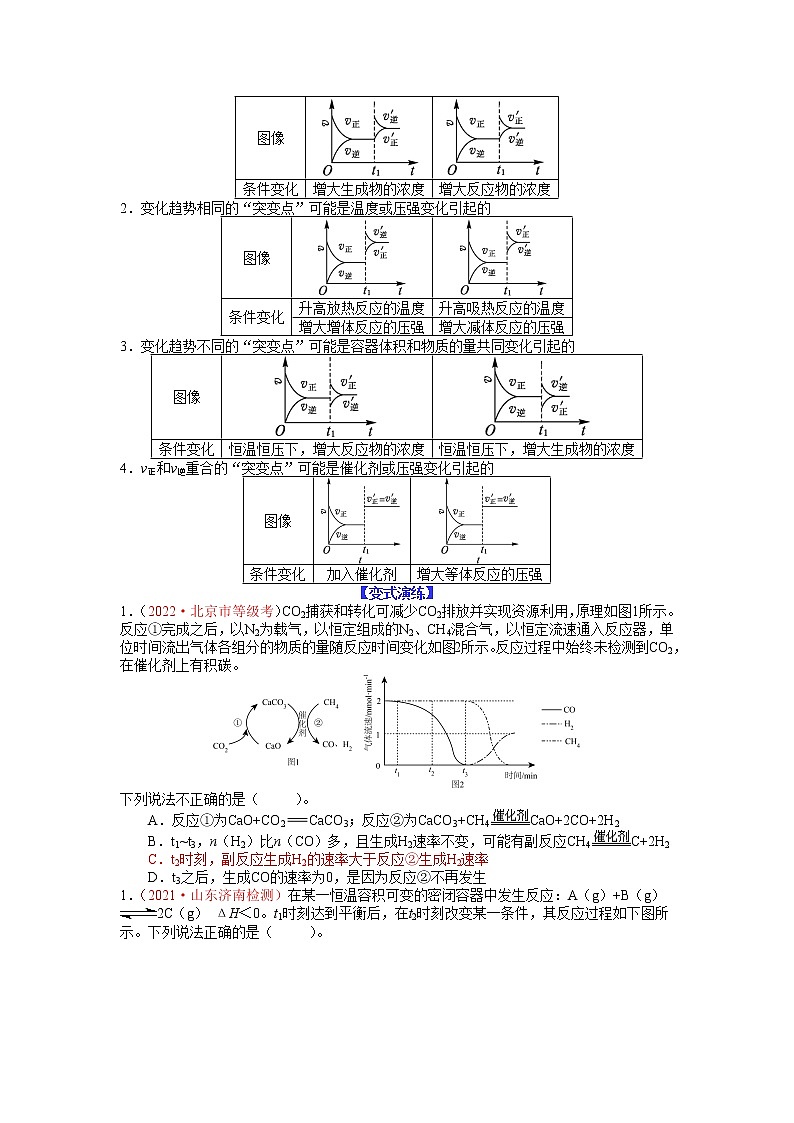
1.(2022·北京市等级考)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
下列说法不正确的是( )。
A.反应①为CaO+CO2CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能有副反应CH4C+2H2
C.t2时刻,副反应生成H2的速率大于反应②生成H2速率
D.t3之后,生成CO的速率为0,是因为反应②不再发生
【解析】选C。由题干图1所示信息可知,反应①为CaO+CO2CaCO3,结合氧化还原反应配平可得反应②为CaCO3+CH4CaO+2CO+2H2,A正确;由题干图2信息可知,t1~t3,n(H2)比n(CO)多,且生成H2速率不变,且反应过程中始终未检测到CO2,在催化剂上有积碳,故可能有副反应CH4C+2H2,反应②和副反应中CH4和H2的系数比均为1:2,B正确;由题干反应②方程式可知,H2和CO的反应速率相等,而t2时刻信息可知,H2的反应速率未变,仍然为2mmol/min,而CO变为1~2mmol/min之间,故能够说明副反应生成H2的速率小于反应②生成H2速率,C错误;由题干图2信息可知,t3之后,CO的速率为0,CH4的速率逐渐增大,最终恢复到1,说明生成CO的速率为0,是因为反应②不再发生,而后副反应逐渐停止反应,D正确。
1.(2021·山东济南检测)在某一恒温容积可变的密闭容器中发生反应:A(g)+B(g)2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )。
A.0~t2时,v正>v逆
B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ
C.t2时刻改变的条件是向密闭容器中加入C
D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数KⅠ<KⅡ
【解析】选C。0~t1,反应正向进行,说明v正>v逆,t1~t2,反应到达平衡,v正=v逆,A项错误。t2时刻改变条件后达到新平衡,逆速率不变,说明改变条件后与原平衡等效,平衡不移动,因此达到平衡时A的体积分数Ⅰ=Ⅱ,B项错误。向密闭容器中加入C,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同,符合图像,C项正确。该反应是在恒温下进行,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以Ⅰ、Ⅱ两过程达到平衡时,平衡常数KⅠ=KⅡ,D项错误。
3.研究小组向恒容密闭容器中加入一定量的固体A和气体B,发生反应:A(s)+2B(g)D(g)+E(g)。已知Δc=c后-c前,下列示意图中,能正确表达该反应的有关物理量随时间变化的是( )。
【解析】选A。根据题目信息可知Δc(B)为负值,Δc(E)为正值,当反应达到平衡后单位时间内浓度不再变化,即为0,且反应过程中B的化学计量数为2,E的化学计量数为1,所以(B)的变化速率为(E)的2倍,故A正确;根据题目信息可知Δc(B)为负值,故B错误;反应物A为固体,浓度为常数,故C错误;反应达到平衡后,浓度商与平衡常数相等,不会再随时间变化,故D错误。
【题型二】某量-时间图像
【典例分析】
【典例2】(2022·湖南省等级考)向体积均为1L的两恒容容器中分别充入2molX和1molY发生反应:2X(g)+Y(g)Z(g)△H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )。
A.△H>0
B.气体的总物质的量:na<nc
C.a点平衡常数:K>12
D.反应速率:va正<vb正
【解析】选B。甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程PV=nRT可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即△H<0,故A错误;根据A项分析可知,上述密闭容器中的反应为放热反应,图中a点和c点的压强相等,因甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量此时相比乙容器在减小即气体总物质的量:na<nc,故B正确;a点为平衡点,此时容器的总压为p,假设在恒温恒容条件下进行,则气体的压强之比等于气体的物质的量(物质的量浓度)之比,所以可设Y转化的物质的量浓度为xmol·L−1,则列出三段式如下:
2X(g)
+
Y(g)
Z(g)
起始mol·L−1
2
1
0
变化mol·L−1
2x
x
x
平衡mol·L−1
2-2x
1-x
x
则有=,计算得到x=0.75,那么化学平衡常数K===12,又甲容器为绝热条件,等效为恒温条件下升温,平衡逆向移动,则平衡常数减小即平衡常数K<12,故C错误;根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即va正>vb正,故D错误。
【提分秘籍】
1.浓度(物质的量)-时间图像
(1)判断计算反应的化学方程式
①反应物的量越来越小
②生成物的量越来越多
③化学计量数之比=物质的量(浓度)变化之比
(2)斜率越大(单位时间内变化量大),反应速率越快,反应条件越高
2.某量-时间-条件图像:以mA(g)+nB(g)pC(g)+qD(g)为例:
(1)图甲中,T2>T1,升高温度,αA减小,说明平衡逆向移动,正反应的ΔH<0。
(2)图乙中,p1>p2,增大压强,αA增大,说明平衡正向移动,正反应是气体总分子数减小的反应。
(3)若纵坐标表示A的百分含量,则甲中正反应的ΔH>0,乙中正反应是气体总分子数增大的反应。
【变式演练】
1.(2022·广东省等级考)在相同条件下研究催化剂I、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )。
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2min内,v(X)=1.0mol·L-1·min-1
【解析】选D。由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故A错误;由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故B错误;由图可知,使用催化剂II时,在0~2min内Y的浓度变化了2.0mol/L,而a曲线表示的X的浓度变化了2.0mol/L,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂II时X浓度随时间t的变化,故C错误;使用催化剂I时,在0~2min内,Y的浓度变化了4.0mol/L,则v(Y)==2.0mol·L-1·min-1,v(X)=v(Y)=×2.0mol·L-1·min-1=1.0mol·L-1·min-1,故D正确。
2.(2021年1月高三八省联考重庆卷)MTP是一类重要的药物中间体,可以由TOME经环化后合成。其反应式为:
为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇。TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为amol/L,反应过程中的液体体积变化忽略不计。下列说法错误的是( )。
A.X、Y两点的MTP的物质的量浓度相等
B.X、Z两点的瞬时速率大小为v(X)>v(Z)
C.若Z点处于化学平衡,则210℃时反应的平衡常数K=mol/L
D.190℃时,0~150min之间的MTP的平均反应速率为mol/(L·min)
【解析】选C。由图知X、Y两点反应物的转化率相等,则MTP的物质的量浓度相等,A正确;由图知,X点曲线斜率大于Z点,则X、Z两点的瞬时速率大小为v(X)>v(Z),因为Z点转化率已达98%,反应物浓度极小,则反应速率下降,B正确;由题知,反应过程中甲醇不断从体系中移走,若Z点处于化学平衡,则210℃时甲醇的浓度不等于0.98amol/L,则反应的平衡常数K=≠mol/L,C错误;190℃时,0~150min之间的MTP的浓度减少了0.67mol/L,则其平均反应速率为mol/(L·min),D正确。
3.(2021·辽宁省选择考)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法不正确的是( )。
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为0.012mol·L-1·min-1
D.条件②,降冰片烯起始浓度为3.0mol·L-1时,半衰期为62.5min
【解析】选B。由题干图中曲线①②可知,其他条件相同时,催化剂浓度越大,反应所需要的时间更短,故反应速率越大,A正确;由题干图中曲线①③可知,其他条件相同时,降冰片烯浓度①是③的两倍,所用时间①也是③的两倍,反应速率相等,故说明反应速率与降冰片烯浓度无关,B错误;由题干图中数据可知,条件①,反应速率为v===0.012mol•L-1•min-1,C正确;反应物消耗一半所需的时间称为半衰期,由题干图中数据可知,条件②,降冰片烯起始浓度为3.0mol·L-1时,半衰期为125min÷2=62.5min,D正确。
【题型三】含量-条件图像
【典例分析】
【典例3】(双选)(2019·江苏高考)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。列说法正确的是( )。
A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×10-4mol·L-1,NO平衡转化率为50%,则平衡常数K>2000
【解析】选B、D。A项,实线表示不同温度下相同时间内NO的转化率,虚线表示相同条件下随温度变化的NO的平衡转化率,随着温度升高,由虚线知,NO的平衡转化率减小,即温度升高,2NO+O22NO2的平衡逆向移动,说明该反应为放热反应,ΔH<0,错误;B项,与X点相同温度下,NO的转化率没有达到最大,所以反应没有达到平衡,如果延长时间,使反应达到平衡,则可以提高NO的转化率,正确;C项,Y点处,反应已达平衡,通入O2时,平衡正向移动,NO的转化率会提高,错误;D项,设起始时c(NO)=a mol·L-1,则:
2NO
+
O2
2NO2
起始mol·L−1
a
5×10-4
0
变化mol·L−1
0.5a
0.25a
0.5a
平衡mol·L−1
0.5a
5×10-4-0.25a
0.5a
K==>=2000,正确。
【提分秘籍】
1.含量-条件图像:mA(g)+nB(g)pC(g)+qD(g)
(1)极限点前:表示从反应物开始,v正>v逆,未达到平衡,受反应速率控制。
①升高温度,反应速率加快,A的百分含量减少, C的百分含量增加
②加入催化剂,反应物的转化率增大
(2)极限点M:刚达到平衡点,v正=v逆
(3)极限点后:新平衡点,v正=v逆,受平衡移动控制。
①即升高温度,A的百分含量增加或C的百分含量减少,平衡逆向移动,故该反应的ΔH<0。
②加入催化剂,平衡不移动,平衡转化率和百分含量不变。
2.注意“连续曲线型”和“连续断点型”图像中极限点的判断:2X(g)+Y(g)3Z(g)
图像
各点特点
I点为非平衡点,Ⅱ和Ⅲ点均为平衡点
I点为非平衡点,Ⅱ点为可能的平衡点,Ⅲ点为平衡点
【变式演练】
1.在容积均为500mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入lmolN2和2.5molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g)2NH3(g)△H<0。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是( )。
A.当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态
B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ
C.在t min时,一定没有达化学平衡状态的是I
D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小
【解析】选C。若为一个表示正反应速率、另一个表示逆反应速率,反应到达平衡,若为同方向速率,选项A中关系式在任何情况下都成立,不能说明到达平衡,没有指明H2和N2的正逆反应速率,不能说明反应达到了平衡状态,故A错误;由于不能确定容器II中氮气是否达到最小值,因此不能确定II是否达到平衡状态,故B错误;若未达平衡,温度越高反应速率越快,相同时间内氮气的含量越低,tmin时,氮气的含量Ⅲ比Ⅱ高,故Ⅲ到达平衡,故C正确;由质量守恒定律知,总质量不变,该反应为体积缩小的反应,Ⅲ中N2的含量最大,故总物质的量最大,故Ⅲ平均相对分子质量最小,故D错误。
2.(河南省天一大联考2022届高三上学期阶段性测试)用活性炭还原NO2可防止空气污染,其反应原理为2C(s)+2NO2(g)N2(g)+2CO2(g)。在密闭容器中1molNO2和足量C发生上述反应,反应相同时间内测得NO2的生成速率与N2的生成速率随温度变化的关系如图1所示;维持温度不变,反应相同时间内测得NO2的转化率随压强的变化如图2所示。
下列说法错误的是( )。
A.图1中的A、B、C三个点中只有C点的v正=v逆
B.图2中E点的v逆小于F点的v正
C.图2中平衡常数K(E)=K(G),则NO2的平衡浓度c(E)=c(G)
D.在恒温恒容下,向图2中C点平衡体系中充入一定量的NO2,与原平衡相比,NO2的平衡转化率减小
【解析】选C。由2C(s)+2NO2(g)N2(g)+2CO2(g)知,NO2的生成速率(逆反应速率)等于N2的生成速率(正反应速率)的两倍时,反应达到平衡状态,即v正=v逆,只有C点满足该条件,A选项正确;E点反应未达到平衡,F点反应刚好达到平衡,且F点压强大,则F点的速率快,B选项错误;E、G两点的温度相同,故平衡常数K(E)=K(G),G 点的压强大,容器的体积小,则NO2的平衡浓度大,C选项错误;在恒温恒容下,向图2中C点平衡体系中充入一定量的NO2,等效于加压,平衡逆向移动,与原平衡相比,NO2的平衡转化率减小,D选项正确。
3.(2022·黑龙江牡丹江高三3月模拟)在2L恒容密闭容器中充入2molX和1molY,发生反应:2X(g)+Y(g)3Z(g)ΔH<0,反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断不正确的是( )。
A.Q点时,Y的转化率最大
B.升高温度,平衡常数减小
C.W点X的正反应速率小于M点X的正反应速率
D.平衡时,再充入Z,达到平衡时Z的体积分数一定增大
【解析】选D。在Q对应温度之前,升高温度,X的含量减小,在Q对应温度之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应,据此分析解答。曲线上最低点Q为平衡点,升高温度平衡向逆反应移动,Y的转化率减小,所以Q点时,Y的转化率最大,A正确;已知该反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,导致化学平衡常数减小,B正确;W点对应的温度低于M点对应的温度,温度越高,反应速率越高,所以W点X的正反应速率小于M点X的正反应速率,C正确;该反应为气体体积不变的反应,恒容恒温度下,平衡时充入Z,二者为等效平衡,达到新平衡时Z的体积分数与原平衡时相等,D错误。
【题型四】某量-投料比图像
【典例分析】
【典例4】(2016·四川高考)一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )。
A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中=3
D.温度不变时,图中X点对应的平衡在加压后(CH4)减小
【解题指南】解答本题时应注意以下两点:(1)判断反应是吸热还是放热,看温度变化平衡向哪移动(2)Z增大,相当于增大水蒸气浓度,甲烷的转化率变大
【解析】选A。从图分析,随着温度升高甲烷的体积分数逐渐减小,说明升温平衡正向移动,则正反应为吸热反应,故A正确;的比值越大,起始时水蒸气浓度越大,则甲烷的转化率越大,甲烷的体积分数越小,故a<3<b,故B错误;起始加入量的比值为3,但反应中甲烷和水是按等物质的量反应的,所以到平衡时比值不是3,故C错误;温度不变时,加压,平衡逆向移动,甲烷的体积分数增大,故D错误。
【提分秘籍】
1.投料比对转化率和百分含量的影响
(1)反应物转化率相等的唯一条件:投料比=化学计量数比
(2)生成物含量最大的条件:投料比=化学计量数比
(3)催化剂的组成不变:投料比=化学计量数比
2.图像分析:以mA(g)+nB(g)pC(g)+qD(g)为例
(1)增大,即在B的量不变的基础上,增加A的量,平衡正向移动,C的量增多。
①开始阶段,C量的增加值比总量的增加值大,所以C的含量增加。
②b点=,C的含量最大
③后来阶段,C量的增加值比总量的增加值小,所以C的含量降低。
(2)反应物转化率间的关系
①a、b、c三点A的转化率:a>b>c
②a、b、c三点B的转化率:c>b>a
【变式演练】
1.(2022·湖南株洲高三4月模拟)已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比时CH4的平衡转化率如图所示.下列说法正确的是( )。
A.越大,CH4的转化率越高
B.不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
【解析】选B。由图象看出,CH4的转化率随为的增大而降低,故A错误;△H>0,该反应是吸热反应,升高温度平衡正向移动,NH3的体积分数会增大,故B正确;ab两点的温度相同,平衡常数只与温度有关,则平衡常数不变,故C错误;a点甲烷转化率为22%,=0.75,则设甲烷为3mol,氮气为4mol,则:
3CH4(g)
+
2N2(g)
3C(s)
+
4NH3(g)
起始mol·L−1
3
4
0
变化mol·L−1
0.66
0.44
0.88
平衡mol·L−1
2.34
3.56
0.88
则NH3的体积分数约为×100%=13%,故D错误。
2.反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中,Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )。
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加
【解析】选B。A项,加入催化剂,对平衡无影响,Q的体积分数不变,故A错误。B项,同压同Z时,升高温度,由图像可知M的体积分数y(M)减小,说明平衡向正反应方向进行,所以平衡时Q的体积分数增加,B正确。C项,同温同Z时,增加压强,对照两个图可知压强越大,M的体积分数y(M)越大,即平衡向逆反应方向移动,平衡时Q的体积分数应减小,所以C错误。D项,同温同压时,增加Z,由图像可知M的体积分数y(M)减小,可看作增加了N的物质的量,达平衡后,N的转化率降低,其百分含量升高,而其他物质不论是反应物还是生成物,其百分含量均降低,所以D错误。
3.在2L的密闭容器中发生反应xA(g)+yB(g)zC(g),图甲表示200℃时容器中A、B、C的物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
甲
乙
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当温度由200℃降到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2
【解析】选B。由图甲可知,反应中A、B、C的物质的量的变化量为0.4∶0.2∶0.2=2∶1∶1,根据反应中计量数之比等于物质的物质的量的变化量之比可知,该反应方程式为:2A(g)+B(g)C(g)。根据v=可知v(B)==0.02mol•L﹣1•min﹣1,故A错误;由图可知平衡时A、B、C的物质的量分别为0.4mol、0.2mol、0.2mol,所以它们的浓度分别为:0.2mol/L、0.1mol/L、0.1mol/L,结合化学方程式2A(g)+B(g)C(g),可知该反应的平衡常数为=25L2/mol2,故B正确;根据图乙可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,所以升高温度平衡正向移动,同时反应速率增大,故C错误;根据图乙可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,△H>0;当投入的反应物的物质的量之比等于化学反应中计量数之比时,平衡时C的体积分数达最大值,根据化学方程式2A(g)+B(g)C(g),可知a=2,故D错误。
【题型五】某量-条件图像
【典例分析】
【典例5】(2022·河北省选择考)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①XY;②YZ。反应①的速率v1=k1c(X),反应②的速率v2=k2c(Y),式中k1、k2为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的lnk∼曲线。下列说法错误的是
A.随c(X)的减小,反应①、②的速率均降低
B.体系中v(X)=v(Y)+v(Z)
C.欲提高Y的产率,需提高反应温度且控制反应时间
D.温度低于T1时,总反应速率由反应②决定
【解析】选AB。由图甲中的信息可知,随c(X)的减小,c(Y)先增大后减小,c(Z)增大,因此,反应①的速率随c(X)的减小而减小,而反应②的速率先增大后减小,A说法错误;根据体系中发生的反应可知,在Y的浓度达到最大值之前,单位时间内X的减少量等于Y和Z的增加量,因此,v(X)=v(Y)+v(Z),但是,在Y的浓度达到最大值之后,单位时间内Z的增加量等于Y和X的减少量,故v(X)+v(Y)=v(Z),B说法错误;升高温度可以可以加快反应①的速率,但是反应①的速率常数随温度升高增大的幅度小于反应②的,且反应②的的速率随着Y的浓度的增大而增大,因此,欲提高Y的产率,需提高反应温度且控制反应时间,C说法正确;由图乙信息可知,温度低于T时,k1>k2,反应②为慢反应,因此,总反应速率由反应②决定,D说法正确。
【提分秘籍】
1.化学平衡图像题“五看”
(1)一看面:即横坐标、纵坐标代表的量。
(2)二看线:即线的斜率大小、平与陡的含义、函数的增减性。
(3)三看点:即起点、终点、转折点、交叉点等。
(4)四看辅助线:等温线、等压线等。
(5)五看量:浓度等的改变量。
2.化学平衡图像题的思维模板
【变式演练】
1.(2022·广东省等级考)恒容密闭容器中,BaSO4(s)+4H2(g)BaS(s)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )。
A.该反应的△H<0
B.a为n(H2O)随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入BaSO4,H2的平衡转化率增大
【解析】选C。从图示可以看出,平衡时升高温度,氢气的物质的量减少,则平衡正向移动,说明该反应的正反应是吸热反应,即ΔH>0,故A错误;从图示可以看出,在恒容密闭容器中,随着温度升高氢气的平衡时的物质的量减少,则平衡随着温度升高正向移动,水蒸气的物质的量增加,而a曲线表示的是物质的量不随温度变化而变化,故B错误;容器体积固定,向容器中充入惰性气体,没有改变各物质的浓度,平衡不移动,故C正确;BaSO4是固体,向平衡体系中加入BaSO4,不能改变其浓度,因此平衡不移动,氢气的转化率不变,故D错误。
2.(江苏盐城2021~2022学年度高三上学期期中)CO2催化重整CH4的反应:(Ⅰ)CH4(g)+CO2(g)2CO(g)+2H2(g);ΔH1,主要副反应:(Ⅱ)H2(g)+CO2(g)CO(g)+H2O(g);ΔH2>0,(Ⅲ)4H2(g)+CO2(g)CH4(g)+2H2O(g);ΔH3<0。在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )。
A.ΔH1=2ΔH2-ΔH3<0
B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行
C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量
D.T℃时,在2.0L容器中加入2molCH4、2molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81
【解析】选BD。反应(Ⅰ)可由2倍(Ⅱ)减去反应(Ⅲ)得到,故ΔH1=2ΔH2-ΔH3,再根据图示,随温度的升高,CH4和CO2的体积分数减小,说明升温,平衡正移,而升温平衡向吸热方向移,正反应吸热,ΔH1>0,A不正确;其他条件不变,适当增大起始时V(CH4)∶V(CO2),即增大CH4浓度和减小CO2浓度,根据平衡移动原理,减小反应物浓度或增加生成物浓度,平衡都逆向移动,B正确;300~580℃时,H2O的体积分数不断增大,反应(Ⅲ)是放热反应,升温时,平衡逆移消耗H2O,反应(Ⅱ)是吸热反应,升温时正移,生成H2O,而由于反应(Ⅲ)消耗H2O的量小于反应(Ⅱ)生成水的量,C错误;T℃时,在2.0L容器中加入2molCH4、2molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则CO2转化的浓度为c(CO2)=×75%=0.75mol/L,根据三段式:
CH4
+
CO2
2CO
+
2H2
起始mol/L
1
1
0
0
变化mol/L
0.75
0.75
1.5
1.5
平衡mol/L
0.25
0.25
1.5
1.5
则反应(Ⅰ)的平衡常数K===81,但由于副反应(Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中,分子减小的更多,值小于81,D正确。
3.(2022·湖北七市高三3月联合调研)在一定温度下,BaSO4和C在一密闭容器中进行反应:BaSO4(s)+4C(s)BaS(s)+4CO(g),CO的平衡浓度(mol/L)的对数lgc(CO)与温度的倒数的关系如图所示,下列说法中正确的是( )。
A.Q点BaSO4的消耗速率小于生成速率
B.该反应的ΔH<0
C.温度是K时,反应的平衡常数为1
D.温度不变,将R点状态的容器体积扩大,重新达到平衡时,气体的压强减小
【解析】选A。由图可知,温度一定时,Q点的浓度熵大于平衡常数,平衡向逆反应方向移动,则硫酸钡的消耗速率小于生成速率,故A正确;由分析可知,该反应为吸热反应,反应ΔH>0,故B错误;由图可知,为×10-4K-1时,反应的平衡常数为1,则反应温度T=3×104K,故C错误;反应的化学平衡常数K=c4(CO),平衡常数为温度函数,温度不变,平衡常数不变,则温度不变,将R点状态的容器体积扩大,重新达到平衡时,一氧化碳的浓度不变,气体的压强不变,故D错误。
【题型六】某量-条件-条件图像
【典例分析】
【典例6】(2022·黑龙江大庆高三3月模拟)在一恒容的密闭容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )。
A.上述反应的ΔH>0
B.压强:p4>p3>p2>p1
C.1100℃时该反应平衡常数约为1.64
D.压强为p4时,在y点:v(正)<v(逆)
【解析】选D。从图象分析,随温度升高CH4转化率增大,平衡正向移动,正反应吸热,△H>0,故A正确;根据方程式,压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1,故B正确;
CH4
+
CO2
2CO
+
2H2
起始mol/L
0.1
0.1
0
0
变化mol/L
0.08
0.08
0.16
0.16
平衡mol/L
0.02
0.02
0.16
0.16
平衡常数K===1.64mol2/L2,故C正确;在y点,甲烷的转化率小于平衡时的转化率,反应正向进行,v正>v逆,故D错误。
【提分秘籍】
1.恒温线(或恒压线)图像及分析
(1)纵坐标代表反应物的转化率(α)或平衡浓度(c),横坐标代表温度(T)或压强(p)。
(2)采用“定一议二”法,即将自变量(温度或压强)之一看作恒量,讨论另外两个量的关系。
反应2A(g)+B(g)2C(g)达到平衡
图像
图像分析
定压看温度变化,升温,曲线走势降低,说明A的转化率降低,平衡向左移动,正反应是放热反应。
定温看压强变化,因为此反应是反应前后气体体积减小的反应,压强增大,平衡向右移动,A的转化率增大,故p2>p1。
【变式演练】
1.已知:(HF)2(g)2HF(g)ΔH>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )。
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当=30g·mol-1时,n(HF)∶n[(HF)2]=2∶1
【解析】选C。平衡体系的总质量m(总)与总物质的量n(总)之比即为混合气体的平均摩尔质量,压强一定时,升高温度,(HF)2(g)2HF(g)正向移动,n(总)增大,由于m(总)不变,则减小,由图可知,温度:T1>T2,A错误;平衡常数K随温度变化而发生变化,与压强大小无关,升高温度,平衡正向移动,平衡常数K增大,故平衡常数关系为K(a)=K(c)<K(b),B错误;由A项分析可知T1>T2,温度升高,反应速率加快,故反应速率:v(b)>v(a),C正确; n(HF)∶n[(HF)2]=2∶1时,混合气体中=≈26.7g·mol-1,D错误。
2.向两个体积可变的密闭容器中均充入1mol的A2和2mol的B2发生反应:A2(g)+2B2(g)2AB2(g)ΔH。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
已知:图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上;Ⅳ点不在曲线上。下列叙述正确的是( )。
A.Ⅰ点和Ⅱ点反应速率相等
B.Ⅳ点时反应未到达平衡v(正)<v(逆)
C.Ⅰ点时,A的平衡转化率为40%
D.将点Ⅱ所对应容器冷却到600K,可变成点Ⅰ
【解析】选B。A2(g)+2B2(g)2AB2(g)正反应气体物质的量减小,根据图示,相同温度下,压强为p1时,达到平衡AB2的体积分数大于压强为p2时的体积分数,所以p1>p2,Ⅱ点比Ⅰ点温度高、压强大,所以反应速率Ⅱ点大于Ⅰ点,故A错误;Ⅳ点对应的温度下,达到平衡AB2的体积分数减小,反应逆向进行,所以Ⅳ点时反应未到达平衡v(正)<v(逆),故B正确;
=0.4,x=0.5,Ⅰ点时,A的平衡转化率为50%,故C错误;将点Ⅱ所对应容器冷却到600K,点Ⅱ在压强为p1的曲线上向左移动,故D错误。
3.乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如图[起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L]。下列分析不正确的是( )。
A.乙烯气相直接水合反应的ΔH>0
B.图中压强的大小关系为p1>p2>p3
C.图中a点对应的平衡常数的数值K=
D.达到平衡状态a、b所需要的时间:a>b
【解析】选AB。压强不变时,升高温度乙烯转化率降低,平衡逆向移动,正反应为放热反应,则ΔH<0,故A不正确;相同温度下,增大压强平衡正向移动,乙烯转化率增大,根据图知,压强:p1<p2<p3,故B不正确;a点乙烯转化率为20%,则消耗的n(C2H4)=1mol×20%=0.2mol,根据“三段式”:
C2H4(g)
+
H2O(g)
C2H5OH(g)
起始mol/L
1
1
0
变化mol/L
0.2
0.2
0.2
平衡mol/L
0.8
0.8
0.2
化学平衡常数K===L/mol,故C正确;温度越高、压强越大,化学反应速率越快,反应达到平衡时间越短,温度、压强:a<b,则反应速率:a<b,所以达到平衡状态a、b所需要的时间:a>b,故D正确。
【题型七】选择性-条件图像
【典例分析】
【典例7】(2022·江苏省选择考)乙醇-水催化重整可获得H2。其主要反应为:
C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g)△H=173.3kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g)△H=41.2kJ·mol-1
在1.0×105Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
CO的选择性×100%,下列说法正确的是( )。
A.图中曲线①表示平衡时H2产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
【解析】选D。根据已知反应①C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g)△H=173.3kJ·mol-,反应②CO2(g)+H2(g)=CO(g)+H2O(g)△H=41.2kJ·mol-1,且反应①的热效应更大,温度升高的时候对反应①影响更大一些,即CO2选择性增大,同时CO的选择性减小,根据CO的选择性的定义可知③代表CO2的选择性,①代表CO的选择性,②代表H2的产率。由分析可知②代表H2的产率,故A错误;由分析可知升高温度,平衡时CO的选择性减小,故B错误;一定温度下,增大,可以认为开始时水蒸气物质的量不变,增大乙醇物质的量,乙醇的平衡转化率降低,故C错误;加入CaO(s)与水反应放热,且CaO吸收CO2,促进反应①向正反应方向进行,反应②向逆反应方向进行,对反应①影响较大,可以增大H2产率,或者选用对反应①影响较大的高效催化剂,增加反应①的反应,减少反应②的发生,也可以增大H2产率,故D正确。
【提分秘籍】
1.指某一反应物转化为目的产物,其理论消耗的物质的量占该反应物在反应中实际消耗的总物质的量的百分数。
2.催化剂对反应有选择性,改变催化剂,可以提高某反应的选择性。
3.多重平衡中的选择性
4.“平衡图像”认知模型构建
【变式演练】
1.(南京市、盐城市2022届高三一模)一种捕获并资源化利用CO2的方法是将CO2催化加氢合成CH3OCH3,其过程中主要发生如下反应:
Ⅰ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)ΔH1=-122.5kJ·mol-1
Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
向恒压密闭容器中充入1molCO2和3molH2,CO2的平衡转化率和平衡时CH3OCH3的选择性[CH3OCH3的选择性=×100%]随温度的变化如右图所示。下列说法错误的是( )。
A.2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)ΔH=-204.9kJ·mol-1
B.由图可知,210℃时以反应Ⅰ为主,300℃时,以反应Ⅱ为主
C.增大反应体系压强,CH3OCH3选择性增大
D.反应状态达A点时,容器中n(CH3OCH3)为mol
【解析】选D。A项,依据盖斯定律,按“反应I-反应II×2”,可得所求反应,ΔH=-122.5kJ·mol-1-41.2kJ·mol-1×2=-204.9kJ·mol-1,正确;B项,210℃时,CH3OCH3(g)的选择性较大,同时CO2的平衡转化率也较大,以反应I为主,300℃时,CH3OCH3(g)的选择性小,同时CO2的平衡转化率也小,以反应II为主,正确;C项,增大压强,反应I正向移动,生成更多的CH3OCH3(g),即CH3OCH3选择性增大,正确;D项,依据CH3OCH3的选择性公式:CH3OCH3的选择性=×100%,A点处,CH3OCH3的选择性和CO2的平衡转化率均为25%,即25%=×100%,则n(CH3OCH3)=0.25mol×0.25mol×=mol,错误。
2.(江苏扬州2021~2022学年高三3月模拟)二氧化碳加氢合成二甲醚(CH3OCH3)具有重要的现实意义和广阔的应用前景。该方法主要涉及下列反应:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH1=−49.0kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
反应Ⅲ:2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH3=−24.5kJ·mol-1
向恒压密闭容器中按n(CO2)∶n(H2)=1∶3通入CO2和H2,平衡时各含碳物种的体积分数随温度的变化如图所示。下列有关说法正确的是( )。
A.反应I的平衡常数可表示为K=
B.图中曲线b表示CO2的平衡体积分数随温度的变化
C.510K时,反应至CH3OCH3的体积分数达到X点的值,延长反应时间不能提高CH3OCH3的体积分数
D.增大压强有利于提高平衡时CH3OCH3的选择性(CH3OCH3的选择性=×100%)
【解析】选D。反应Ⅰ中H2O也是气态,所以平衡常数为K=,A错误;只有反应Ⅲ涉及CH3OCH3,反应Ⅲ焓变小于0,升高温度平衡逆向移动,所以CH3OCH3的体积分数会随温度升高而降低,则b代表的应该是CH3OCH3,a代表CO2,B错误;b代表的应该是CH3OCH3,X点位于曲线下方,所以延长反应时间可以提高CH3OCH3的体积分数,C错误;反应Ⅰ为气体系数之和减小的反应,反应Ⅱ、Ⅲ均为气体系数之和不变的反应,增大压强,反应Ⅰ平衡正向移动,CH3OH的浓度增大,虽然H2O的浓度也增大,但CH3OH的系数为2,所以反应Ⅲ平衡正向移动,CH3OCH3的选择性增大,D正确。
【题型八】速率平衡表格分析
【典例分析】
【典例8】(2022·浙江6月选考)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g)N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )。
A.实验①,0~20min,v(N2)=1.00×10-5mol•L-1•min-1
B.实验②,60min时处于平衡状态,x≠0.4
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
【解析】选C。实验①中,0~20min,氨气浓度变化量为2.40×10-3mol/L-2.00×10-3mol/L=4.00×10-4mol/L,v(NH3)==2.00×10-5 mol•L-1•min-1,反应速率之比等于化学计量数之比,v(N2)=v(NH3)=1.00×10-5 mol•L-1•min-1,A正确;催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达到平衡时氨气浓度为4.00×10-4mol/L,则实验①达平衡时氨气浓度也为4.00×10-4mol/L,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,因此实验②60min时处于平衡状态,x<0.4,即x≠0.4,B正确;实验①、实验②中0~20min、20min~40min氨气浓度变化量都是4.00×10-4mol/L,实验②中60min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①60min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;对比实验①和实验③,氨气浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D正确。
【提分秘籍】
1.数据表格的处理方法
(1)明确表格数据的单位
(2)总结表格数据的变化规律,判断相应的平衡状态。
(3)结合化学平衡常数、化学反应速率、平衡转化率进行相关计算。
(4)不同状态下的数据处理要注意利用对比法综合分析。
2.看单位时间内某量的变化量,比较速率快慢和条件高低
(1)单位时间内某量的变化量越大,反应速率越快,反应条件越高
(2)举例:不同温度下,反应物A的物质的量(mol)随时间变化表
组别
温度
时间/min
0
10
20
40
50
结论
①
T1
0.50
0.35
0.25
0.10
0.10
T1___T2
②
T2
0.50
0.30
0.18
a
0.15
a=___
①单位时间内实验②的物质的量变化大,则②的反应速率快,温度:T1<T2
②实验②反应速率快,达到平衡所用的时间短,实验②不到40min达到平衡,则a=0.15
【变式演练】
1.(2021年1月高三八省联考辽宁卷)苯乙烯与溴苯在一定条件下发生Heck反应: +
溴苯用量(mmol)
100
100
100
100
100
100
100
催化剂用量(mmol)
2
2
2
2
2
2
2
反应温度(℃)
100
100
100
100
120
140
160
反应时间(h)
10
12
14
16
14
14
14
产率(%)
81.2
84.4
86.6
86.2
93.5
96.6
89.0
根据上表数据,下列说法正确的是( )。
A.最佳反应温度为100℃
B.最佳反应时间为16h
C.温度过高时催化剂活性可能降低
D.反应产物是顺式结构
【解析】选C。根据表格信息,当反应温度为140℃,反应时间为14h时,生成物的产率最大,因此最佳反应温度为140℃,A错误;由A的分析可知,最佳反应时间为14h,B错误;根据表格数据,温度超过140℃时,生成物的产率降低,可能是温度过高导致了催化剂活性降低,C正确;反应产物为,属于反式结构,D错误。
2.(2021·浙江6月选考)一定温度下:在N2O5的四氯化碳溶液(100mL)中发生分解反应:2N2O54NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
t/s
0
600
1200
1710
2220
2820
x
c(N2O5)/mol·L-1
1.40
0.96
0.66
0.48
0.35
0.24
0.12
下列说法正确的是( )。
A.600~1200s,生成NO2的平均速率为5.0×10-4mol·L-1·s-1
B.反应2220s时,放出的O2体积为11.8L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测上表中的x为3930
【解析】选D。600~1200s,N2O5的变化量为(0.96-0.66)mol·L-1=0.3mol·L-1,在此时间段内NO2的变化量为其2倍,即0.6mol·L-1,因此,生成NO2的平均速率为=1.0×10-3mol·L-1·s-1,A说法不正确;由表中数据可知,反应2220s时,N2O5的变化量为(1.40-0.35)mol·L-1=1.05mol·L-1,其物质的量的变化量为1.05mol·L-1´0.1L=0.105mol,O2的变化量是其,即0.0525mol,因此,放出的O2在标准状况下的体积为0.0525mol´22.4L/mol=1.176L,B说法不正确;反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,2v正(N2O5)=v逆(NO2),C说法不正确;分析表中数据可知,该反应经过1110s(600~1710,1710~2820)后N2O5的浓度会变为原来的,因此,N2O5的浓度由0.24mol·L-1变为0.12mol·L-1时,可以推测上表中的x为(2820+1110)=3930,D说法正确。
3.(2022·辽宁省选择考)某温度下,在1L恒容密闭容器中2.0molX发生反应2X(s)Y(g)+2Z(g),有关数据如下:
时间段/min
产物Z的平均生成速率/mol·L-1·min-1
0~2
0.20
0~4
0.15
0~6
0.10
下列说法错误的是( )。
A.1min时,Z的浓度大于0.20mol·L-1
B.2min时,加入0.20molZ,此时v正(Z)<v逆(Z)
C.3min时,Y的体积分数约为33.3%
D.5min时,X的物质的量为1.4mol
【解析】选B。反应开始一段时间,随着时间的延长,反应物浓度逐渐减小,产物Z的平均生成速率逐渐减小,则0~1min内Z的平均生成速率大于0~2min内的,故1min时,Z的浓度大于0.20mol·L-1,A正确;1min时生成的Z的物质的量为0.15mol·L-1·min-1×4min×1L=0.6mol,6min时生成的Z的物质的量为0.10mol·L-1·min-1×6min×1L=0.6mol,故反应在4min时已达到平衡,设达到平衡时生了amolY,列三段式:
2X(s)
Y(g)
+
2Z(g)
起始mol
2.0
0
0
变化mol
2a
a
2a
平衡mol
2.0-2a
a
2a
根据2a=0.6mol,得a=0.3mol,则Y的平衡浓度为0.30mol·L-1,Z的平衡浓度为0.60mol·L-1,平衡常数K=c2(Z)·c(Y)=0.602·0.30=0.108,2min时Y的浓度为0.20mol·L-1,Z的浓度为0.40mol·L-1,加入0.20molZ后Z的浓度变为0.6mol·L-1,Q=c2(Z)·c(Y)=0.602·0.20=0.072<K,反应正向进行,故v正(Z)>v逆(Z),B错误;反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,相同条件下,体积之比等于物质的量之比,V(Y)∶V(Z)=1∶2,故Y的体积分数始终约为33.3%,C正确;由B项分析可知5min时反应处于平衡状态,此时生成Z为0.6mol,则X的转化量为0.6mol,初始X的物质的量为2mol,剩余X的物质的量为1.4mol,D正确。
1.(2022~2023河南安阳高三11月模拟)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收,使SO2转化生成为S。催化剂不同,相同其他条件(浓度、温度、压强)情况下,相同时间内SO2的转化率随反应温度的变化如下图:下列说法不正确的是( )。
A.不考虑催化剂价格因素,选择Fe2O3作催化剂可以节约能源
B.相同其他条件下,选择Cr2O3作催化剂,SO2的平衡转化率最小
C.a点后SO2的转化率减小的原因可能是温度升高催化剂活性降低了
D.选择Fe2O3作催化剂,最适宜温度为340~380℃温度范围
【解析】选B。根据图像可知,当温度在340℃时,在Fe2O3作催化剂条件下,反应先达到平衡,SO2的平衡转化率最大,A正确;相同其他条件下,选择Cr2O3作催化剂,在温度为380℃时,SO2的平衡转化率不是最小的,NiO作催化剂时,相同温度下,SO2的转化率是最小的,B错误;催化剂催化能力需要维持在一定的温度下,温度太高,催化剂活性可能会降低,C正确;340~380℃温度范围内,催化剂的催化能力最大,二氧化硫的转化率也是最大,反应速率最快,D正确。
2.(江苏省宜兴市2021~2022学年高三上学期期中)25℃时,向40mL0.05mol/L的FeCl3溶液中一次性加入10mL0.15mol/L的KSCN溶液,发生反应,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示。下列说法正确的是( )。
A.该反应的离子方程式为Fe3++3SCN-Fe(SCN)3↓
B.E点对应的坐标为(0,0.04)
C.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动
D.若该反应是可逆反应,在25℃时平衡常数的数值为
【解析】选BD。Fe3+与SCN-反应生成络合物,不是沉淀,离子方程式为Fe3++3SCN-Fe(SCN)3,故A错误;E点为反应起点,混合溶液体积为50mL,此时溶液中c(Fe3+)==0.04mol/L,所以E点对应的坐标为(0,0.04),故B正确;t4时向溶液中加入50mL0.1mol/LKCl溶液,相当于稀释溶液,平衡逆向移动,故C错误;由图可知,平衡时Fe3+浓度为m,则Fe(SCN)3浓度为(0.04-m)mol/L,SCN-的浓度为c(SCN-)=-3×(0.04-m)mol/L=(3m-0.09)mol/L,所以平衡常数K==,故D正确。
3.(河南三门峡市2022届高三上学期期末检测)298K时,0.180mol·L-1γ-羟基丁酸水溶液发生如下反应,生成γ-丁内酯:HOCH2CH2CH2COOH+H2O不同时刻测得γ-丁内酯的浓度如下表。
t/min
20
50
80
100
120
160
220
∞
c/mol·L-1
0.024
0.050
0.071
0.081
0.090
0.104
0.116
0.132
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是( )。
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298K时,该反应的平衡常数为2.75
C.反应至120min时,γ-羟基丁酸的转化率<50%
D.80~120min的平均反应速率:v(γ-丁内酯)>1.2×10-3mol·L-1·min-1
【解析】选B。增大γ-羟基丁酸的浓度可以使平衡正向移动,γ-丁内酯的产量增加,但不能提高γ-丁内酯的产率,A错误;该反应的平衡常数K===2.75,B正确;反应至120min时,丁内酯的浓度为0.090mol·L-1,反应了的γ-羟基丁酸的浓度为0.090mol·L-1,转化率为×100%=50%,C错误;80~120min,∆c(γ-丁内酯)=(0.09-0.071)mol·L-1,平均反应速率:v(γ-丁内酯)==4.75×10-4mol·L-1·min-1,D错误。
4.(2022·广西池州高三3月阶段练习)某温度时,若向2L体积恒定的密闭容器中充入一定量X(g)和Y(g)发生反应:X(g)+Y(g)Z(s)+2W(g),其中X、W的物质的量随时间变化的曲线如图所示。下列说法中正确的是( )。
A.点A时反应达到平衡状态
B.前10min内,v(Y)=0.02mol·L-1·min-1
C.第10min时,改变的外界条件可能是加入催化剂
D.第10min时,改变的外界条件可能是增大Z的量
【解析】选C。由图可知,反应在第12min时达到平衡,A点时,X、W的物质的量还在改变,反应没有达到平衡状态,A错误;前10min内,X的物质的量的减少0.45mol-0.25mol=0.2mol,根据转化物质的量之比等于化学计量数之比,则Y物质的量减少0.2mol,v(Y)==0.01mol·L-1·min-1,B错误;由图可知,第10min时改变条件,化学反应速率加快,故改变的外界条件可能是加入催化剂,C正确;由图可知,第10min时改变条件,化学反应速率加快,因为Z是固体,增大固体的量对化学反应速率无影响,故改变的外界条件不可能是增大Z的量,D错误。
5.(2022·河北邢台一模)在两个容积均为2L的恒容密闭容器中,起始时均充入amolH2S,以温度、Al2O3催化剂为实验条件变量,进行H2S的分解实验[反应为2H2S2H2(g)+S2(g)]。测得的结果如图所示。(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)
下列说法正确的是( )。
A.温度升高,H2S分解的速率增大,S2的含量减少
B.由曲线Ⅱ、Ⅲ可知,加入Al2O3可提高H2S的平衡转化率
C.900℃时,ts后达到平衡,则H2的生成速率为mol·L-1·s-1
D.约1100℃,曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
【解析】选D。由图像可知,温度升高,H2S的分解速率增大,H2S转化率增大,则平衡右移,S2的含量增大,故A错误;催化剂不影响平衡的移动,加入催化剂Al2O3,H2S的平衡转化率不变,故B错误;900℃时,ts后达到平衡,H2S的平衡转化率为50%,则生成的氢气为amol,则H2的生成速率为v(H2)==mol·L-1·s-1,故C错误;催化剂需要适宜温度,根据图像,约1100℃,曲线Ⅱ、Ⅲ几乎重合,说明不论有无催化剂,反应速率相同,则Al2O3可能几乎失去催化活性,故D正确。
6.(江苏常州2021~2022学年度高三上学期期中)一定温度下将2molCO和2molH2O(g)充入2.0L恒容绝热的密闭容器中,发生CO(g)+H2O(g)CO2(g)+H2(g)ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )。
A.图中d点所示条件下,延长反应时间不能提高CO的转化率
B.反应器中的压强不变,说明反应已经达到平衡状态
C.Δt1=Δt2时,反应物的转化率:b~c段小于a~b段
D.e点CO的转化率为80%,则该温度下平衡常数为K=16
【解析】选BD。根据图示可知:开始发生反应后,气体反应速率加快,说明该反应的正反应为放热反应,由于反应是在恒容绝热的密闭容器中进行,d点后正反应速率逐渐降低,说明d点反应达到平衡状态,后延长反应时间,反应正反应速率降低,则反应物浓度减小,化学平衡状态正向移动,时CO的转化率提高,A错误;该反应是反应前后气体体积不变的反应,反应是在恒容绝热的密闭容器中进行的,若反应器中的压强不变,说明反应温度不变,此时反应已经达到平衡状态,B正确;反应速率越快,相同时间内反应物转化为生成物的就更多,反应物的转化率越大,由于反应速率:b~c段>a~b段,所以反应物的转化率:b~c段大于a~b段,这与相同时间段内速率改变量大小无关,C错误;反应开始时c(CO)=c(H2O)=1mol/L,c(CO2)=c(H2)=0,e点CO的转化率为80%,则该温度下平衡时c(CO)=c(H2O)=0.2mol/L,c(CO2)=c(H2)=0.8mol/L,根据平衡常数的含义可知平衡常数为K===16,D正确。
7.(安徽A10联盟2023届高三开学摸底考)反应2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0可有效降低汽车尾气中污染物的排放。一定条件下,向某恒容密闭容器中按物质的量比为2∶1充入NO和CO,一段时间后达到平衡。下图曲线M表示该反应在温度T0℃下,CO的物质的量浓度随时间的变化;曲线N则表示该反应改变某一起始条件时的变化。
下列叙述正确的是( )。
A.混合气体的密度:(x)>(y)>(z)
B.化学反应速率:v正(x)>v正(z)>v逆(y)
C.在温度T0℃下,该反应的化学平衡常数K=
D.曲线N改变的条件是升高温度
【解析】选B。由于平衡建立过程中混合气体的总质量不变,恒容密闭容器的总体积不变,则混合气体的密度:(x)=(y)=(z),A错误;根据教材化学平衡建立速率时间图像,可判断v正(x)>v正(z)>v逆(y),B正确;平衡时,c(CO2)=2c(N2)=(c0-c1)mol·L-1,c(CO)=c1mol·L-1,c(NO)=(c0+c1)mol·L-1,K=,C错误;该反应的正反应为放热反应,升高温度反应速率加快,达到平衡时间缩短但CO的转化率应减小,与图像不符,D错误。
8.(重庆南开中学高2023届高三九月考试)某反应在不同pH下产物A的浓度随时间变化的关系如图所示(其他条件相同),则下列有关说法正确的是( )。
A.pH=8.5时,随着反应的进行反应速率逐渐增大
B.若减小压强,该反应的反应速率会减小
C.用调节pH的方法可以使该反应停止
D.一定pH范围内,溶液中H+浓度越大,反应速率越慢
【解析】选C。图像中表示反应速率的是曲线的斜率,pH=8.5时,随着反应的进行,曲线的斜率逐渐减小,A错误;图像没有给出压强对反应速率的影响,不能确定,B错误;pH=9.0时,c(A)基本不变,说明反应停止,C正确;pH越小,H+浓度越大,反应速率越快,D错误。
9.(新疆喀什2021~2022学年高三下学期开学考)用CO还原N2O的方程式为:N2O(g)+CO(g)N2(g)+CO2(g)。在体积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)中分别加入0.1molN2O、0.4molCO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图所示。下列说法错误的是( )。
A.A容器中的转化率随时间的变化关系是图中的a曲线
B.要缩短b曲线对应容器达到平衡的时间,但不改变N2O平衡转化率,在催化剂一定的情况下可采取缩小容器体积的措施
C.500℃该反应的化学平衡常数K=
D.该反应是放热反应
【解析】选A。根据图像,a曲线比b曲线达到平衡的时间短,a曲线的反应速率比b曲线快,a曲线的温度比b曲线高,平衡时N2O的转化率:a曲线比b曲线小,说明升高温度平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,容器A为恒温容器,容器B为绝热容器,容器B中随着反应的进行温度升高,故曲线a代表B容器中的转化率随时间的变化关系,曲线b代表A容器中的转化率随时间的变化关系,A错误;该反应为反应前后气体分子数不变的反应,缩小容器的体积,增大压强,化学反应速率加快、达到平衡的时间缩短,但平衡不移动,N2O的平衡转化率不变,故要缩短b曲线对应容器达到平衡的时间,但不改变N2O平衡转化率,在催化剂一定的情况下可采取缩小容器体积的措施,B正确;根据b曲线知,500℃N2O的平衡转化率为25%,用三段式:
N2O
+
CO
N2
+
CO2
起始mol/L
0.1
0.4
0
0
变化mol/L
0.025
0.025
0.025
0.025
平衡mol/L
0.075
0.775
0.025
0.025
则该反应的平衡常数K===,C正确;根据A项分析,该反应为放热反应,D正确。
10.(江苏省苏锡常镇四市2022届高三5月模拟考试)Sabatiner反应能实现CO2的吸收与转化,反应方程式为:CO2(g)+4H2(g)CH4(g)+2H2O(g),在体积不变的密闭容器中,将原料气按n(CO2)∶n(H2)=1∶4充入,测得容器中H2O(g)的物质的量分数与温度的关系如图所示(实线表示反应进行相同时间时测得的数据,虚线表示平衡曲线)。下列说法正确的是( )。
A.该反应是吸热反应
B.若容器内气体密度保持不变,则反应达到平衡状态
C.适当升温能提高CO2的转化效率
D.增大催化剂的比表面积,能提高CO2的平衡转化率
【解析】选C。根据图像虚线,平衡时水的物质的量分数随温度升高而降低,该反应为放热反应,A项错误;B项中由于容器体积不变,容器内气体体积保持不变,因此气体平均密度始终保持不变,不能作为达到平衡的标志,B项错误;C项,适当升高温度,能加快反应速率,因此可以提高CO,的转化效率;D项中催化剂不改变平衡转化率,D项错误。
11.(2022·陕西汉中3月质检)已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol•L-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如右图所示的曲线。下列说法不正确的是( )。
A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7mol·L-1
【解析】选D。由图可知氢离子浓度越大,c(Cr2O72-)越大,所以pH越小,c(Cr2O72-)越大,故A正确;由图可知A点时Cr2O72-的平衡浓度为0.25mol/L,所以转化的CrO42-的浓度为:0.5mol/L,则A点CrO42-的平衡转化率为50%,故B正确;2CrO42-+2H+Cr2O72-+H2O的平衡常数为:K===1014,故C正确;平衡时,若溶液中c(Cr2O72-)=c(CrO42-),而2c(Cr2O72-)+c(CrO42-)=1.0mol•L-1,所以mol•L-1,而图中c(Cr2O72-)=0.35mol/L时,对应氢离子的浓度为2.0×10-7mol•L-1,则溶液中c(Cr2O72-)=c(CrO42-),则c(H+)<2.0×10-7mol•L-1,故D错误。
12.(2022·石家庄4月模拟)在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )。
A.反应CO2(g)+C(s)2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
【解析】选C。由气体的化学计量数增大可知△S>0,由图中温度高,平衡时c(CO2)小,则升高温度,平衡正向移动,可知△H>0,故A错误;分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,若平衡不移动,体系的总压强为P总(状态Ⅱ)=2P总(状态Ⅰ),但加压CO2(g)+C(s)2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),故B错误;状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;状态I、状态Ⅲ的温度不同,温度高,反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误。
13.(湖南师大附中2021~2022学年高三3月模拟)在密闭容器中:按CO2与H2的物质的量之比为1∶3进行投料,发生反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)△H<0,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(V%)如图所示,下列说法中正确的是( )。
A.表示CH3CH2OH组分的曲线是IV
B.图中曲线交点a、b对应的上述反应平衡常数Ka>Kb
C.图中曲线交点a对应的CO2转化率为60%
D.若甲、乙两个密闭容器起始时的容积、温度及投料方式均相同,甲:恒温恒压,乙;恒温恒容,反应达平衡时CH3CH2OH产率:甲<乙
【解析】选A。该反应为放热反应,升高温度平衡向逆反应方向移动,则升高温度CH3CH2OH含量减小,CO2与H2的含量升高,平衡时H2O的含量是CH3CH2OH含量的三倍,符合条件的曲线为Ⅳ,故A正确;因为平衡常数仅与温度有关,该反应为放热反应,升高温度平衡向逆反应移动,所以温度越低,K越大,所以Ka<Kb,故B错误;图中曲线Ⅱ为CO2,曲线Ⅲ为H2O,曲线交点a为二氧化碳和水平衡时的体积分数相等,根据反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)可知,1molCO2反应消耗0.4mol,平衡时为0.6mol,生成水0.6mol,所以CO2转化率为40%,故C正确;根据反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),随着反应进行,体积减小,甲为恒温恒压,乙为恒温恒容,则甲相对于乙在减小体积,即增大压强,平衡向正反应方向移动,所以反应达平衡时CH3CH2OH产率:甲>乙,故D错误。
14.(湖南永州市2023年高考第一次适应性考试)甲烷重整制合成气,体系中主要反应如下:
I.CH4(g)+H2O(g)CO(g)+3H2(g)ΔH1
II.CH4(g)+CO2(g)2CO(g)+2H2(g)ΔH2
各反应平衡常数与温度的关系如图所示,下列说法正确的是( )。
A.体系温度高于1000K时,升温对反应I的平衡影响更大
B.理论上,反应II在低温下可自发进行
C.1000K时,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K=1
D.1000K时,若平衡时=2,则=2,应控制起始投料比=2
【解析】选CD。由图可知,升高温度lnK均变大,说明平衡正向移动,反应均为吸热反应。由图可知,体系温度高于1000K时,升温反应I曲线变化程度较小,故升温对反应II的平衡影响更大,A错误;反应II为吸热的熵增反应,故根据∆H-T∆S<0反应可自发进行,理论上反应II在高温下可自发进行,B错误;根据盖斯定律可知,反应II-反应I得到反应CO2(g)+H2(g)CO(g)+H2O(g);1000K时,反应II、反应I的K值相等,则反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K==1,C正确;据C分析可知,1000K时,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K==1,若平衡时=2,则=2,由于反应在同一容器中进行,且反应中二氧化碳、水的系数相等,则起始投料比=2,D正确。
15.(广东省深圳市光明区2023届高三上学期第一次模拟)工业上制备硝酸过程中涉及反应:2NO(g)+O2(g)2NO2(g)△H=-57kJ·mol-1。某实验小组测得不同条件下反应平衡时NO2的体积分数变化如下图(图中X、Y分别代表温度或压强),下列说法不正确的是( )。
A.图中X表示温度,Y表示压强
B.X1>X2>X3
C.对应条件下的平衡常数:a>b>c
D.X3、Y1条件下,e点对应状态时v(逆)>v(正)
【解析】选A。该反应中温度越高NO2的平衡体积分数越低,压强越大NO2的平衡体积分数越大,由图可知Y表示温度,X表示压强,A项错误;压强越大NO2的平衡体积分数越大,所以X1>X2>X3,B项正确;反应为放热反应,温度越高平衡常数越小,所以a>b>c,C项正确;X3、Y1条件下,e点状态NO2体积分数较高,反应逆向进行,此时v(逆)>v(正),D项正确。
16.(江苏省扬州2021~2022学年高三上学期12月模拟)表中所列是2个反应在不同温度时的化学平衡常数(K)值。
反应
①N2(g)+O2(g)2NO(g)
②N2(g)+3H2(g)2NH3(g)
温度/℃
27
2000
25
400
450
K
3.8×10-31
0.1
5×108
0.507
0.152
关于反应①、②的下列说法正确的是( )。
A.①、②都需要在一定条件才能发生,但①是放热反应,②是吸热反应
B.一定温度下,①、②分别达到平衡,压缩容器体积(加压)均可使N2的转化率增大
C.①、②均实现了“固氮”的过程,其中①比较适合用于大规模人工固氮
D.即使已知①、②的ΔH,仍然无法求算反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)的ΔH
【解析】选D。①N2(g)+O2(g)2NO(g)随温度升高,K值增大,平衡正向移动,是吸热反应,②N2(g)+3H2(g)2NH3(g)随温度升高,K值减小,平衡逆向移动,是放热热反应,A项错误;一定温度下,①N2(g)+O2(g)2NO(g)是气体体积不变的反应,压缩容器体积(加压)平衡不移动,不能使N2的转化率增大,B项错误;①、②均实现了“固氮”的过程,但①是吸热反应,平衡常数太小,不适合用于大规模人工固氮,C项错误;①N2(g)+O2(g)2NO(g),②N2(g)+3H2(g)2NH3(g),由盖斯定律,①×2-②×2得:4NH3(g)+2O2(g)4NO(g)+6H2(g),得不到4NH3(g)+5O2(g)4NO(g)+6H2O(g),D项正确。
17.(2022·湖南岳阳高三4月模拟)往2L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4):
时间(min)
浓度
(mol·L-1)
0
10
20
30
40
50
实验1/800℃
1.00
0.80
0.65
0.55
0.50
0.50
实验2/800℃
1.00
0.70
0.50
0.50
0.50
0.50
实验3/850℃
1.00
050
0.40
0.15
0.15
0.15
下列说法正确的是( )。
A.实验2比实验1使用了效率更高的催化剂
B.实验2比实验1的反应容器体积小
C.由实验2和实验3可判断该反应是放热反应
D.实验1比实验3的平衡常数大
【解析】选A。对比实验1、2可知温度相同,起始浓度相同,平衡状态相同,但实验2达到平衡所需的时间短,反应速率快,可知实验2使用了效率更高的催化剂,故A正确;若实验2的反应容器体积减小,则相当于增大压强,最终实验1、2的平衡状态不同,故B错误;温度升高,最终平衡时,实验3的NO2浓度最小,说明平衡正向移动,正反应是吸热反应,故C错误;由C项分析,可知实验3的平衡常数大,故D错误。
18.(天津市新华中学2021~2022学年高三下学期二模)一定温度下,在容积恒为1L的容器中通入一定量N2O4,发生反应N2O4(g)2NO2(g)△H>0,体系中各组分浓度随时间(t)的变化如下表:
t/s
0
20
40
60
80
c(N2O4)/(mol/L)
0.100
0.062
0.048
0.040
0.040
c(NO2)/(mol/L)
0
0.076
0.104
0.120
0.120
下列说法正确的是( )。
A.0~60s,N2O4的平均反应速率为0.04mol/(L·min)
B.升高温度,反应的化学平衡常数值减小
C.80s时,再充入NO2、N2O4各0.12mol,平衡不移动
D.若压缩容器使压强增大,达新平衡后混合气颜色比原平衡时浅
【解析】选C。0~60s,N2O4的浓度变化量为0.100mol/L-0.040mol/L=0.060mol/L,根据v=,得v(N2O4)==0.060mol/(L·min),故A错误;该反应吸热,升高温度平衡常数增大,故B错误;该温度下,平衡常数K===0.36mol/L,再充入NO2、N2O4各0.12mol,Qc===0.36mol/L,K=Qc,平衡不移动,故C正确;该反应为气体系数之和增大的反应,压缩体积压强增大,平衡逆向进行,但是各组分浓度增加,颜色加深,故D错误。
19.(广东省深圳市龙岗区2022届高三一调)向某密闭容器中充入NO2,发生反应:2NO2(g)N2O4(g)(己知:N2O4为无色气体)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表。下列说法正确的是( )。
t/℃
27
35
49
70
NO2%
20
25
40
66
N2O4%
80
75
60
34
A.平衡时,v(NO2消耗)=2v(N2O4消耗)
B.27℃时,该平衡体系中NO2的转化率为80%
C.升高温度,该反应的化学平衡常数增大
D.温度不变,缩小容器体积,达平衡时气体颜色变浅
【解析】选A。速率比值等于化学计量数之比,平衡时,正逆反应速率相等,则平衡时,v(NO2消耗)=2v(N2O4消耗),故A正确;27℃时,该平衡体系中NO2的物质的量分数为20%,N2O4的物质的量分数为80%,设物质的量分别为0.2mol、0.8mol,则:
2NO2(g)
N2O4(g)
起始mol
1.8
0
变化mol
1.6
0.8
平衡mol
0.2
0.8
由方程式可知,转化NO2的物质的量为1.6mol,则该平衡体系中NO2的转化率为×100%≈88.9%,故B错误;由表中数据可知升高温度,NO2物质的量分数增大,N2O4物质的量分数减小,则平衡逆向移动,K值减小,故C错误;温度不变,缩小容器体积,虽然平衡正向移动,但达到新的平衡时c(NO2)还是大于原平衡时c(NO2),则达平衡时气体颜色变深,故D错误。
20.(2022·黑龙江大庆高三3月模拟)将一定量的氨基甲酸铵置于2L恒容真空密闭容器中,在一定温度下达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。不同温度下的平衡数据如下表:
温度(℃)
15
20
25
30
35
平衡时气体总浓度(×10-3mol·L-1)
2.40
3.40
4.80
6.80
9.40
下列说法正确的是( )。
A.该反应在低温条件下自发
B.氨气的体积分数不变,可以判断反应达到了平衡状态
C.其他条件不变时将容器体积变为1L,NH3平衡浓度不变
D.若25℃时达到平衡所需时间为2min,则0~2min用CO2表示的平均反应速率为4×10-4mol·L-1·min-1
【解析】选C。由表格中数据可知,温度越高,平衡气体总浓度增大,则升高温度,平衡正向移动,△H>0,由化学计量数可知△S>0,△H−T△S<0的反应可自发进行,则该反应在高温下可自发进行,故A错误;NH2COONH4(s)2NH3(g)+CO2(g),生成物中氨气与CO2始终按2∶1生成,则氨气的体积分数始终不变,不能说明该反应达到了平衡状态,故B错误;其他条件不变时将容器体积变为1L,等同于体积减小了原来的一半,单位体积内物质的量是原来物质的量的2倍,则NH3平衡浓度不变,故C正确;25℃时,平衡气体总浓度为4.8×10−3mol/L,根据反应可知CO2占,则v(CO2)==8×10-4mol·L-1·min-1,故D错误。
21.(2022年1月浙江选考化学仿真模拟试卷B)已知汽车尾气的无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。为研究某种催化剂催化测定在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s)
0
1
2
3
4
5
c(NO)(×10-3mol/L)
1.00
0.45
0.25
0.15
0.1
0.1
c(CO)(×10-3mol/L)
3.60
3.05
2.85
2.75
2.70
2.70
下列说法正确的是( )。
A.该反应在3s时达到平衡
B.前2s内的平均反应速率v(N2)=1.875×10-4mol/(L·s)
C.NO和CO的平衡转化率相同
D.平衡状态时,c(CO2)=0.9mol/L
【解析】选B。A项,从题中表中数据可得出该反应在3s时反应物浓度仍然在变化,没有达到平衡状态,故A错误;B项,前2s内NO浓度减少了7.5×10-4mol/L,因此根据方程式可知生成氮气浓度是3.75×10-4mol/L,则氮气的平均反应速率==1.875×10-4mol/(L·s),故B正确;C项,NO和CO的起始浓度不是1∶1的,而反应是按照1∶1转化的,因此平衡转化率不相同,故C错误;D项,平衡状态时消耗CO是9×10-4mol/L,则根据方程式可知平衡时c(CO2)=9×10-4mol/L,故D错误。
22.(山东市青岛市2022届高三上学期期中)在体积均为2.0L的恒容密闭容器中,发生反应Si(s)+4HCl(g)SiCl4(g)+2H2(g)△H<0。三个容器分别在一定温度下达到化学平衡状态(容器I在5min时达平衡)。下列说法正确的是( )。
容器
温度
(T1>T2)
起始时物质的量/mol
平衡时物质的量/mol
n(Si)
n(HCl)
n(SiCl4)
n(H2)
n(H2)
Ⅰ
T1
0.8
0.4
0
0
0.1
Ⅱ
T1
0.8
0.8
0
0
x
Ⅲ
T2
0
0
0.1
0.2
y
A.当温度为T1时,该反应的化学平衡常数值为0.625
B.容器I中5min内的平均反应速率v(SiCl4)=0.01mo1·L-1·min-1
C.达到平衡时,容器II中HCl的转化率比容器I中的小
D.达到平衡时,容器III中的SiCl4的转化率小于50%
【解析】选AD。温度T1时,容器Ⅰ中平衡时n(H2)=0.1mo1,c(H2)==0.05mo1·L-1,根据“三段式”有:
Si(s)
+
4HCl(g)
SiCl4(g)
+
2H2(g)
起始mol/L
0.2
0
0
变化mol/L
0.1
0.025
0.05
平衡mol/L
0.1
0.025
0.05
该反应的化学平衡常数值为K===0.625,故A正确;5min后容器Ⅰ中达到平衡,则5min内的平均反应速率:v(SiCl4)==0.005mo1·L-1·min-1,故B错误;若容器Ⅱ的体积为容器Ⅰ的2倍,则两平衡等效,HCl的转化率相同,此时将容器II体积缩小一半,则平衡正向移动,HCl的转化率增大,即容器Ⅱ中HCl的转化率比容器Ⅰ中的大,故C错误;容器Ⅲ在T1温度下达到的平衡与容器Ⅰ中形成的平衡状态相同,即平衡时SiCl4为0.025mol/L,此时SiCl4的转化率为×100%=50%,在此平衡状态的基础上降温到T2,平衡正向移动,SiCl4的转化率减小,即平衡时,容器III中的SiCl4的转化率小于50%,故D正确。
23.(天津市和平区2022年高三4月模拟)SO2、NOx是主要的大气污染物。某研究小组采用微生物法同时脱硫脱硝(细菌生存的最佳温度为30~45℃,pH为6.5~8.5),研究结果表明pH对脱硫、脱硝效果的影响如图1所示。该小组采用催化反应法研究时,发现NH3和NO在Ag2O催化剂表面反应时,相同时间条件下,NO生成N2的转化率随温度的变化关系如图2所示。下列说法错误的是( )。
A.从图1中可以看出,采用微生物治理法时应选择的最佳pH是8
B.图1中pH过大时,细菌活性迅速降低,脱硝效率明显下降
C.图2中,在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是:NO与O2反应生成NO2,NO2更易与NH3反应
D.图2中,在有氧条件下,温度580K之后NO生成N2的转化率降低是因为Ag2O催化剂活性下降
【解析】选A。由图1可知采用微生物治理法时,应选择的最佳pH约为7.5,故A错误;由图象可知,pH过大时,超过细菌生存的最佳pH环境,细菌的活性减弱,则脱硝效率明显下降,与细菌活性迅速降低有关,故B正确;在温度为420∼580K时,有氧条件下NO与O2反应生成NO2,NO2氧化性更强,更易与NH3反应,NO生成N2转化率明显高于无氧条件,故C正确;在有氧条件下,温度580K之后NO生成N2的转化率降低,与催化剂的活性有关,Ag2O催化剂活性下降,故D正确。
24.(2022·河南郑州一模)用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4作内相酸处理含铜废水。在其他条件相同时,Cu2+萃取率[萃取率=×100%]与初始Cu2+浓度关系如图1所示;在其他条件相同时,处理前初始Cu2+浓度为200mg·L-1,Cu2+萃取率与废水pH的关系如图2所示。下列说法错误的是( )。
A.根据图1可知,废水中初始Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图2可知,废水初始pH>2时,去除Cu2+的效果较好
C.根据图1可知,Cu2+初始浓度为200mg·L-1时,Cu2+的萃取率为97.0%
D.根据图2可知,若取800mL初始Cu2+浓度为200mg·L-1的废水,在pH=1.5时处理废水,则处理后的废水中剩余Cu2+的物质的量为1.5×10-3mol(假设体积不变)
【解析】选AD。根据图1可知,Cu2+萃取率随初始Cu2+浓度的增大而减小,故A错误;根据图2可知,废水初始pH>2时,去除Cu2+的效果较好,故B正确;根据图1可知,Cu2+初始浓度为200mg·L-1时,Cu2+的萃取率为97.0%,故C正确;根据图2可知,若取800mL初始Cu2+浓度为200mg·L-1的废水,n(Cu2+)处理前==2.5×10-3mol,在pH=1.5时处理废水,萃取率为60%,则除去的n(Cu2+)处理=2.5×10-3mol×60%=1.5×10-3mol,则处理后的废水中剩余Cu2+的物质的量为n(Cu2+)处理后=n(Cu2+)处理前-n(Cu2+)处理=2.5×10-3mol-1.5×10-3mol=1×10-3mol,故D错误。
25.(安徽省滁州市2021~2022学年高三下学期开学考)某研究小组,在某恒容密闭容器中,在不同温度(T1>T2)下进行储氢合金储氢过程的探究。平衡时,氢气的压强(p)与固相中氢原子与金属原子(M)的个数比[]的关系如图:
已知:①OA(或OA′)段:M(s)+H2(g)MHx(s) △H1(I)
②AB(或A′B′)段:zMHx(s)+H2(g)zMHy(s) △H2(II)
③在B或B′点,氢化反应结束,进一步增大氢气压强,的值变化较小。下列说法正确的是( )。
A.反应I、II均为△S>0的反应
B.平衡常数:K(c)<K(a)=K(b)
C.该储氢合金可通过升温或减压的方式释放H2
D.由a点移到d点,需在恒温恒容条件下通入少量氢气
【解析】选BC。反应I、II均是反应物有气体物质,生成物是固体,系统无序度下降,均为ΔS<0的反应,A错误;平衡常数只与温度有关,a、b点均在T2温度下,K(a)=K(b),题给信息T1>T2,由图可知,T1温度下氢气压强更大,体系平衡朝逆向移动,平衡常数K减小,故平衡常数:K(c)<K(a)=K(b),B正确;该储氢过程是放热过程,且体系压强下降,故该储氢合金可通过升温或减压的方式释放氢气,C正确;图中a点表示反应II处于化学平衡状态,向恒容密闭容器中,通入少量氢气,化学平衡正向移动,的值增大,达到新的化学平衡后,p(H2)增大,Kp=减小,而恒温下平衡常数应保持不变,所以在恒温恒容条件下通入少量氢气反应不可能处在d点,D错误。
26.(山东师大附中2022年11月高三学业质量检测)已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按w=向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w的关系,图乙表示正、逆反应的平衡常数与温度的关系,则下列说法错误的是( )。
A.图甲中,w2>1
B.图乙中,A线表示正反应的平衡常数
C.温度为T1、w=2时,Cl2的平衡转化率为50%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
【解析】选BC。其他条件不变,增大氯气的用量,平衡向右移动,丙烯的体积分数减小,因此,w2>1,故A正确。从图甲知,升高温度时,丙烯的体积分数增大,说明升高温度时平衡向左移动,该反应是放热反应。所以,升温时,逆反应的平衡常数增大,图乙中的A线表示逆反应的平衡常数,故B不正确。从图乙知,温度为T1时,正反应和逆反应的平衡常数都是1,w=2时,设丙烯的起始浓度为1,则氯气的起始浓度为2,丙烯的浓度减小了x,丙烯的平衡浓度为(1-x),氯气的平衡浓度为(2-x),一氯丙烯和氯化氢的平衡浓度都是x,列出方程:=1,解得:x=,所以,氯气的转化率为:×100%≈33.3%,故C不正确。正反应是放热反应,若在恒容绝热装置中进行上述反应,反应进行中容器内的温度升高,混合气体的总物质的量不变,根据PV=nRT,则气体的压强增大,故D正确。
27.(2022·河北张家口高三4月模拟)丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)C4H8(g)+H2(g)ΔH=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
下列分析正确的是( )。
A.随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
B.丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C.氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
D.一定温度下,控制进料比[]越小,越有利于提高丁烯的产率
【解析】选A。由图2可知,随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率,故A正确;由图可知,平衡后升高温度产率降低,则升高温度平衡逆向移动,则正反应为放热反应,故B错误;增大或减少氢气的量,平衡均发生移动,均影响丁烯的产率,故C错误;由1可知,一定温度下,控制进料比[]在1.5左右,有利于提高丁烯的产率,越小或越大均不利于产率的增大,故D错误。
28.(2022·云南玉溪3月模拟)一定条件下,反应:6H2(g)+2CO2(g)C2H5OH(g)+3H2O(g)的数据如图所示。
下列说法正确的是( )。
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
【解析】选D。由图象可知,升高温度,CO2的平衡转化率降低,平衡逆向移动,所以该反应为放热反应,故A错误;达平衡时,正逆反应速率比等于系数比,即v正(H2)=3v逆(CO2),故B错误;正反应放热,升高温度,平衡常数减小,b点对应的平衡常数K值小于c点,故C错误;曲线ⅠH2、CO2的投料比为2∶1,设投入H2、CO2的物质的量分别是2mol、1mol,a点CO2的平衡转化率为60%,则消耗CO20.6mol、消耗H21.8mol,所以a点对应的H2的平衡转化率为×100%=90%,故D正确。
29.(2022·山东济宁3月模拟)SCR法是工业上消除氮氧化物的常用方法,主要反应如下:
4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) ΔH
相同条件下,在甲、乙两种催化剂作用下进行上述反应,下列说法错误的是( )。
A.工业上选择催化剂乙的原因是低温下有很强的催化活性
B.投料比一定时有利于提高NO平衡转化率的反应条件是降低温度、减小压强
C.图中M点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率
D.相同条件下选择高效催化剂,可以提高NO的平衡转化率
【解析】选D。由图可知,相同温度下,催化剂乙作用下NO转化率远大于催化剂甲,故工业上选择催化活性更高的催化剂乙,A项正确。催化剂一定时,达到平衡后,随着温度升高,NO转化率减小,说明该反应是放热反应,且该反应的正向是气体总分子数增大的反应,故降低温度、减小压强,有利于平衡正向移动,提高NO平衡转化率,B项正确。M点对应温度下,催化剂乙存在时NO转化率大于M点,而催化剂对平衡无影响,故M点NO的转化率不是该温度下的平衡转化率,C项正确。相同条件下,选择高效催化剂,可加快反应速率,但不能使平衡移动,故不能改变NO的平衡转化率,D项错误。
30.(吉林长春2022~2023学年高三11月调研)甲醇-水蒸气重整法所得氢气是电动汽车燃料电池的理想氢源。反应的热化学方程式如下:
反应Ⅰ:CH3OH(g)+H2O(g)CO2(g)+3H2(g)△H1=49kJ•mol-1
反应Ⅱ:CH3OH(g)CO(g)+2H2(g)△H2
CO会损害燃料电池的交换膜。在压强、CH3OH和H2O的起始浓度一定的条件下,催化反应相同时间,测得不同温度下,CH3OH的转化率、H2的产率和CO的物质的量如图中实线所示(图中虚线表示相同条件下达平衡状态时的变化)。已知:CO的选择性=×100%。下列说法正确的是( )。
A.△H2<0
B.210℃升温至270℃时,反应Ⅰ的活化能增大
C.温度升高,反应Ⅰ的速率比反应Ⅱ增加的更多
D.温度升高,n(CO)的实际值与平衡值相差越来越大,原因是催化剂对CO的选择性升高
【解析】选C。由图可知,随着温度的升高,CO的物质的量增大,说明升高温度,反应Ⅱ正向移动,则反应Ⅱ为吸热反应,△H2>0,故A错误;升高温度可以增加活化分子百分数,从而加快反应速率,但不能改变反应的活化能,则210℃升温至270℃时,反应Ⅰ的活化能不变,故B错误;由图可知,升高温度CO物质的量增大的不明显,但CH3OH的转化率明显增大,说明温度升高,反应Ⅰ的速率比反应Ⅱ增加的更多,故C正确;由图可知,温度升高,n(CO)的实际值与平衡值相差越来越大,但CH3OH的转化率明显增大,说明反应物更多地进行反应Ⅰ,催化剂对CO的选择性降低,故D错误。
【新高考】2023年高考化学二轮题型精讲精练——专题29 无机化工流程综合分析: 这是一份【新高考】2023年高考化学二轮题型精讲精练——专题29 无机化工流程综合分析,文件包含新高考2023年高考化学二轮题型精讲精练专题29无机化工流程综合分析教师版docx、新高考2023年高考化学二轮题型精讲精练专题29无机化工流程综合分析学生版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
【新高考】2023年高考化学二轮题型精讲精练——专题22 沉淀溶解平衡及图像分析: 这是一份【新高考】2023年高考化学二轮题型精讲精练——专题22 沉淀溶解平衡及图像分析,文件包含新高考2023年高考化学二轮题型精讲精练专题22沉淀溶解平衡及图像分析教师版docx、新高考2023年高考化学二轮题型精讲精练专题22沉淀溶解平衡及图像分析学生版docx等2份试卷配套教学资源,其中试卷共51页, 欢迎下载使用。
【新高考】2023年高考化学二轮题型精讲精练——专题21 电解质溶液图像分析: 这是一份【新高考】2023年高考化学二轮题型精讲精练——专题21 电解质溶液图像分析,文件包含新高考2023年高考化学二轮题型精讲精练专题21电解质溶液图像分析教师版docx、新高考2023年高考化学二轮题型精讲精练专题21电解质溶液图像分析学生版docx等2份试卷配套教学资源,其中试卷共42页, 欢迎下载使用。












