




【新高考】2023年高考化学二轮题型精讲精练——专题34 晶体结构及相关计算
展开专题34 晶体结构及相关计算
目录
一、热点题型归纳……………………………………………………………………………………………………1
【题型一】晶体的结构分析…………………………………………………………………………………………1
【题型二】晶胞密度的计算…………………………………………………………………………………………4
【题型三】微粒间距的计算…………………………………………………………………………………………8
【题型四】空间利用率计算…………………………………………………………………………………………12
二、最新模考题组练…………………………………………………………………………………………………14
【题型一】晶体的结构分析
【典例分析】
【典例1】(2022·山东省等级考)Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是( )。
A.每个Cu2-xSe晶胞中Cu2+个数为x
B.每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为8
C.每个NaCuSe晶胞中0价Cu原子个数为1-x
D.当NayCu2-xSe转化为NaCuSe时,每转移(1-y)mol电子,产生(1-x)mol Cu原子
【提分秘籍】
1.典型的晶体结构
(1)金属晶体的四种堆积方式
堆积名称
面心立方
最密堆积
体心立
方堆积
六方最
密堆积
简单立
方堆积
晶胞结构
堆积类型
A1型或铜型
A2型或钾型
A3型
或镁型
Po型
堆积方式
…ABCABC…
…ABAB…
配位数
12
8
12
6
空间利用率
74%
68%
74%
52%
典型代表
Cu、Ag、Au
Na、K、Fe
Mg、Zn、Ti
Po
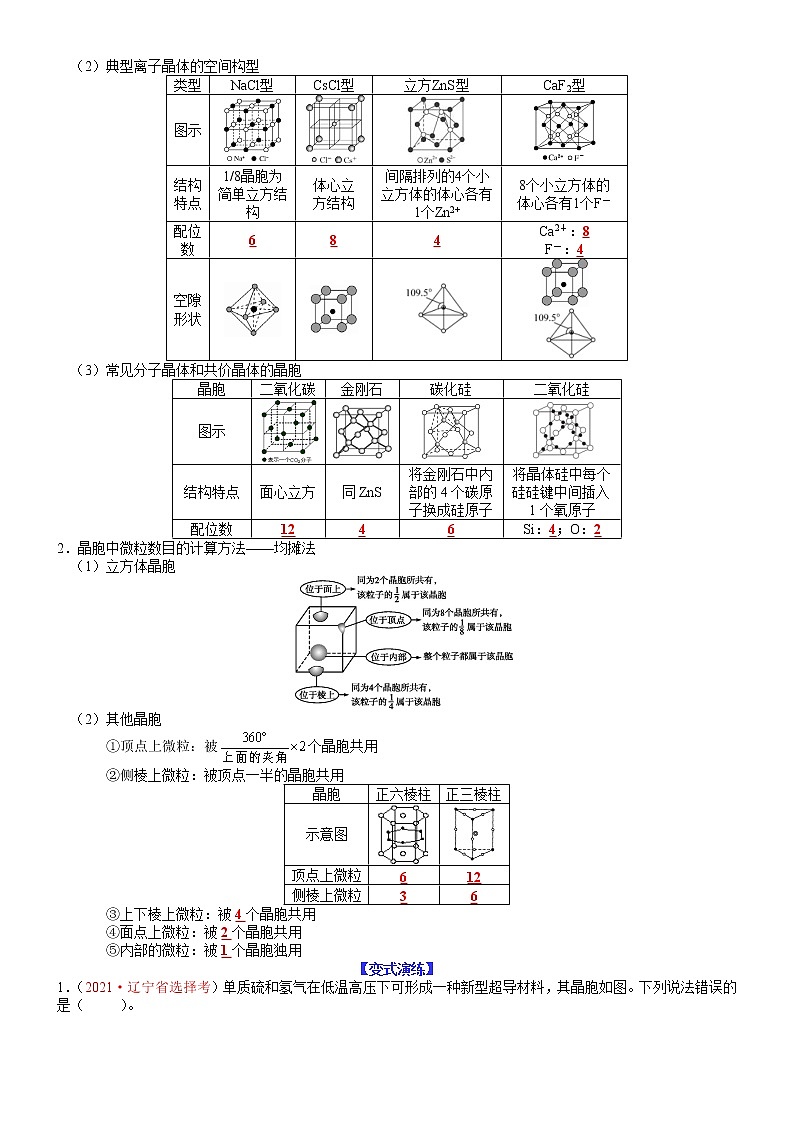
(2)典型离子晶体的空间构型
类型
NaCl型
CsCl型
立方ZnS型
CaF2型
图示
结构特点
1/8晶胞为简单立方结构
体心立
方结构
间隔排列的4个小立方体的体心各有1个Zn2+
8个小立方体的
体心各有1个F-
配位数
6
8
4
Ca2+:8
F-:4
空隙形状
(3)常见分子晶体和共价晶体的晶胞
晶胞
二氧化碳
金刚石
碳化硅
二氧化硅
图示
结构特点
面心立方
同ZnS
将金刚石中内部的4个碳原子换成硅原子
将晶体硅中每个硅硅键中间插入1个氧原子
配位数
12
4
6
Si:4;O:2
2.晶胞中微粒数目的计算方法——均摊法
(1)立方体晶胞
(2)其他晶胞
①顶点上微粒:被个晶胞共用
②侧棱上微粒:被顶点一半的晶胞共用
晶胞
正六棱柱
正三棱柱
示意图
顶点上微粒
6
12
侧棱上微粒
3
6
③上下棱上微粒:被4个晶胞共用
④面点上微粒:被2个晶胞共用
⑤内部的微粒:被1个晶胞独用
【变式演练】
1.(2021·辽宁省选择考)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )。
A.S位于元素周期表p区
B.该物质的化学式为H3S
C.S位于H构成的八面体空隙中
D.该晶体属于分子晶体
2.(2021·湖北省选择考)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )。
A.该晶胞的体积为a3×10-36cm-3
B.K和Sb原子数之比为3∶1
C.与Sb最邻近的K原子数为4
D.K和Sb之间的最短距离为apm
3.(2021年1月高三八省联考湖北卷)已知NixMg1-xO晶体属立方晶系,晶胞边长a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。
假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )。
A.该结构单元中O原子数为3
B.Ni和Mg间的最短距离是
C.Ni的配位数为4
D.该物质的化学式为Li0.5Mg1.12Ni2.38O4
4.(2021年1月高三八省联考辽宁卷)我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是( )。
A.11BN和10BN的性质无差异
B.该晶体具有良好的导电性
C.该晶胞中含有14个B原子,4个N原子
D.N原子周围等距且最近的N原子数为12
【题型二】晶胞密度的计算
【典例分析】
【典例2】(2022·湖南省等级考)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为_______;
②Fe原子的配位数为_______;
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_______ g•cm-3(列出计算式)。
【提分秘籍】
1.密度公式:ρ==
2.晶胞的体积
几何体
图示
计算公式
立方体
V=a3
长方体
V=abc
正三棱柱
V=a2hsin60°=
正六棱柱
V=6×a2hsin60°=
正四面体
S=,h=,V=
平行六面体
S=ab×sinα
h=csinβ
V=abcsinαsinβ
3.单位换算
(1)1pm=10-12m=10-10cm
(2)1nm=10-9m=10-7cm
(3)1μm=10-6m=10-4cm
【变式演练】
1.(2022·北京市等级考)FeS2晶胞为立方体,边长为anm,如图所示。与Fe2+紧邻的阴离子个数为___________。晶胞的密度为=_____g·cm-3。(1nm=10-9m)
2.(2021·湖南省选择考)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①己知化合物中Ge和O的原子个数比为1∶4,图中Z表示_______原子(填元素符号),该化合物的化学式为_______;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm,==γ=90°,则该晶体的密度=_______ g•cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
3.(2021·广东省选择考)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是__________________。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_________;该晶胞中粒子个数比Hg∶Ge∶Sb=_________。
③设X的最简式的式量为Mr,则X晶体的密度为________g/cm3(列出算式)。
4.(2021·河北省选择考)分别用○、●表示H2PO4-和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO4-、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA,晶体的密度____________g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为_______(填标号)。
5.(2021·全国甲卷)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为____________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=________(用x表达)。
6.(2020·全国Ⅱ卷)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH3+,其晶胞如图(b)所示。其中Pb2+与图(a)中____的空间位置相同,有机碱CH3NH3+中,N原子的杂化轨道类型是_____;若晶胞参数为anm,则晶体密度为______g·cm-3(列出计算式)。
7.(2018·全国卷Ⅲ)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________________。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为_____g·cm-3(列出计算式)。
【题型三】微粒间距的计算
【典例分析】
【典例3】(2022·广东省等级考)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
①X的化学式为_______。
②设X的最简式的式量为,晶体密度为g•cm-3,则X中相邻K之间的最短距离为_______ nm(列出计算式,NA为阿伏加德罗常数的值)。
【提分秘籍】
1.晶体中某些几何体中的数量关系(晶胞参数为a)
(1)立方体晶胞:边长和体对角线及面对角线的关系
(2)面心立方晶胞:相邻的两个面心间的距离和边长的关系
(3)立方体套正四面体晶胞:最近的黑球和白球间的距离
(4)正四面体中各量的关系
①直角三角形BEC中:(BC)2=(CE)2+(BE)2
②BO=BE,OE=BE
③直角三角形AOB中:(AB)2=(BO)2+(AO)2
2.某些晶胞中微粒间的最短距离(晶胞参数为a)
类型
图示
最近距离
NaCl型
阴阳离子间:a
同号离子间:
CsCl型
阴阳离子间:
同号离子间:a
立方ZnS型
阴阳离子间:
同号离子间:
CaF2型
阴阳离子间:
同号离子间:
二氧化碳型
微粒间最近距离:
金刚石型
微粒间最近距离:
【变式演练】
1.(2022·全国甲卷)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______;若该立方晶胞参数为apm,正负离子的核间距最小为_______pm。
2.(2021·山东省等级考)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有____个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(,,)。已知Xe-F键长为rpm,则B点原子的分数坐标为_________;晶胞中A、B间距离d=_________pm。
3.(2020·海南高考)X的晶胞结构如图所示(晶胞参数:α=β=γ=90º,a=b=450.25pm),密度为1.4g·cm-3,H-的配位数为______________,X的储氢质量分数是______________,c=___________pm(列出计算式即可)。
4.(2018·全国卷Ⅱ)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为________nm。
5.(2017•全国卷乙节选)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。
(1)K与O间的最短距离为______nm,与K紧邻的O个数为______。
(2)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
6.(2017•全国卷丙)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为____________nm。MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为____________nm。
【题型四】空间利用率计算
【典例分析】
【典例4】(2021·全国乙卷)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是_______原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为_______%(列出计算表达式)。
【提分秘籍】
1.空间利用率=×100%=×100%
(1)原子的体积:V V0=πr3(r为原子半径)
(2)晶胞体积
①根据晶胞参数计算:①V=Sh;②V锥=Sh
②根据密度计算:V=
2.金属晶体原子半径(r)和晶胞参数(a)的关系
(1)面心立方:面对角线上的三个原子相切:4r=a
(2)体心立方:体对角线上的三个原子相切:4r=a
(3)简单立方:侧面上的原子两两相切:2r=1a
(4)六方最密:正四面体相邻原子两两相切:2r=1a
3.晶体摩尔体积的计算:Vm===
【变式演练】
1.(2022·全国乙卷)-AgI晶体中I-离子作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,-AgI晶体在电池中可作为_______________。
已知阿伏加德罗常数为NA,则-AgI晶体的摩尔体积Vm=_______ m3/mol(列出算式)。
2.(2016·全国卷III)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________。
3.(2014·海南高考)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a。根据硬球接触模型,则r=______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
1.(湖南省常德市2023届高三上学期期中)在照相底片定影时,Na2S2O3溶液能溶解未起反应的AgBr,这是因为Ag+与S2O32-生成配离子,Ag+的配位数为2。下列说法不正确的是( )。
A.Ag+与S2O32-结合成配离子,使反应AgBr(s)Ag+(aq)+Br-(aq)平衡向右移动
B.上述反应生成配合物的化学方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr
C.Ag+与S2O32-反应时,Ag+提供空轨道,S2O32-提供孤电子对,二者通过配位键结合
D.如图为单质银的晶胞(面心立方最密堆积),银原子的配位数为6
2.(唐山市2022~2023学年度高三年级摸底演练)下列叙述正确的是( )。
A.NCl3、BCl3和HCl分子中所有原子的最外层都达到8电子稳定结构
B.P4和CH4都是正四面体分子且键角都为109.5°
C.NO3-和CO32-是等电子体,均为平面正三角形结构
D.金属镁采取的是六方最密堆积,晶胞结构如上图所示,配位数为12
3.(湖南省三湘创新发展联合2022~2023学年高三上学期起点调研)高压不仅会引发物质的相变,还会导致新类型化学键的形成。如图所示,M、N、P为Na与FeCl2在50~300GPa的高压下反应生成的不同晶体晶胞,下列说法错误的是( )。
A.三种晶胞的化学式均为NaCl
B.晶胞M中与Na原子距离最近且等距的Cl原子有12个
C.晶胞M、N、P中所含Cl原子的个数之比为3∶1∶1
D.2号的原子坐标为(,,)
4.(湖南永州市2023年高考第一次适应性考试)河蚌的壳外层主要成分为方解石,内层主要是霰石,两者成分都是碳酸钙,但晶体结构不同,称为“同质多象”现象,金刚石和石墨也属于同质多象现象。霰石光滑,结构中每个Ca2+周围围绕着6个CO32-,方解石坚硬,晶胞结构如图。下列说法错误的是( )。
A.霰石晶体中每个CO32-周围有6个Ca2+
B.霰石和方解石中的CO32-均为平面三角形结构
C.霰石和方解石的熔点相同
D.方解石晶体结构图的平行六面体中含有2个Ca2+、2个CO32-
5.(2022·湖北七市高三3月联合调研)砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法错误的是( )。
A.砷化镉中Cd与As原子个数比为3∶2
B.两个Cd原子间最短距离为0.5apm
C.③号位原子坐标参数(,1,)
D.该晶胞的密度为g·cm-3
6.(重庆市育才中学2023届高三上学期期中)在800℃下B12与As4单质可发生化学反应制备具有超高热导率半导体材料--BAs晶体。下列说法错误的是( )。
A.图(a)表示As4结构,As4分子中成键电子对数与孤对电子数之比为3∶1
B.图(b)表示单质硼晶体B12的基本结构单元,该基本单元为正二十面体
C.图(b)所示单质硼晶体的熔点为2180℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,若晶胞参数为a nm,则BAs晶体密度为g·cm-3
7.(广东省2023届高三11月大联考)钙钛矿类杂化材料(CH3NH3)PbI3在太阳能电池领域具有重要的应用价值,其晶胞结构如图1所示,B代表Pb2+,A的原子分数坐标为(0,0,0),B的为(,,)。设NA为阿伏加德罗常数的值,下列说法中错误的是( )。
A.N、I、Pb均属于p区元素
B.C的原子分数坐标为(,1,)
C.该晶体的密度为g/cm3
D.若沿z轴向xy平面投影,则其投影图如图2所示
8.(2023年1月浙江省选考仿真模拟卷C)某种新型储氢材料的晶胞如图(是一种金属硼氢化物氨合物),八面体中心为金属离子M2+,顶点均为配体NH3;四面体中心为硼原子,顶点均为氢原子。该晶体属立方晶系,晶胞棱边夹角均为90°,棱长为apm,阿伏加德罗常数的值为NA。下列说法错误的是( )。
A.金属离子M2+的配位数为6
B.该晶体的化学式为M(NH3)6(BH4)2
C.若该晶体的摩尔质量为196g•mol-1,则0.5mol•L-1MSO4溶液呈深蓝色
D.金属离子M2+与硼原子间最短距离为a×10-10cm
9.(温州市普通高中2023届高三第一次适应性考试)冰的晶胞结构如图所示。下列相关说法不正确的是( )。
A.晶胞中z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键的长为d
B.冰晶体中,相邻的水分子间皆以氢键结合
C.冰密度比干冰的小,主要是因为冰晶体分子间的氢键存在方向性、饱和性
D.硫化氢晶体结构与冰相似
10.(山东威海乳山市2022~2023学年高三上学期期中)磷钇矿是提取钇的重要矿物原料,某磷钇矿的四方晶胞如图所示。下列说法错误的是( )。
A.该晶体的化学式为YPO4
B.PO43-中磷原子采用sp3杂化
C.距离钇原子为的PO43-有6个
D.晶胞参数a等于钇和磷酸根直径之和
11.(2022·广东惠州4月模拟)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为________(用含ρ、a的代数式表示,相对原子质量:Cu-64,Cl-35.5)。
12.(2022·河北张家口一模)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为NA,则MgCu2的密度是_______g/cm3(列出计算表达式)。
13.(2022·郑州第二次质量预测)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为__________g·cm-3(列式即可,不必化简)。
14.(2022·湖北省重点高中联考)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的AlH4-有______个,设阿伏伽德罗常数为NA,则晶体的密度为_________g·cm-3。
15.(2022·河北邢台一模)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:
已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____________g·cm-3(用含NA、a、b的式子表示)。
16.(宁夏大学附中2022届高三上学期期中)Cu与Cl形成化合物的晶胞如图所示。
该晶体的化学式为___________。已知该晶体中Cu原子和Cl原子之间的最短距离为acm,且恰好为体对角线的,阿伏加德罗常数为NA,则该晶体的密度为_______g•cm-3(只写计算式)。
17.(吉林梅河口2022年高三第三次模拟)钪晶体的晶胞如图所示,已知钪晶胞底边边长为apm,高为bpm,NA表示阿伏加德罗常数的值,则钪晶体的密度为______________g/cm3(只列出计算式)。
18.(安徽省淮南市2022年高三3月模拟)Ca和B可以形成一种离子型簇合物,晶胞结构如图,其化学式为________,若其晶胞边长为apm,则其密度的计算式为ρ=________g•cm-3(阿伏伽德罗常数用NA表示)。
19.(江西省新余市2022届高三上学期期末)InSb晶体晶胞为立方晶胞(如图1),晶胞参数为631pm,Sb位于顶点和面心,In位于Sb原子构成的四面体的体心。InSb晶体常用作金属锂的镶嵌材料,某种镶嵌锂之后的晶胞如图2,晶胞参数为664pm(“”代表锂原子)。
①图1所示晶胞中,距离最近的两个In原子间的距离为______pm。(已知≈1.4)
②图2所示晶胞的密度为___________g·cm-3。(列出计算式即可
20.(福建省厦门市2021~2022高三1月质检)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___________,晶胞参数为428pm,则晶体密度为_______g•cm-3(NA表示阿伏加德罗常数的值,列出表达式)。
21.(辽宁省辽阳市2022届高三第一次模拟)传统锂电池的主要成分是LiCoO2,其晶胞结构如图所示;因结构中存在笼状空隙,可以与Ni和Mn发生位置替换,形成储电性能更加优良的化合物LiNiCoMnO2。
基态Co原子的价电子排布式为_____________;化合物LiCoO2中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________。已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O=e,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________(用含有a、b、c、d、e、m、n的式子表示)。
22.(2022·广西崇左高三3月调研)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
(1)该铜银合金的化学式是___________________。
(2)已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
(3)若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=×100%)
23.(2022~2023学年内蒙古巴彦淖尔高三12月模拟)短周期B原子核外电子有6种不同的运动状态,B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为__________;另一种的晶胞如图二所示,该晶胞的空间利用率为__________。(=1.732)
24.(2022·湖南郴州二模)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为×2rnm,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
25.(2022·四川攀枝花高三3月模拟)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
26.(2022·汕头高三3月模拟)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于__________,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为________________(用含π的代数式表示)。
27.(2022~2023学年福建漳州高三11月模拟)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量计算式为___________。
28.(安徽省六安市2022届高三第二次模拟)超硬材料(仅次于金刚石)氮化铂的一种晶胞如图所示,N的配位数是______,若该晶胞的边长为apm,晶胞的密度为g/cm3,则阿伏加德罗常数(NA)为_________ mol-1(用a、表示,并化成最简)。
29.(2022·重庆5月调研)GaAs为共价晶体,密度为ρg•cm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加德罗常数的值为NA=_______________。(用字母表示)
30.(甘肃张掖2021~2022学年高三上学期质检)钛晶体的一种晶胞,如图所示:
已知图中六棱柱边长为xcm,高为ycm。该钛晶胞密度为Dg·cm-3,NA为______mol-1(用含x、y和D的式子表示)。
31.(重庆四校2021~2022学年12月联考)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和由3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g·cm-3,则该晶胞参数a=_________cm(写出计算表达式即可)。
32.(黄山市2022届高中毕业班第一次质量检测)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:___,若晶胞参数为bnm,阿伏加德罗常数的值为NA,则Li2O的密度为_________g·cm-3(列出计算式即可),O2-和Li+的最短距离等于________nm(用含b的代数式表示)。
33.(安徽省皖南八校2022届高三下学期第三次联考)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2-均与Ti4+、Ba2+相接触),已知O2-的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为_______pm、_______pm。
34.(河南省名校联盟2021~2022学年高三1月联考)碳的一种同素异形体--石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为______个。已知石墨的密度为ρg·cm-3,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为______cm。
35.(2021~2022学年天津高三上期中检测)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(,,0),则E原子的坐标参数为__________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为__________pm(只列计算式)。已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为__________pm(已知正六边形面积为a2,a为边长)。
微题型02 晶体结构及相关计算-2024年高考化学二轮热点题型归纳与变式演练(新高考通用): 这是一份微题型02 晶体结构及相关计算-2024年高考化学二轮热点题型归纳与变式演练(新高考通用),文件包含微题型02晶体结构及相关计算原卷版docx、微题型02晶体结构及相关计算解析版docx等2份试卷配套教学资源,其中试卷共77页, 欢迎下载使用。
【新高考】2023年高考化学二轮题型精讲精练——专题32 有机推断及合成: 这是一份【新高考】2023年高考化学二轮题型精讲精练——专题32 有机推断及合成,文件包含新高考2023年高考化学二轮题型精讲精练专题32有机推断及合成教师版docx、新高考2023年高考化学二轮题型精讲精练专题32有机推断及合成学生版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
【新高考】2023年高考化学二轮题型精讲精练——专题19 化学平衡常数的计算: 这是一份【新高考】2023年高考化学二轮题型精讲精练——专题19 化学平衡常数的计算,文件包含新高考2023年高考化学二轮题型精讲精练专题19化学平衡常数的计算教师版docx、新高考2023年高考化学二轮题型精讲精练专题19化学平衡常数的计算学生版docx等2份试卷配套教学资源,其中试卷共43页, 欢迎下载使用。












